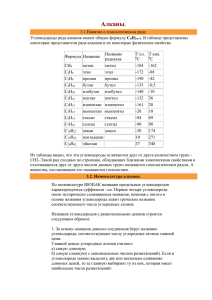
АЛКАНЫ Алканы В молекулах алканов между углеродными атомами только простые связи, которые соединены с максимально возможным числом атомов водорода (4), т.е. связи насыщены до предела. Поэтому такие углеводороды называются предельными или насыщенными. CnH2n+2 алкан с самой длинной молекулой (синтезирован в 1985) АЛКАНЫ = ПАРАФИНЫ (исторически сложившееся название) Гомологи Гомологи – вещества, сходные по строению и свойствам и отличающиеся друг от друга по составу на одну или несколшько групп СН2 Гомологический ряд – это ряд гомологов в порядке возрастания атогмных масс СН4 метан C6H14 гексан С2H6 этан C7H16 гептан C3H8 пропан C8H18 октан C4H10 бутан C9H20 нонан C5H12 пентан C10H22 декан Изомерия Изомеры – это вещества, которые имеют один и тот же качественный составы, но отличаются по своему строению и свойствам. Для алканов характерна изомерия углеродного скелета или структурная изомерия Структурная изомерия пентана C5H12 : CH3 - CH2 - CH2 - CH2 - CH3 или CH3 – CH - CH2 - CH3 │ CH3 Число атомов углерода Название числа Формула радикала Название радикала 1 Моно- -СН3 Метил 2 Ди- -С2Н5 Этил 3 Три- -С3Н7 Пропил 4 Тетра- -С4Н9 Бутил 5 Пента- -С5Н11 Пентил Изомеризация алканов Алканы в природе Метан (болотный газ) образуется в результате разложения растительных и животных остатков без доступа воздуха. Может накапливаться в угольных шахтах, содержится в природном газе и попутных нефтяных газах Метан и этан содержатся в атмосфере планет Солнечной системы: Юпитера, Сатурна, Урана, Нептуна. Кроме того, метан найден в хвосте комет и в метеоритах. Физические свойства Алканы количеством атомов углерода от 1 до 4 газы Алканы с числом атомов углерода от 5 до 15 – жидкости Алканы с числом атомов углерода более 16- твердые вещества С увеличением молекулярных масс повышаются температуры кипения и плавления предельных углеводородов Все алканы легче воды, в воде не растворяются, но растворяются в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями Изомеризация алканов Алканы — химически наименее активные органические соединения. Коновалов: «Алканы – химические мертвецы» Реакции алканов: замещения разложения дегидрирования окисления Реакции замещения- реакции, идущие с разрывом С-Н связей 1. Галогенирование н Реакции разложения при температуре В отличие от пиролиза крекинг протекает при более низких температурах, и разрушения молекулы углеводорода менее глубокие, чем при пиролизе. Крекинг алканов: алкан алкан с более короткой цепью + алкен В результате крекинга получается алкан с длиной цепи ~ в 2 раза короче, чем исходного алкана. Получение алканов 1926г. Фишер,Тропш Получение алканов Из ненасыщенных углеводородов (гидрирование): катализаторы - Pt,Ni ; CnH2n + H2 CnH2n+2 Из галогенопроизводных (реакция Вюрца). R–Hal + 2Na + R–Hal R–R + 2NaHal Из солей карбоновых кислот: СН3 COONa + NaOH Na2CO3 + CH4↑ Прямой синтез из углерода и водорода (400-500ºC, Ni): С + 2Н2 СН4 Из карбида алюминия: Hal - галоген Al4C3 + 12H2O 4Al(OH)3 + 3CH4↑ Применение алканов Алканы являются главным источником органического химического сырья для промышленности. Получение растворителей Получение ацетилена (для сварки) Горючее для дизельных и турбореактивных двигателей Сырьё для синтезов спиртов, альдегидов, кислот. Производство сажи (картриджи; резина; типографическая краска)