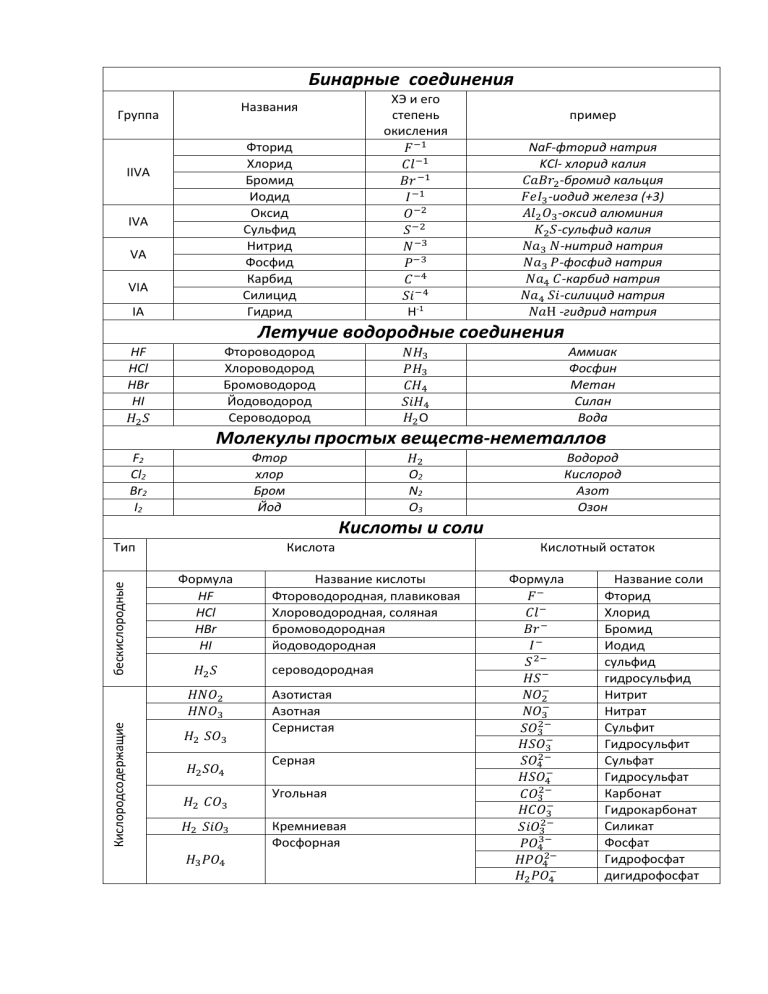
Бинарные соединения ХЭ и его степень окисления 𝐹 −1 𝐶𝑙 −1 𝐵𝑟 −1 𝐼 −1 𝑂 −2 𝑆 −2 𝑁 −3 𝑃−3 𝐶 −4 𝑆𝑖 −4 Н-1 Названия Группа Фторид Хлорид Бромид Иодид Оксид Сульфид Нитрид Фосфид Карбид Силицид Гидрид IIVА IVА VА VIА IА пример NaF-фторид натрия KCl- хлорид калия 𝐶𝑎𝐵𝑟2 -бромид кальция 𝐹𝑒𝐼3-иодид железа (+3) 𝐴𝑙2 𝑂3 -оксид алюминия 𝐾2 𝑆-сульфид калия 𝑁𝑎3 𝑁-нитрид натрия 𝑁𝑎3 𝑃-фосфид натрия 𝑁𝑎4 𝐶-карбид натрия 𝑁𝑎4 𝑆𝑖-силицид натрия 𝑁𝑎Н -гидрид натрия Летучие водородные соединения НF НCl HBr НI 𝐻2 𝑆 Фтороводород Хлороводород Бромоводород Йодоводород Сероводород Аммиак Фосфин Метан Силан Вода 𝑁𝐻3 𝑃𝐻3 𝐶𝐻4 𝑆𝑖𝐻4 𝐻2 O Молекулы простых веществ-неметаллов F2 Cl2 Br2 I2 Фтор хлор Бром Йод Водород Кислород Азот Озон 𝐻2 О2 N2 О3 Кислоты и соли бескислородные Тип Кислота Формула НF НCl HBr НI 𝐻2 𝑆 Кислородсодержащие 𝐻𝑁𝑂2 𝐻𝑁𝑂3 𝐻2 𝑆𝑂3 𝐻2 𝑆𝑂4 𝐻2 𝐶𝑂3 𝐻2 𝑆𝑖𝑂3 𝐻3 𝑃𝑂4 Название кислоты Фтороводородная, плавиковая Хлороводородная, соляная бромоводородная йодоводородная сероводородная Азотистая Азотная Сернистая Серная Угольная Кремниевая Фосфорная Кислотный остаток Формула 𝐹− 𝐶𝑙 − 𝐵𝑟 − 𝐼− 𝑆 2− 𝐻𝑆 − 𝑁𝑂2− 𝑁𝑂3− 𝑆𝑂32− 𝐻𝑆𝑂3− 𝑆𝑂42− 𝐻𝑆𝑂4− 𝐶𝑂32− 𝐻𝐶𝑂3− 𝑆𝑖𝑂32− 𝑃𝑂43− 𝐻𝑃𝑂42− 𝐻2 𝑃𝑂4− Название соли Фторид Хлорид Бромид Иодид сульфид гидросульфид Нитрит Нитрат Сульфит Гидросульфит Сульфат Гидросульфат Карбонат Гидрокарбонат Силикат Фосфат Гидрофосфат дигидрофосфат Степень окисления (с.о.)- это условный заряд атомов в соединении, полученный в результате приёма или отдачи электронов. СТЕПЕНЬ ОКИСЛЕНИЯ МОЖЕТ ИМЕТЬ ЗНАЧЕНИЯ: Отрицательные (S-2 , N-3 ) Постоянные(Na+1,Ca+2, F-1) Положительные ( K+1, Fe+3) Переменные( N+1, N+2, N+3, N+4, N+5, N-3) нулевые (Cl20, H20) В СОЕДИНЕНИЯХ отрицательное значение с.о. имеют элементы с большим значением электроотрицательности, а положительное значение с.о. – элементы с меньшим значением электроотрицательности. Нулевое значение с.о. имеют атомы в молекулах простых веществ и свободные атомы. Суммарное значение всех с.о. в молекуле всегда равно нулю. ЗНАЧЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ ПОЛОЖИТЕЛЬНЫЕ ОТРИЦАТЕЛЬНЫЕ Всегда у металлов У неметаллов с большой электроотрицательностью I А группа +1 Всегда Фтор F-1 с.о.=-1 IIА группа +2 Кислород O-2 с.о.= -2 (исключение в соединениях с фтором O+2F2-1 с.о. = +2 и в пероксидах Na+12O-12 с.о.=-1) IIIА группа +3 У водорода в соединениях с неметаллами +1 (искл SiH4) У водорода в соединениях с металлами -1 У неметаллов с меньшей электроотрицательностью номеру группы) (низшая с.о. = 8 - номер группы) ( высшая с.о. = Алгоритм составления формул по степеням окисления +2 −2 1. Если значения степеней численно совпадают, то индексы не ставятся.Са О 2. Если значение одной степени окисления можно поделить на значение другой степени окисления, то у атома с меньшей степенью окисления индексом ставится результат деления 𝑆 +6 𝑂3−2 3. Если значения степеней окисления не делятся, то их численные значения крест-накрест переносятся индексами в формулу 𝐴𝑙2+3 𝑂3−2











