календарно-тематическое планирование уроков химии
реклама
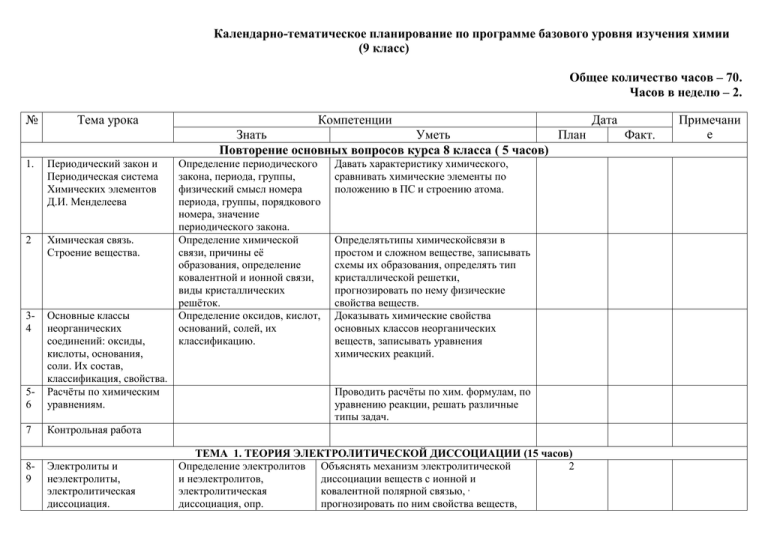
Календарно-тематическое планирование по программе базового уровня изучения химии (9 класс) Общее количество часов – 70. Часов в неделю – 2. № Тема урока Компетенции Знать Уметь План Повторение основных вопросов курса 8 класса ( 5 часов) 1. Периодический закон и Периодическая система Химических элементов Д.И. Менделеева 2 Химическая связь. Строение вещества. 34 56 Основные классы неорганических соединений: оксиды, кислоты, основания, соли. Их состав, классификация, свойства. Расчёты по химическим уравнениям. 7 Контрольная работа 89 Электролиты и неэлектролиты, электролитическая диссоциация. Определение периодического закона, периода, группы, физический смысл номера периода, группы, порядкового номера, значение периодического закона. Определение химической связи, причины её образования, определение ковалентной и ионной связи, виды кристаллических решёток. Определение оксидов, кислот, оснований, солей, их классификацию. Давать характеристику химического, сравнивать химические элементы по положению в ПС и строению атома. Определятьтипы химическойсвязи в простом и сложном веществе, записывать схемы их образования, определять тип кристаллической решетки, прогнозировать по нему физические свойства веществ. Доказывать химические свойства основных классов неорганических веществ, записывать уравнения химических реакций. Проводить расчёты по хим. формулам, по уравнению реакции, решать различные типы задач. ТЕМА 1. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (15 часов) Определение электролитов Объяснять механизм электролитической 2 и неэлектролитов, диссоциации веществ с ионной и электролитическая ковалентной полярной связью, , диссоциация, опр. прогнозировать по ним свойства веществ, Дата Факт. Примечани е Диссоциация веществ с ионной и ковалентной полярной связью. 10 Диссоциация кислот, солей, щелочей Кристаллогидратов, степень электролитической диссоциации. определение- основание, кислота, соль в свете ТЭД, 11 Степень электролитической диссоциации. Сильные и слабые электролиты. 12 Химические свойства кислот, оснований, солей 14 в свете ТЭД. Гидролиз солей. 15 Реакции ионного обмена. 16 Определение степени ЭД, сильные, слабые электролиты 17 Окислительное восстановительные реакции. Обобщение по теме ТЭД, Определение О.В.Р., окислителя, восстановителя. Определение кислот, оснований, солей в свете ТЭД, гидролиз солей. Определение реакции ионного обмена, условия осуществления данных реакций. сравнивать по строению и свойствам ионов и атомов. Записывать уравнения диссоциации кислот, оснований, солей, определять в водных растворах катион Н+ и Он 1 1 Записывать уравнения реакций в молекулярном и в ионном виде, записывать уравнения гидролиза солей, определять рН среды. Составлять молекулярные, полные и сокращённые ионные уравнения, необратимые реакции, объяснять их сущность в свете ТЭД, выполнятьлабораторные опыты попроведению реакций ионного обмена, делать выводы. Определять ОВР, составлять электронный баланс, расставлять коэффициенты. 18 Контрольная работа по теме 1. Уметь применять знания, умения и навыки, полученные при изучении темы 1. 19 Расчёты по уравнениям химических реакций, если одно из реагирующих веществ дано в избытке. 20 Решение экспериментальных задач по теме ТЭД. Определять с помощью расчётов вещество, данное в избытке, и вычислять массу (объём или количество вещества) продукта реакции по данному исходному веществу. Решение различных задач. Самостоятельно проводить опыты, используя предложенные растворы, описывать результаты наблюдения реакций 3. 2. 1 1. 1 1. 21 Общая характеристика подгруппы кислорода. 22 Кислород и сера. – простые вещества. Аллотропия. 23 Соединения серы. 24 Серная кислота 25 26 Тепловой эффект хим. реакции. Расчёты по термохим. Уравнениям. 27 Скорость хим. реакции. 28 29 Хим. равновесие. Условия его смещения. ионного обмена, определять реакцию среды в растворах солей, записывать уравнения, делать выводы. ТЕМА 2. ПОДГРУППА КИСЛОРОДА ( 5 часов) Определение аллотропии и Давать характеристику главной подгруппы 2 аллотропных по плану, сравнивать простые вещества, видоизменений. Причины доказывать хим. свойства серы, записывать аллотропии. Физические уравнения в молекулярном и в ОВ виде. свойства серы. Области её применения. Строение и свойства Доказывать свойстваоксидов серы. 2 оксидов серы, Сероводорода, сернистой кислоты, серной сероводорода, сернистой и кислоты, записывать уравнения в серной кислот, области их молекулярном, ионном и в ОВ виде. применения, качественную реакцию на сульфат-ион. Знать общие и Уметь составлять уравнения реакций в 1 специфические свойства ионном виде и ОВ серной кислоты ТЕМА 3. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ (6 часов) Опр-е теплового эффекта Опр-ять по тепловому эффекту 1. хим. реакции, что такое экзотермические и эндотермические экзотермические и реакции, проводить расчёты по ТХУ, эндотермические реакции, составлятьТХУ по массе исходного определение термохим. вещества и количеству тепла. Уравнения. Опр-е скорости хим. Объяснять влияние различных условий на 2. реакции, зависимости скорость хим. реакций, решать задачи. скорости хим. реакции от природы реагирующих веществ, площади соприкосновения, концентрации, температуры, катализатора. Опр-е химического Объяснять на примерах условия смещения 1. равновесия, понятие равновесия в зависимости от условий хим. прямой и обратной реакций. реакции, опр-е принципа Ле - Шателье. 30 Обобщение и систематизация знаний. Решение задач. 31 Контрольная работа по теме 2 и 3. 32 Общая характеристика элементов главной подгруппы \/ группы. Физические и химические свойства азота. 33 Аммиак. Строение молекулы. Физические и 34 хим. свойства. Производство аммиака. 35 Р. Задач на практический выход. Применять знания, умения и навыки при выполнении тренировочных заданий и упражнений по темам 2,3. Подготовка к контрольной работе. Применять знания, умения и навыки, полученные при изучении тем 2 и 3. ТЕМА 4. ПОДГРУППА АЗОТА (13 часов) Физические и химические Давать характеристику подгруппы свойства азота. элементов по плану, доказывать хим. свойства азота, записывать уравнения в молекулярном и ионном виде. 1. Строение аммиака, физические и химические свойства, производство. 2. 36 Азотная кислота. Строение. Свойства. Применение. Химизм производства азотной кислоты. 37 Соли аммония. Нитраты. 38 Строение. Свойства и применение азотной кислоты. 39 Фосфор и его соединения. 40 Минеральные удобрения. Характеристику фосфора как хим. элемента и простого вещества, строение и свойства соединений фосфора, применение минеральных удобрений. Состав, строение, свойства и применение солей аммония и нитратов. Доказывать химические свойства аммиака, записывать реакции в молекулярном и ионном виде. 1 1. Определять массовую долю выхода 1. продукта реакции от теоретически возможного. Доказывать общие и особые хим. свойства 1. азотной кислоты. Записывать уравнения хим. реакций в молекулярном. Ионном и ОВ виде. Доказывать общие и особые свойства солей на примере солей аммония и нитратов, Записывать уравнения хим. реакций в молекулярном, ионном и О-В виде. Доказывать хим. свойства фосфора как простого вещества и его соединений, записывать уравнения молекулярном, ионном и О-В виде. 2. 2. Обобщение и систематизация знаний по теме 4 . Решение экспериментальных задач по теме – Подгруппа азота. 44 Контрольная работа. 41 42 43 45 Общая характеристика подгруппы углерода. Углерод и кремний в сравнении. Химические свойства углерода. 46 Оксиды углерода и кремния. Состав, строение, свойства, применение. 47 Угольная и кремневая кислоты. Карбонаты. Силикаты 48 Решение задач на примеси. 49 Обобщение и систематизация знаний по теме 5. Силикатная промышленность. 50 Общая характеристика металлов. Химические 51 свойства. Применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений. Доказывать опытным путём состав изученных веществ. Записывать уравнения, проводить наблюдения, делать выводы. 2. Применять знания, умения и навыки в контрольной работе. ТЕМА 5. ПОДГРУППА УГЛЕРОДА ( 5 часов) Общую характеристику Сравнить по строению и свойствам элементов главной .Записывать уравнения, характеризующие подгруппы 1\/ группы. хим. свойства углерода в молекулярном, Понятие адсорбции, ионном и О-В виде. Иметь представление применение углерода и об аллотропных видоизменений углерода. кремния. Состав, строение, свойства, Сравнить по строению и составу оксиды применение оксидов углерода и кремния, Записывать уравнения углерода и кремния. хим. реакций в молекулярном, ионном и ОВ виде. Состав, строение, свойства, Доказывать хим. свойства угольной и применение угольной и кремневой кислот и их солей, Записывать кремневой кислот и их уравнения хим. реакций в молекулярном, солей. ионном и О-В виде. Решать расчётные задачи на вычисление массы продуктов реакции по указанной массе исходного вещества, одно из которых содержит примеси. Применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений. Иметь представление о силикатной промышленности, её видах. 1. ТЕМА 6. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ ( 3 часов) Понятие металлической Давать характеристику металлов как связи и металлической элементов по положению в ПС и строению кристаллической решётки, атома, Доказывать хим. свойства металлов, 1. 1. 1. 1 1. 1. 2. 52 Обобщение и систематизация знаний по теме 6 . Коррозия металлов. 53 Общая характеристика металлов 1- 3 групп главной подгруппы (на примере натрия, кальция, алюминия). 54 Соединения металлов главных подгрупп – 55 оксиды, гидроксиды, соли. Жёсткость воды. Амфотерность. Соединения алюминия. 56 Обобщение и систематизация знаний по теме. Физические свойства и Записывать уравнения хим. реакций в способы получения молекулярном, ионном и О-В виде. металлов. Определение коррозии, её Применять полученные знания, умения и 1. виды, способы защиты от навыки при выполнении тренировочных коррозии, условия, заданий и упражнений. способствующие и препятствующие коррозии. ТЕМА 7. МЕТАЛЛЫ ГЛАВНЫХ ПОДГРУПП 1 – 3 ГРУПП ( 5 часов) Области применения Давать характеристику металлов и строения 1 металлов. атомов, доказывать хим. свойства. Записывать уравнения хим. реакций . Состав, строение, свойства оксидов, оснований, солей металлов. Качественная реакция на ионы натрия, кальция, бария. 57 Контрольная работа по темам 6 и 7 58 Железо и его соединения. Положение железа в ПС, Практикум. состав и характер его оксидов и гидроксидов. 59 Решение экспериментальных задач 60 по теме – Металлы. Соединения металлов. Доказывать хим. свойства оксидов, оснований, солей металлов 1- 3 групп главной подгрупп.. Записывать уравнения хим. реакций в молекулярном, ионном и ОВ виде. 2. Применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений по темам 6 и 7 Подготовка к контрольной работе.. 1. Применять полученные знания, умения и навыки при выполнении контрольной работы. 1 ТЕМА 8. ЖЕЛЕЗО ( 3 часа) Давать характеристику элементу, его химическим свойствам. Записывать уравнения хим. реакций в молекулярном, ионном и О-В виде. Проводить химический эксперимент по характеристике химических свойств металлов и их соединений, осуществлять превращения. 1. 2. 61 Понятие о металлургии. Основные способы 62 получения металлов. Электролиз, его значение. 63 Многообразие органических веществ. 64 Углеводороды. Природные источники 65 углеводородов. 66 Спирты, карбоновые кислоты. 67 Сложные эфиры, жиры и углеводы. 68 Белки. Обобщение и систематизация знаний по теме -Органические соединения. 69 Резерв 70 Резерв ТЕМА 9. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ ( 2 часа) Определение металлургии, Записывать уравнения хим. реакций в 2. способы промышленного молекулярном, ионном и О-В виде. получения металлов. ТЕМА 10. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ( 8 часов) Определение органической химии, что изучает данная наука, различия между органическими и неорганическими веществами, особенности строения и свойства органических веществ. Определение Записывать полные и сокращённые углеводородов, их структурные формулы органических классификацию, основные веществ.,определять изомеры, давать им положения теории А.М. названия, записывать некоторые уравнения Бутлерова, определение реакций. изомеров, некоторые свойства углеводородов. Записывать некоторые структурные формулы спиртов и карбоновых кислот. Знать нахождение в природе, приминение. Применять полученные знания, умения и навыки при выполнении тренировочных заданий и упражнений. 1. 2. 1. 1. 1.

