ЗНАЮ ХОЧУ УЗНАТЬ 1) Информацию о веществе: а) формула- NH
реклама
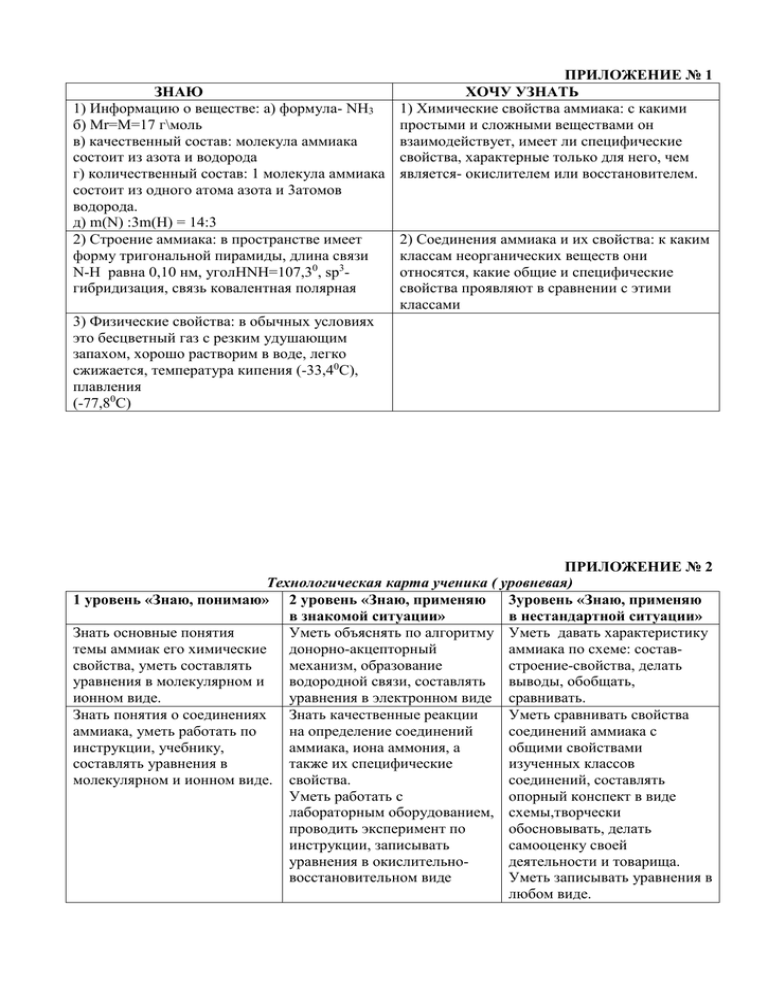
ПРИЛОЖЕНИЕ № 1 ЗНАЮ ХОЧУ УЗНАТЬ 1) Информацию о веществе: а) формула- NH3 1) Химические свойства аммиака: с какими б) Mr=M=17 г\моль простыми и сложными веществами он в) качественный состав: молекула аммиака взаимодействует, имеет ли специфические состоит из азота и водорода свойства, характерные только для него, чем г) количественный состав: 1 молекула аммиака является- окислителем или восстановителем. состоит из одного атома азота и 3атомов водорода. д) m(N) :3m(H) = 14:3 2) Строение аммиака: в пространстве имеет 2) Соединения аммиака и их свойства: к каким форму тригональной пирамиды, длина связи классам неорганических веществ они N-H равна 0,10 нм, уголHNH=107,30, sp3относятся, какие общие и специфические гибридизация, связь ковалентная полярная свойства проявляют в сравнении с этими классами 3) Физические свойства: в обычных условиях это бесцветный газ с резким удушающим запахом, хорошо растворим в воде, легко сжижается, температура кипения (-33,40С), плавления (-77,80С) ПРИЛОЖЕНИЕ № 2 Технологическая карта ученика ( уровневая) 1 уровень «Знаю, понимаю» 2 уровень «Знаю, применяю 3уровень «Знаю, применяю в знакомой ситуации» в нестандартной ситуации» Знать основные понятия Уметь объяснять по алгоритму Уметь давать характеристику темы аммиак его химические донорно-акцепторный аммиака по схеме: составсвойства, уметь составлять механизм, образование строение-свойства, делать уравнения в молекулярном и водородной связи, составлять выводы, обобщать, ионном виде. уравнения в электронном виде сравнивать. Знать понятия о соединениях Знать качественные реакции Уметь сравнивать свойства аммиака, уметь работать по на определение соединений соединений аммиака с инструкции, учебнику, аммиака, иона аммония, а общими свойствами составлять уравнения в также их специфические изученных классов молекулярном и ионном виде. свойства. соединений, составлять Уметь работать с опорный конспект в виде лабораторным оборудованием, схемы,творчески проводить эксперимент по обосновывать, делать инструкции, записывать самооценку своей уравнения в окислительнодеятельности и товарища. восстановительном виде Уметь записывать уравнения в любом виде. ПРИЛОЖЕНИЕ № 3 Инструкции к выполнению практической части ГРУППА № 1. Задание. Провести опыты доказывающие, что аммиачная вода (гидроксид аммония) слабое основание. Опыт1. В пробирку с раствором аммиачной воды ( NH4OH) добавьте каплю индикатора фенолфталеина, что наблюдаете? Затем укрепите ее в держателе для пробирок и нагрейте на спиртовке, соблюдая правила по ТБ. Запишите наблюдения в тетрадь и сделайте вывод, к какому классу неорганических веществ относится данное вещество, составьте уравнение в ионном виде. Опыт 2. В химический стакан налейте немного аммиачной воды, а в чашку Петри немного раствора соляной кислоты и поднесите ее к стакану. Что наблюдаете? Затем соедините оба раствора. Запишите наблюдения и уравнения реакции в молекулярном и ионном виде в тетрадь. ГРУППА №4 ГРУППА №4 Задание. Провести опыт на определение иона аммония в соединениях, сделать вывод о качественной реакции на ион аммония, записать наблюдения и уравнения реакций в молекулярном и ионном виде. Опыт. Внесите в пробирку 2-3 мл раствора сульфата аммония (NH4)2SO4 и добавьте раствор гидроксида натрия. Нагрейте жидкость в пробирке до кипения, осторожно определите запах выделяющегося газа. Поднесите к отверстию пробирки красную лакмусовую бумажку, смоченную водой. Как изменилась окраска лакмусовой бумажки? ПРИЛОЖЕНИЕ № 4 Опорные схемы, выводы после работы в группах ГРУППА №1. Диссоциация NH4OH=NH4+ +OH- 3NH4OH+AlCl3 =3 NH4Cl + Al(OH)3 Al3++3OH=Al(OH)3 Химические свойства NH4OHгидроксида аммония NH4OH+HCl = NH4Cl+H2O OH-+ H+=H2O 2NH4OH+CO2 = ( NH4)2CO3 H2O 2OH- +CO2 =CO32-+H2O ВЫВОД: NH4OH- гидроксид аммония, слабое основание. Это доказывает опыт, что при нагревании он разлагается на аммиак и воду. Это соединение относится к классу оснований, так как изменяет окраску фенолфталеина в малиновый цвет, как и щелочи. Как щелочи он взаимодействует с кислотными оксидами, образуя соль и воду, с кислотами, также образуя соль и воду, с солями, если образуется нерастворимое основание. Специфичность этого соединения в том, что в отличии от щелочей это слабое основание, которое имеет формулу гидрата и запах аммиака: NH3*H2O=NH4OH частично ГРУППА №2 и №3 Химические свойства аммиака NH3 NH3+HCl=NH4C l NH3+H+=NH4+ -3 t,кат. 4NH3 + 5O2 = +2 =4NO+6H2O NH3- восстанов. -3 t 2NH3 +3CuO=3Cu+ 0 +N2+3H2O NH3- восстанов. -3 t 0 2NH3+3Cl2=N2 + +6HCl NH3восстановитель. -3 0 4NH3+3O2=2N2+ +6H2O NH3восстановит. -3 t -3 2NH3+2Al=2AlN + +3H2 NH3-окислитель -3 t 0 2NH3 = N2+3H2 NH3 восстановитель NH3+H2O=NH4OН ВЫВОД: Аммиак сильный восстановитель. Для него характерны свойства, как: А) Восстановителя- горение, окисление кислородом в присутствии катализатора, взаимодействие с галогенами, восстановление металлов из их оксидов. Б) Окислителя – взаимодействие с металлами. В) Специфические свойства – присоединение воды и кислот протекает по донорноакцепторному механизму, аммиак способен образовывать водородные связи между собой и водой, при нагревании разлагается на простые вещества азот и водород. ГРУППА № 4. Соли аммония NH4Cl=NH4++Cl- t NH4NO3+NaOH= =NH3+NaNO3+H2O NH4Cl+AgNO3 = AgCl +NH4NO3 t NH4Cl=NH3+HCl Гидролиз солей аммония идет по катиону NH4+ (NH4)2CO3+HCl = = NH4Cl+CO2+H2O ВЫВОД:1) Соли аммония – это электролиты, которые диссоциируют на катион аммония NH4+ и анионы кислотного остатка. 2) Они проявляют свойства: а) Общие с солями- взаимодействуют с кислотами, солями, если образуется осадок или газ. б) Специфические – взаимодействуют с щелочами с образованием аммиака, при нагревании разлагаются, хорошо растворимы в воде и являются электролитами, при гидролизе показывают кислотную среду или гидролиз идет полностью. ПРИЛОЖЕНИЕ № 5 ЛИСТ УЧЕТА ДЕЯТЕЛЬНОСТИ УЧЕНИКА Ф.И. учся Цель до 3б. Тест До 5б. Работа в паре Самооц. товарища Работа в группе Самооцен. Заявка на урок: 20б и выше – «5» 3уровень 15 - 19б. - «4» 2уровень 10 - 14б. - «3» 1уровень товарища Защита от групп До 5б. Дополнение До 3б. Итог\ уровень оценка







