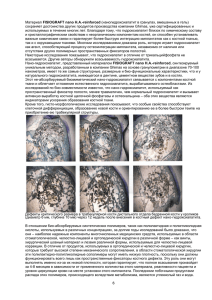
Министерство образования и науки Российской Федерации ФГБОУ ВО "Российский химико - технологический университет им. Д.И.Менделеева Кафедра химической технологии композиционных и вяжущих материалов Научно-исследовательская работа на тему: «Исследование термохимических взаимодействий биоактивного стекла и фосфатов кальция» Выполнила : студентка гр. Н-44 Насырова Илия Ишкиневна Научный руководитель: кандидат тех. наук Свентская Наталья Валерьевна Москва -2019 Содержание Введение 1. Аналитический обзор 1.1.Состав, структура, свойства костной ткани 1.2.Имплантационные материалы, применяемые в костной пластике 1.2.1. Металлические имплантаты (состав, виды имплантов, свойства, области применения 1.2.2. Полимерные имплантаты 1.2.2а. Высокостабильные полимерные имплантаты (состав, виды имплантов, свойства, области применения [Штильман М.И., Артюхов А.А.]) 1.2.2б. Резорбируемые полимерные имплантаты (состав, виды имплантов, свойства, области применения [Штильман М.И., Артюхов А.А.]) 1.2.3. Стекловидные и стеклокристаллические имплантационные материалы (состав, виды имплантов, свойства, области применения [Белецкий Б.И., Мастрюкова Д.Л., Свентская Н.В., Бучилин Н., Михайленко Н.Ю, Строганова Е.Е.]) 1.2.4. Спеченные керамические имплантаты (на основе ZrO2, гидроксиапатита кальция, фосфатов кальция [Комлев В.С., Баринов, Сафронова Т.В.]) 1.2.5. Кальций-фосфатные цементы (дикальцийфосфата дигидрата, гидроксиапатита кальция [Лукина Ю.С., Свентская Н.В.]) 1.3. Сравнительные свойства биокомпозиционных материалов на основе фосфатов кальция 1.4. Выводы по литературному обзору 2. Материалы и методы исследования 2.1. Характеристика исходных материалов 2.2. Состав исследуемых композиций 2.3. Методы исследований 2.3.1. Грануляция композиций 2.3.2. Обжиг композиций 2.3.3. Рентгенофазовый анализ 2.3.4. Определение степени растворимости 2.3.5. рН-метрия 3. Исследование термохимических взаимодействий биоактивного стекла и фосфатов кальция 3.1. Влияние параметров обжига на фазовый состав композиций 3.2. Исследование степени растворимости композиций 3.3. Исследование рН раствора композиций 3.4. Выводы по экспериментальной части Список используемой литературы \ Введение 1. Аналитический обзор 1.1.Состав, структура, свойства костной ткани Структура костной ткани. Кости состоят из пластинчатой костной ткани, которая относится к соединительным тканям. Основу составляют три вида клеток: остеобласты (образующие костную ткань), остеоклаты (разрушающие костную ткань) и остеоциты (участвуют в минерализации костной ткани). Клетки находятся в межклеточном веществе, которые в совокупности образуют костные пластинки. Снаружи кость покрыта надкостницей, внутри нее в костномозговых полостях, находится костный мозг (Рис. 1) Рис.1 Строение кости Кроме суставных поверхностей, покрытых хрящом, снаружи кость покрыта надкостницей. В ней можно выделить два слоя: наружный (волокнистый) и внутренний (остеогенный, костеобразующий). За счет внутреннего слоя надкостницы образуются остеобласты и кость растет в толщину. Наружный слой кости представлен толстой (в диафизах трубчатых костей) или тонкой (в эпифизах трубчатых костей, в губчатых и плоских костях) пластинкой компактного вещества. Под компактным веществом располагается губчатое (трабекулярное) вещество, пористое, построенное из костных балок с ячейками между ними Внутри диафиза трубчатых содержащая костный мозг. костей находится костномозговая полость, Центральный канал с системой концентрических пластинок является структурной единицей кости и получил название остеона, или гаверсовой системы. Пространства между остеонами выполнены вставочными (промежуточными) пластинками. Остеоны и вставочные пластинки образуют компактное корковое вещество кости. Внутри кости, в костномозговой полости и ячейках губчатого вещества, находится костный мозг. Во внутриутробном периоде и у новорожденных во всех костях содержится красный костный мозг, выполняющий кроветворную и защитную функции. Он представлен сетью ретикулярных волокон и клеток. В петлях этой сети находятся молодые и зрелые клетки крови и лимфоидные элементы. В костном мозге разветвляются нервные волокна и сосуды. У взрослого человека красный костный мозг содержится только в ячейках губчатого вещества плоских костей (кости черепа, грудина, крылья подвздошных костей), в губчатых (коротких) костях, эпифизах трубчатых костей. В костномозговой полости диафизов трубчатых костей находится желтый костный мозг представляющий собой перерожденную ретикулярную строму с жировыми включениями. На поверхностях каждой кости имеются неровности: здесь начинаются или прикрепляются мышцы и их сухожилия, фасции, связки. Эти возвышения, выступающие над поверхностью кости, называют апофизами (бугор, гребень, отросток). На участке, где мышца прикрепляется своей мясистой частью, определяются углубления. Химический состав кости. Химический состав кости зависит от ее состояния, возрастных и индивидуальных особенностей. Свежая кость взрослого человека содержит 50 % воды, 16 % жира, 12 % органических и 22 % неорганических веществ. Высушенная и обезвоженная кость примерно на 2/3 состоит из неорганического вещества и на 1/3— из органического. Неорганическое вещество представлено преимущественно солями кальция в виде субмикроскопических кристаллов гидроксиапатита. С помощью электронного микроскопа установлено, что оси кристаллов параллельны костным волокнам. Из кристаллов гидроксиапатита формируются минеральные волокна. Свойства костной ткани. Кости, как строительный материал скелета, работают на сжатие, растяжение, кручение или на изгиб. Эти режимы работы предъявляют к костям как элементам скелета совершенно разные требования. Самое главное при этом в скелете - сочетание прочности с легкостью. Прочность кости является результатом сочетания твердости эластичности, обусловленных наличием в ее составе химических веществ и Если подвергнуть кость воздействию соляной кислоты, то минеральные элементы костной ткани растворятся. Кость сохраняет свою форму и цвет, но становится совершенно мягкой. Особую прочность кости придает и ее структура. Например, структура длинных костей ближе к суставам переходит из плотной в пористую, за счет чего плавно изменяется жесткость и обеспечивается равномерное распределение напряжений. С увеличением возраста костная ткань претерпевает ряд изменений, которые затрагивают ее химический состав и внутреннюю структуру. Например, возникает множество вторичных остеонов, образующих новую внутреннюю конструктивную систему. Старение снижает биологическую активность костной ткани, меняет степень минерализации, а также порядок расположения минеральных кристаллов и остеонов, уменьшает количество связующего вещества, некоторая часть ткани исчезает, а появляются поры. Путем экспериментов установлено, что для костной ткани самым опасным является напряжение растяжения. Хотя прочность кости на растяжение приблизительно равна прочности чугуна. 1.2.Имплантационные материалы, применяемые в костной пластике Современные стратегии регенеративной медицины направлены на восстановление архитектуры патологически измененной ткани путем замещения костного дефекта имплантатом, помещенным в зону повреждения. Тем самым сокращаются сроки восстановления трудоспособности и повышается качество жизни пациента. Большое количество природных материалов подвергается в свою очередь условной классификации. Например, натуральные костные массы бывают аутогенными, аллопластическими, а также ксеногенными. Аутогенная пластика нуждается в остеопластических структурах, которые вырезают у больного из определённых мест челюстно-лицевого аппарата. Данный материал идеальнейшим образом подходит для воссоздания костной ткани. Количество подобного вещества нужно совсем небольшое, поэтому риск возникновения и переноса инфекционного воспаления в месте забора материала практически равен нулю. При этом процессе приживляемость (остеоинтеграция) является достаточно быстрой и практически идеальной. Благодаря таким замечательным свойствам данной костной ткани, созданной посредством аутогенных веществ, врачи-стоматологи считают такой вид кости «золотым стандартом». Но и у неё имеются свои недочёты. Забирать костную структуру приходится при осуществлении добавочных хирургических манипуляций. А всем известно, что любое хирургическое вмешательство сопряжено с определёнными рисками. Аллогенные кости производятся из костной массы животных посредством особой, достаточно сложной и многоэтапной, обработки. Подобные вещества хранятся в специальном банке тканей. Наращивание костной массы посредством аллогенных костей обладает несколькими достоинствами. В этом случае стоматологу не приходится производить хирургическое вмешательство, поэтому пациенту не требуется добавочная трата нервов и обезболивающих препаратов. Аллогенные вещества в значительной мере снижают процент кровопотери, а также уменьшают временной период, необходимый для проведения реконструкции. На получение ксеногенныхостеопластических костных масс идёт костный материал КРС (крупного рогатого скота). До недавнего времени именно этот материал был самым востребованным при проведении операций на челюстнолицевом аппарате человека. Ксеногенныеостеопластические кости считались незаменимым веществом в таком востребованном разделе стоматологии как дентальная имплантация. Сегодня первенство принадлежит аллогенным костным тканям. Если говорить об искусственном костном материале, то на сегодняшний день он не менее востребован, чем все прочие костные вещества. По своим техническим параметрам он не уступает природным материалам. Но основной изюминкой синтетической кости является полное отсутствие инфекции при её применении. 1.2.1.Металлические имплантаты Инертные материалы имеют физико-химическую связь с костной структурой. Имплантаты, из которых они созданы, не разрушаются в процессе взаимодействия с окружающими тканями организма. К инертным материалам относятся титан и его сплавы, никелид титана, цирконий. Титан — легкий, прочный металл, обладающий высокой устойчивостью к коррозии. Титан плавится при температуре 1690°С и обладает плотностью 4,5 г/см3, является немагнитным металлом, имеет невысокий коэффициент теплопроводности и низкий модуль упругости. Важное свойство титана заключается в самопроизвольном создании, до определенной толщины, оксидной пленки, что обеспечивает его высокую коррозийную устойчивость. Оксидный слой на поверхности титанового имплантата является основой для последующего формирования и жизнедеятельности остеогенных клеток: остеобластов, остеоцитов, фибробластов. Титан является абсолютно биоинертным материалом, не вызывающим воспалительной реакции в организме и способствующим образованию кости на поверхности имплантата. В клинической практике применяются внутрикостные имплантаты из никелид титана, обладающие эффектом памяти формы. Эффект памяти формы основан на изменении внутреннего строения сплава, вследствие перестройки кристаллической решетки материала в условиях охлаждения до температуры ниже 10°С. После охлаждения с помощью титанового инструмента, лепестки стержня цилиндрического имплантата сводятся до полного контакта, а лепестки на титановой поверхности пластиночного имплантата устанавливаются в одной плоскости. При введении имплантата в костное ложе при температуре 35—37°С проявляется эффект термомеханической памяти сплава, когда лепестки раздвигаются и принимают первичную форму, фиксируя имплантат в кости челюсти. Цирконий — прочный металл, на поверхности которого образуется слой оксида и нитрида, обеспечивающий его высокую устойчивость к коррозии. Основным его источником является ортоксилат циркония. В настоящее время чистый цирконий применяется для изготовления внутрикостных имплантатов. К основным технологическим способам изготовления имплантатов относятся фрезерование, обработка титана посредством штамповки или пластического деформирования. Методом литья в основном производятся поднадкостничные имплантаты из кобальтохромового сплава. Большое значение при конструировании имплантатов придается созданию внутрикостной поверхности, которая определяет не только прочностные свойства, коррозийную стойкость, но также и адгезию остеогенных клеток. Структура поверхности имплантата существенно влияет на создание контакта с костью и распределение напряжений в кости. Надежность долговременной фиксации внутрикостных имплантатов можно достичь за счет увеличения площади контакта поверхности имплантата с костной тканью путем создания шероховатой структуры его поверхности. Микронеровности на внутренней части имплантата можно создать с помощью механической обработки или обработки абразивными материалами под давлением. При механической обработке (метод наката) микрорельеф поверхности имплантата образуется за счет поверхностной деформации при взаимодействии с более твердым материалом. Абразивная или пескоструйная обработка под давлением проводится порошком алюмооксидной керамики. После этого для создания более равномерной шероховатости поверхности имплантата, проводится травление соляной, серной, азотной кислотами. Возможно создание шероховатой поверхности имплантата при помощи эксимерного лазера. Формирование поверхности имплантата может осуществляться с помощью технологии плазменного напыления. При этом на поверхность титанового имплантата можно наносить не только порошок чистого титана, но и активные материалы, например гидроксиапатит или стеклокерамику. В результате создается покрытие толщиной от 30 до 50 мкм. На поверхность имплантатов «Эндопор» для увеличения площади контакта с костью, методом термического спекания наносятся титановые шарики. Керамические материалы также находят применение в качестве внутрикостных имплантатов. Важной характеристикой этих материалов является их высокая коррозийная стойкость и хорошая биологическая совместимость с костью. Для изготовления внутрикостных имплантатов используется алюмооксидная керамика, которая имеет моно- и поликристаллическую структуру. Монокристаллические сапфировые заготовки для цилиндрических и пластиночных имплантатов выращивают на автоматизированных установках в вакууме или особо чистом аргоне. Следует отметить, что имплантаты из алюмооксидной керамики, несмотря на высокую инертность и биологическую совместимость, являются хрупкими и имеют малый запас прочности, поэтому в настоящее время керамические имплантаты почти не применяются. Толерантные материалы, к которым относятся сплавы на основе кобальта и нержавеющей стали, не образуют физико-химического соединения между поверхностью имплантата и костью, что приводит к образованию вокруг имплантата соединительнотканной прослойки. Поэтому не происходит их плотного, неподвижного соединения с костью и отсутствует хорошая устойчивость после внутрикостной имплантации. Основу кобальтохромового сплава составляет кобальт (66—67%), обладающий высокими механическими качествами, и хром (26—30%), вводимый для придания сплаву твердости и повышения антикоррозийной стойкости. Температура плавления сплава составляет 1458°С. Благодаря хорошим литейным свойствам, сплав используется для изготовления каркасов литых коронок, мостовидных и дуговых протезов, а также применяется при отливке поднадкостничных каркасов имплантатов, которые фиксируются на поверхности кости верхней и нижней челюсти. Кроме металлов к толерантным материалам относятся полимеры, не обладающие токсическими и канцерогенными свойствами (полиэтилен, полипропилен). В процессе создания имплантатов происходит загрязнение (контаминация) их поверхности, что зависит от технологии их изготовления и способа обработки внутрикостной поверхности. Очистка поверхности имплантата может проводиться химическими способами с помощью кетонного раствора. Существуют способы очистки в тлеющем электрическом разряде и с помощью ультразвуковой обработки. Стерилизацию имплантатов осуществляют автоклавированием, сухожаровым способом, а также посредством ультрафиолетового облучения, что позволяет добиться относительно чистой поверхности имплантата. 1.2.2.Полимерные имплантаты Полимерные материалы являются основой многих групп имплантатов — объектов, вводимых в организм хирургическими методами и функционирующих в условиях полного или частичного окружения живыми тканями. Имплантаты, вводимые вместо удаленных внутренних органов или их фрагментов, принято называть эндопротезами. В зависимости от способности материала имплантата к распаду под действием окружающих сред наблюдается или постепенное уменьшение массы и объема вводимых в организм объектов (процесс биодеградации), или, в случае нераспадающегося или медленно распадающегося материала, образование вокруг имплантата тонкой тканевой оболочки (капсулы), которая является защитной реакцией организма на появление чужеродного объекта. В настоящее время имплантаты широко используют при хирургических операциях. Наиболее крупной группой имплантатов являются имплантаты, используемые при операциях в сердечно-сосудистой системе, системах, образованных костной зубоврачебной технике (Рис.2). и мягкими тканями, офтальмологии, Рис.2 Элементы конструкции поворотно-дискового (одностворчатого) протеза клапана сердца: а - диск (запирающий элемент); б - корпус ограничителями хода; в - пришивная манжета с большим и малыми Отдельные группы имплантатов составляют различные изделия, используемые при поражениях кожного покрова, в том числе после раневого и ожогового поражения, а также шовные материалы, материалы, используемые для создания имплантатов для зубоврачебной техники, офтальмологии и др. Применяемые в создании костных имплантатов полимеры должны или обладать высокой стойкостью к биодеградации (например, полимеры, используемые для изготовления эндопротезов суставов), или распадаться при создании изделий, которые должны постепенно замещаться живой тканью (например, крепежные детали для внутреннего остеосинтеза, пломбировочные составы). Из небиодеградируемых полимеров, используемых для создания костных имплантатов, можно отметить полиэтилен сверхвысокой молекулярной массы, полисульфоны, полиформальдегид. В создании биодеградируемыхимплантатов все большее значение приобретают полиэфиры гидроксикарбоновых кислот. Важную роль в ортопедической хирургии играют эндопротезы связок и сухожилий (Рис.3). Так, применение нашли пористые ленты из полиэтилентерефталата и вспененного политетрафторэтилента. Активно исследуют использование для замещения связок и сухожилий способных к биодеградации полиэфиров гидроксикарбоновых кислот. Такие эндопротезы должны замещаться живой тканью. Рис.3Эндопротезирование коленного сустава