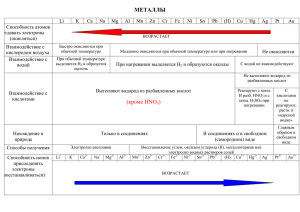
ИВАНОВСКИЙ ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ «Электролиз» Дисциплина: химия Выполнила: Иванова А., Студентка гр.1-А 2018-1019 уч.год •Электролиз – это окислительновосстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита • Электролиты: Соли, Щёлочи, Кислоты. Анод (анион) – это положительно заряженный электрод- он обозначается A(+) На катоде всегда идёт процесс восстановления. На аноде всегда идёт процесс окисления. Электрод • Электроды Активные ( только анод: материал анода окисляется) • Например медный • Инертные (не окисляются, например: графит, уголь, платина) 2 вида электролиза: - электролиз расплавов - электролиз растворов Электролиз растворов электролитов Катионы активных металлов: Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+, NH4 активные металлы - не восстанавливаются, восстанавливается вода • 2H2O + 2ē = H2↑ + 2OH– Катионы металлов средней активности Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+, Sn2+, Pb2+ Восстанавливаются катионы металлов и вода: Men++ nē = Meo 2H2O + 2ē = H2↑+ 2OH– Катионы неактивных металлов Cu2+, Hg2+, Ag+, Pt2+, Au3+ Восстанавливаются только катионы металлов: Men++nē = Meo Если анод не растворимый Cl-, Br-, S-, I -… Бескислородные (кроме F) анионы окисляются Am– – mē = Ao Анионы OH– Окисляются только при электролизе растворов щёлочей 4OH– – 4ē = O2↑+ 2H2O Анионы кислородсодержащих кислот: SO42–, NO3–, CO32–, PO43– Окисляются молекулы воды: 2H2O – 4ē =O2↑+ 4H+ Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлы. Анионы не окисляются. Окисляется сам анод: Мео – nē = Men+ Катионы Men+ переходят в раствор. Масса анода уменьшается Применение электролиза в косметологии для электроэпиляции ( при удалении волос этим методом используются очень тонкие иголочки ,которыми воздействую на волосяной фолликул)