задания для контрольных работ и тесты
реклама
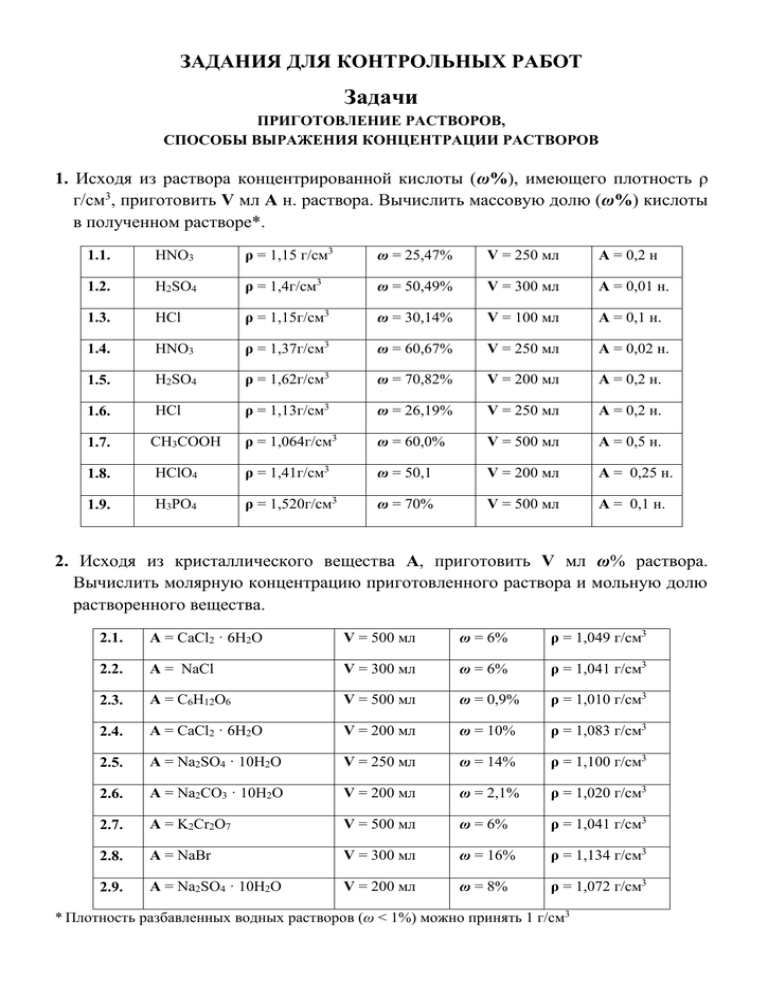
ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ Задачи ПРИГОТОВЛЕНИЕ РАСТВОРОВ, СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ 1. Исходя из раствора концентрированной кислоты (ω%), имеющего плотность ρ г/см3, приготовить V мл А н. раствора. Вычислить массовую долю (ω%) кислоты в полученном растворе*. 1.1. HNO3 ρ = 1,15 г/см3 ω = 25,47% V = 250 мл А = 0,2 н 1.2. H2SO4 ρ = 1,4г/см3 ω = 50,49% V = 300 мл А = 0,01 н. 1.3. HCl ρ = 1,15г/см3 ω = 30,14% V = 100 мл А = 0,1 н. 1.4. HNO3 ρ = 1,37г/см3 ω = 60,67% V = 250 мл А = 0,02 н. 1.5. H2SO4 ρ = 1,62г/см3 ω = 70,82% V = 200 мл А = 0,2 н. 1.6. HCl ρ = 1,13г/см3 ω = 26,19% V = 250 мл А = 0,2 н. 1.7. CH3COOH ρ = 1,064г/см3 ω = 60,0% V = 500 мл А = 0,5 н. 1.8. HClO4 ρ = 1,41г/см3 ω = 50,1 V = 200 мл А = 0,25 н. 1.9. H3PO4 ρ = 1,520г/см3 ω = 70% V = 500 мл А = 0,1 н. 2. Исходя из кристаллического вещества А, приготовить V мл ω% раствора. Вычислить молярную концентрацию приготовленного раствора и мольную долю растворенного вещества. 2.1. А = CaCl2 · 6H2O V = 500 мл ω = 6% ρ = 1,049 г/см3 2.2. А = NaCl V = 300 мл ω = 6% ρ = 1,041 г/см3 2.3. A = C6H12O6 V = 500 мл ω = 0,9% ρ = 1,010 г/см3 2.4. A = CaCl2 · 6H2O V = 200 мл ω = 10% ρ = 1,083 г/см3 2.5. A = Na2SO4 · 10H2O V = 250 мл ω = 14% ρ = 1,100 г/см3 2.6. A = Na2CO3 · 10H2O V = 200 мл ω = 2,1% ρ = 1,020 г/см3 2.7. A = K2Cr2O7 V = 500 мл ω = 6% ρ = 1,041 г/см3 2.8. A = NaBr V = 300 мл ω = 16% ρ = 1,134 г/см3 2.9. A = Na2SO4 · 10H2O V = 200 мл ω = 8% ρ = 1,072 г/см3 * Плотность разбавленных водных растворов (ω < 1%) можно принять 1 г/см3 3. Исходя из 6% раствора NaCl (ρ=1,041г/см3), приготовить: 3.1. 200 мл 0,3 М раствора. Рассчитать титр раствора. 3.2. 5 кг 0,86% раствора. Рассчитать молярную концентрацию приготовленного раствора. 3.3. 200 мл 0,15 н. раствора. Рассчитать массовую долю (ω% ) NaCl в приготовленном растворе и титр раствора. 4. Исходя из кристаллического вещества А, приготовить V мл ω% раствора. Вычислить нормальность раствора и его титр. 4.1. A = CaCl2 · 6H2O V = 500 мл ω = 6% ρ = 1,049 г/см3 4.2. А = NaCl V = 300 мл ω = 6% ρ = 1,041 г/см3 4.3. A = C6H12O6 V = 500 мл ω = 0,9% ρ = 1,010 г/см3 4.4. А = CaCl2 · 6H2O V = 200 мл ω = 10% ρ = 1,083 г/см3 4.5. А = NaCl V = 250 мл ω = 14% ρ = 1,100 г/см3 4.6. A = Na2CO3 · 10H2O V = 200 мл ω = 2,1% ρ = 1,020 г/см3 4.7. A = Na2SO4 · 10H2O V = 200 мл ω = 8% ρ = 1,072 г/см3 4.8. A = NaBr V = 300 мл ω = 16% ρ = 1,134 г/см3 5. Исходя из 10% раствора (ρ =1,083 г/см3) хлорида кальция, приготовить V мл ω% раствора. Рассчитать молярность, нормальность, титр раствора и мольную долю растворенного вещества. 5.1. V = 250 мл г/см3 5.2. V = 200 мл г/см3 5.3. V = 300 мл г/см3 5.4. V = 500 мл г/см3 5.5. V = 100 мл г/см3 6. Исходя из 12% раствора CaCl2 (ρ = 1,066 г/см3), приготовить: 6.1. 200 мл 0,02М раствора. Рассчитать массовую долю CaCl2 (ω%) в приготовленном растворе. 6.2. 250 мл 0,01 н. раствора. Рассчитать массовую долю CaCl2 (ω%) в приготовленном растворе и титр раствора. 6.3. 2 кг 2,8% раствора. Рассчитать молярную концентрацию и моляльность приготовленного раствора. 2 6.4. 500 г 1,5% раствора. Рассчитать нормальность приготовленного раствора (ρ = 1,02 г/см3). 7. Приготовить 0,2 М раствор, исходя из фиксанала (0,1 моль эквивалента): 7.1. NaOH. Рассчитать массовую долю (ω%) NaOH в приготовленном растворе, титр раствора. 7.2. HCl. Рассчитать массовую долю (ω%) HCl в приготовленном растворе, титр раствора. 7.3. H2SO4. Рассчитать массовую долю (ω%) H2SO4 в приготовленном растворе, титр раствора. 8. Исходя из 20% раствора аммиака (ρ = 0,923 г/см3), приготовить: 8.1. 200 мл 0,2М раствора. Рассчитать массовую долю аммиака (ω%) в приготовленном растворе. 8.2. 250 мл 0,15 н. раствора. Рассчитать массовую долю аммиака (ω%) в приготовленном растворе, титр раствора. 8.3. 500 г 2,5% раствора. Рассчитать молярную концентрацию приготовленного раствора. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ. ТЕРМОХИМИЯ 9. Вычислить стандартную энтальпию реакции образования стандартным энтальпиям реакций: Н2(г) + ½ О2(г) = Н2О(ж) , ΔH0 = – 285,83 кДж/моль аммиака по NH3(г) + ¾ О2(г) = ½ N2(г) + 1,5 Н2О(ж) , ΔH0 = – 316,72 кДж/моль 10. Определить стандартную энтальпию сгорания этилового спирта: С2H5OH(ж) + 3О2 (г) = 2CO2 (г) + 3Н2О(ж) по стандартным энтальпиям образования веществ (см. приложения). 11. Вычислить стандартную энтальпию биохимического брожения глюкозы: C6H12O6 (тв) = 2 С2H5OH(ж) + 2 CO2 (г), если стандартные энтальпии сгорания глюкозы и этилового спирта равны соответственно –2801,69 и –1366,6 кДж/моль. Определить знак ΔS. 12. Вычислить стандартную энтальпию реакции: CaCO3(тв) = CaO(тв) + СО2 (г), используя стандартные энтальпии образования веществ (см. приложения). 13. Вычислить стандартную энергию Гиббса (ΔG0) реакции: Н2 (г) + S(ромбич.) = Н2S(г) по стандартным термодинамическим величинам (см. приложения). 14. Вычислить стандартную энергию Гиббса (ΔG0) реакции восстановления магнетита: Fe3O4 (тв) + 4Н2 (г) = 3Fe(тв) + 4Н2О(г) по стандартным термодинамическим величинам (см. приложения). 3 15. Вычислить стандартную энергию Гиббса (ΔG0) реакции: α-D-Глюкоза (р-р) + О2 (г) 2 Пируват (р-р) + 2 Н+ (р-р) + 2 Н2О (ж), если известно, что стандартные энергии Гиббса образования веществ соответственно равны:α-D-Глюкоза 916,34, пируват 474,18, вода 236,96 кДж/моль. 16. Определить, может ли процесс: S(ромбич.) S(монокл.) идти слева направо при Т = 298 К. Если нет, то при какой температуре это станет возможно? 17. Рассчитать температуру, при которой две формы CaCO3 – кальцит и аргонит – находятся в равновесии при давлении 1 атм. Необходимые термодинамические величины (см. приложение № 10). 18. Энтальпия реакции гашения извести равна –66,9 кДж/моль. Сколько теплоты выделится при гашении 1 кг 85%-ной извести? 19. Энтальпия сгорания углеводов в организме человека составляет 17,55 кДж/г, белков – 16,72 кДж/г, жиров – 39,29 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – мужчин составляет соответственно 113 г, 106 г, 451 г, для студентов – женщин 96 г, 90 г, 383 г. Какова среднесуточная потребность студентов в энергии? 20. Используя значение энтальпий сгорания белков, жиров и углеводов (см. предыдущую задачу) рассчитать энергетическую ценность перловой каши (67г крупы). В 100г крупы содержится 9,3 г белков, 1,1 г жиров и 73,7 г углеводов. 21. При растворении 2,67 г SrCl2 ∙ 6Н2О (Р = const) в воде поглощается 309 Дж теплоты, а при растворении 31,8 г SrCl2 выделяется 9,52 кДж теплоты. Вычислите ΔН образования кристаллогидрата. 22. В калориметре смешали 100 мл 1 н. HCl и 50 мл 2 н. NaOH, температура поднялась на 8,9 градуса. Вычислить ΔН нейтрализации, принимая удельную теплоемкость раствора равной 4,18 Дж/(г∙К). 23. Рассчитать энтальпию разложения Н2О2 при некоторой температуре, если известны стандартные энтальпии следующих реакций: SnCl2(р-р) + 2HCl(р-р) + 0,5O2(г) SnCl4(р-р) + H2O(ж); ΔH1˚= − 297 кДж; SnCl2(р-р) + 2HCl (р-р) + H2O2(ж) SnCl4(р-р) + 2H2O(ж); ΔH2˚= − 393 кДж. 24. Рассчитать стандартную энтальпию образования СО, если стандартная энтальпия сгорания СО составляет ΔН˚сгор.(СО) = − 283 кДж/моль; стандартная энтальпия образования СО2 равна − 393,5 кДж/моль. 25. Стандартная энтальпия реакции Fe2O3 (тв) + 3CO (г) 2Fe (тв) + 3CO2 (г) равна − 28,8 кДж. Рассчитать ΔН˚обр.(Fe2O3), если ΔН˚обр.(СО2) = кДж/моль, ΔН˚обр.(СО) = − 110,5 кДж/моль. − 393,5 26. Стандартная энтальпия растворения безводного BaCl2 равна − 8,66 кДж/моль, а энтальпия процесса гидратации BaCl2 (тв) + 2H2O (ж) ВaCl2·2H2O (тв) 4 составляет − кристаллогидрата. 27,2 кДж/моль. Рассчитать энтальпию растворения 27. Протекание какой из двух возможных реакций а) или б) более вероятно? а) N2O(г) +3Mg (тв) = Mg3N2 (тв)+ ½ О2(г); б) N2O(г) +Mg (тв) = MgО (тв) + N2(г) Ответ обосновать расчетом. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 28. Написать выражения констант равновесия для следующих реакций: а) СО(г.) + Cl2(г.) COCl2(г.); б) 2NO(г.) + O2(г.) 2NO2 (г.); в) CO(г.) + H2O(г.) CO2(г.) + H2(г.); г) NH3 (p-р) + H2O(ж.) NH4+(p-р) + OH(p-р); д) CH3COOH (p-p) CH3COO(p-p) + H+(p-p); е) H2O(ж.) H+(p-p)+ OH (p-р); ж) [HgI4]2-(р-р) Hg2+(p-p) + 4I (p-p); з) MgCO3(кр.) + 4H2O(г.) MgO(кр.)+ CO2(г.); и) 3Fe(кр.) + 4H2O(г.) Fe3O4(кр.) + 4H2(г.). Чем отличается форма записи выражения констант равновесия для гомогенных и гетерогенных реакций? 29. При состоянии равновесия в системе N2(г.) + 3H2(г.) 2NH3(г.); ΔH = 92,4кДж, равновесные концентрации участвующих веществ равны: [N2]р = 3 моль/л, [H 2]р = 9 моль/л, [NН3]р = 4 моль/л. Определить: исходные концентрации водорода и азота; направление смещения равновесия с ростом температуры. 30. При некоторой температуре равновесие в системе: 2NО 2(г.) 2NО (г.) + О2(г.) установилось при следующих концентрациях компонентов: [NО2]р = 0,06 моль/л, [NО]р = 0,24 моль/л, [О2]р = 0,12 моль/л. Определить константу равновесия реакции и исходную концентрацию оксида азота (IV). 31. В каком направлении сместится равновесие следующих обратимых реакций: 2СО(г.) + О2 (г.) 2СО2(г.); ΔH = 566 кДж; С(граф.) +Н2О(г.) СО(г.)+ Н2; ΔH = 129,9 кДж; а) при понижении температуры; 5 б) при повышении давления? 32. Константа равновесия для реакции СО2(г.) + Н2(г.) СО(г.) + Н2О(г.) при 8500С равна 1. Рассчитать, при каких концентрациях всех четырех веществ установится равновесие, если начальные концентрации оксида углерода (IV) и водорода равны, соответственно, 0,1 моль/л и 0,6 моль/л. 33. Определить значение ΔG0298 и константу химического равновесия при 250С для системы: СО(г.) + Н2О(г.) Н2 (г.) + СО2(г.) 34. Определить значение ΔG0298 и константу химического равновесия при 250С для реакции: 2 NO2 (г.) N2O4 (г.) КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ. РАСТВОРИМОСТЬ 35. Давление водяного пара при 18оС равно 15,5 мм. рт. ст. Какое будет давление пара при той же температуре, если в 1 кг воды растворить 34,2 г сахара (С12Н22О11)? 36. При 20оС давление водяного пара равно 17,5 мм. рт.ст. Сколько граммов мочевины СО(NH2)2 нужно растворить в 45г воды, чтобы понизить давление на 1%? 37. Чему равно осмотическое давление раствора, в 150 мл которого содержится 6,33 г красящего вещества крови – гематина (C34H33N4O5Fe)? Молярная масса гематина 633 г/моль, t = 25оС. 38. Осмотическое давление крови при 37оС равно 7,7 атм. Будет ли изотоничен крови 3% раствор никотинамида C5H4NCONH2 (витамин PP) (ρ = 1,03 г/мл)? 39. Определить массовую долю глюкозы в растворе изотоничном плазме крови при 37оС? ( ρ р-ра = 1 г/мл). 40. Что произойдет с эритроцитами крови, если их поместить в раствор глюкозы: а) с = 0,2 моль/л; г) = 2% ( = 1,01 г/мл); б) с = 0,5 моль/л; д) с = 0,3 моль/л; в) = 6% ( ρ = 1,03г/мл); е) = 4,5% (ρ = 1,02 г/мл)? о Росм.крови = 7,7 атм. при 37 С. 41. Осмотическое давление раствора, содержащего 0,2 г белка в 10 мл, при 25оС равно 10-3 атм. Определить молярную массу белка. 42. Рассчитать осмотическое давление физиологического раствора (0,86% раствора хлорида натрия) при 37оС. Степень диссоциации хлорида натрия принять за 1, ρ = 1 г/см3. 6 43. Каково будет понижение давления пара раствора, содержащего 4 г NaOH в 190 г воды, если кажущаяся степень диссоциации гидроксида натрия в этом растворе 80% при 100оС? 44. В каком из растворов хлорида натрия: 2%; 0,86%; 0,2% жизнедеятельность эритроцитов не будет нарушена и почему? Росм. крови = 7,7 атм, t = 37оС. Плотность растворов и степень диссоциации NaCl считать равными единице. 45. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы (С12Н22О11) в 350г Н2О при 293К. Плотность раствора считать равной единице. 46. К 100мл 0,5 М водного раствора сахарозы (С12Н22О11) добавлено 300мл воды. Чему равно осмотическое давление полученного раствора при 250С? 47. Сколько молей неэлектролита должен содержать 1л раствора, чтобы его осмотическое давление при 250С было равно 2,47 кПа? 48. В 1мл раствора содержится 1018 молекул растворенного неэлектролита. Вычислить осмотическое давление раствора при 298 К. 49. Вычислить осмотическое давление на мембрану, отделяющую воду от 9% о раствора глюкозы (ρ=1,08 г/мл ), при18 С. 50. Определить молярную концентрацию раствора неэлектролита изотоничного при о 37 С плазме крови (Росм. крови = 7,7 атм.). 51. Что произойдет с эритроцитами крови, если их поместить в 9% раствор глюкозы о ( ρ=1,08 г/мл) при t = 25 С? 52. При 00С осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации К2СО3 в растворе. 53. Кажущаяся степень диссоциации хлорида калия в 0,3 н. растворе равна 0,80. Чему равно осмотическое давление этого раствора при 170С? о о 54. Растворимость NaCl при 10 C равна 29 г, а при 90 C составляет 56 г. Сколько мл воды необходимо взять для перекристаллизации технической соли? Сколько перекристаллизованной соли можно получить теоретически, если исходная масса технической соли равна: а) 100 г; б) 150 г; в) 230 г; г) 1 кг? о 55. Из 500 г 15%-го раствора сульфита натрия при охлаждении до 0 C выпало 36 г Na2SO3·7H2O. Вычислить растворимость безводного сульфита натрия в 100 г о воды при 0 C. о 56. При 25 C растворимость сульфата меди в воде равна 16 г. Сколько граммов о о медного купороса выделится при 25 C из 500 г насыщенного при 90 C раствора, о если растворимость CuSO4·5H2O при 90 С равна 64,2 г? о о 57. Растворимость Al2(SO4)3 при 0 С равна 31,2 г, а при 100 С - 89,0 г. Какая масса о Al2(SO4)3·18H2O выделится при охлаждении до 0 С из m г насыщенного при о 100 С раствор, если: а) m = 100 г; б) m = 200 г; в) m = 350 г; г) m = 1 кг? 7 ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 58. Степень диссоциации муравьиной кислоты НСООН в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты и значение рК. 59. Степень диссоциации угольной кислоты Н2СО3 по первой ступени в растворе равна 2,1110-3. Вычислить К1. 0,1н. 60. Сколько воды нужно прибавить к 300мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации уксусной кислоты удвоилась? 61. Сколько ионов и молекул содержит 1 мл 0,001 М раствора уксусной кислоты? Чему равен рН этого раствора? 62. Рассчитать ионную силу 0,1 моляльных растворов: а) ацетата натрия; в) MgSO4; б) Na2SO4; г) К3РО4. 63. Рассчитать активность ионов Mg2+ в водном растворе, содержащем 0,001 М Na2SO4 и 0,005М MgCl2 при 250С. 64. Вычислить рН раствора, содержащего 1,12 г КОН в 1,5 л раствора. 65. Как изменится рН дистиллированной воды, если в 1 л ее растворить 0,005 моль КОН? 66. Смешали равные объёмы 0,01М Н2SO4 и 0,03 М КОН. Вычислить рН образовавшегося раствора. 67. Для коррекции кислотно-щелочного равновесия при алкалозе используют 5% раствор аскорбиновой кислоты (Ка = 7,9·10-5; М (С6Н8О6) = 167 г/моль; ρ = 1,05 г/см3). Определить [H+] и рН данного раствора. 68. Вычислить рН 0,2 М раствора СН3СООК. К (СН3СООН) = 1,76 · 10-5. 69. Вычислить рН раствора, полученного добавлением к 2 л Н2О 0,5 мл 40% NaOH (ρ = 1,28 г/см3). 70. Используя справочные данные, определить водный раствор какой соли (концентрации равны) будет иметь больше значение рН: KCl, KClO или CH3COOK. Ответ обосновать. 71. Каково будет конечное значение рН раствора, полученного при смешивании 500 мл 0,1 н. гидроксида аммония и 100 мл 0,5 н. HCl? 72. Известно, что рН 0,01 М раствора соли KatAn, гидролизующейся по аниону, равен 10. Определить степень гидролиза соли, константу гидролиза и константу диссоциации кислоты HAn. 73. Вычислить рН раствора, содержащего 0,56 г КОН в 2 л раствора. 74. Как изменится рН дистиллированной воды, если в 1 л ее растворить 0,002 моль H2SO4? 75. Определить рН 0,02 М растворов: а) СН3СООН (Ка=1,76·10-5); в) HNO2 (Ка = 6,9·10-4); 8 б) NH3·H2O (Кв=1,755·10-5); г) HClO (Ка = 2,95·10-8). 76. Рассчитать степень диссоциации, [Н+] и рН 0,1 М раствора молочной кислоты (Ка =1,58·10-4). (Фармацевтические препараты – лактат железа, лактат кальция являются солями этой кислоты). 77. Сколько мл 0,1М раствора КОН потребуется для нейтрализации 20 мл раствора серной кислоты, имеющего рН = 2? 78. Вычислить константу гидролиза хлорида аммония, степень гидролиза и рН 0,1М раствора. (Кb = 1,755·10-5). 79. Значение рН раствора натриевой соли некоторой кислоты НА с концентрацией 0,1 моль/л равно 9. Вычислить константу диссоциации этой кислоты. 80. Расположить в ряд в порядке возрастания рН следующие растворы: 80.1. 80.2. а) 0,01М КОН, а) HCl, б) 0,01М СН3СOONH4, б) NaCl, в) 0,01М HNO3, в) NH3, г) 0,01М KCI, г) HNO2, д) 0,01М CH3COOH, д) NH4NO3, е) 0,01М NН3, е) KOH, ж) 0,01М NH4Cl. ж) NH4HS. Ответ обосновать. 81. Даны соли: 1. CH3COONa; 4. NH4NO3; 2. Na2S; 5. AgNO3; 3. NaHCO3; 6. Na2CO3. а) Написать ионно-молекулярное уравнение гидролиза соли, объяснить механизм гидролиза соли; б) вычислить константу гидролиза соли (в случае ступенчатого гидролиза по первой ступени); в) найти степень гидролиза соли и рН раствора, если концентрация равна: 0,1 моль/л; 0,01 моль/л; г) перечислить факторы усиливающие гидролиз и подавляющие гидролиз. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 82. Вычислить растворимость РbSO4 в воде и 0,1М Na2SO4. 83. Образуется ли осадок при сливании равных объемов 0,01М CuCI2 и 0,02М NaOH ? 9 84. Образуется ли осадок при сливании равных объемов 0,02М CaCI2 и 0,01М Na2SO4? о 85. Вычислить ПР PbBr2 при 25 C, если растворимость соли при этой температуре составляет 1,32·10-2 моль/л. 86. Вычислить растворимость CaC2O4 в воде и 0,2М СaCl2. ПР (CaC2O4) см. в приложении. 87. Определить концентрацию иодид-ионов в насыщенном растворе PbI2. ПР (PbI2) см. в приложении. 88. Выпадет ли осадок КНС4Н4О6 при смешении равных объемов 0,03 М раствора КС1 и 0,3 М раствора NaHC4H4O6? 89. Вычислить растворимость BaSО4 в воде. Во сколько раз растворимость BaSO4 в 0,01 М растворе Na2SO4 меньше, чем в чистой воде? 90. Концентрация хлорид ионов в межклеточной жидкости равна 114 ммоль/л. Образуется ли осадок, если к 20 мл этой жидкости добавить 2 капли 0,01 М раствора AgNO3? (Объём капли 0,05 мл). ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 91. Используя справочные материалы, составить уравнения окислительновосстановительных реакций: а) KMnO4 + FeSO4 + H2SO4 → б) K2Cr2O7 + FeSO4 + H2SO4 → в) MnSO4 + H2O2 + NaOH → г) CrCl3 + H2O2 + NaOH → д) HClO + KI + H2SO4 → е) K2Cr2O7 + KNO2 + H2SO4 → ж) KIO3 + SnCl2 + HСl → з) KMnO4 + K4[Fe(CN)6] + H2SO4 → и) Br2 + K2SO3 + KOH → 92. Установить, можно ли приготовить водный одновременно: а) азотную кислоту и хлороводород; б) азотную кислоту и серную кислоту; в) перманганат калия и сульфит калия; г) перманганат калия и сульфат железа (III); д) нитрит калия и йодоводород? раствор, содержащий 93. Подобрать коэффициенты электронно-ионным методом (методом полуреакций) и рассчитать молярные массы эквивалентов окислителя и восстановителя в следующих реакциях: а) FeSO4 + HNO3 + H2SO4 → Fe2(SО4)3 + NO↑ + H2О; б) FeSO4 + KMnO4 + H2SO4 → Fe2(SО4)3 + MnSO4 + H2О + K2SO4; в) CrCl3 + KMnO4 + KOH → K2CrО4 + KCl + H2О + MnO2; 10 г) CrCl3 + H2O2 + KOH → K2CrО4 + KCl + H2О; д) MnCl2 + H2O2 + KOH → H2MnО3 + KCl + H2О; е) KMnO4 + H2O2 + H2SO4 → MnSO4 + K2SO4 + O2 + H2О; ж) K2Cr2О7 + KI + H2SO4 → Cr2(SО4)3 + H2О + K2SO4 + I2; з) K2Cr2О7 + H2SO4 + Na2SO3 → Cr2(SО4)3 + Na2SO4 + K2SO4 + H2О; и) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2О; к) Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H2О; л) SnCl2 + BiCl3 + KOH → K2SnО3 + KCl + H2О + Bi.; м) CrCl3 + Br2 + KOH → K2CrО4 + KCl + KBr + H2О; н) P + HNO3 + H2O → H3PО4 + NО; о) KCrO2 + Br2 + KOH → K2CrО4 + KBr + H2О; п) Ag + HNO3 → AgNO3 + NO↑ + H2О; СТРОЕНИЕ АТОМА, ХИМИЧЕСКАЯ СВЯЗЬ 94. Какие характеристики орбиталей определяются значением: а) главного квантового числа – n, б) орбитального квантового числа – l, в) магнитного квантового числа – ml ? 95. Напишите электронные и электроно-графические формулы: 17Cl, 17Cl¯, 16S, 16S2-, 2+ 4+ 2+ 3+ 2+ 12Mg, 12Mg , 14Si , 26Fe, 26Fe , 26Fe , 28Ni . 96. Атому какого из элементов отвечает каждая из приведенных формул: а) 1s22s22p3; б) 1s22s22p63s23p6; в) 1s22s22p63s23p63d34s2; г) 1s22s22p63s23p63d104s1; д) 1s22s22p63s23p63d104s24p2? 97. Атомы каких элементов имеют конфигурацию внешнего и предвнешнего слоев: а) ns2np1; д) ns2np6; б) ns2np5; е) (n-1)d10ns1; в) (n-1)d2ns2; ж) (n-1)d5ns1? г) (n-1)d7ns2; 98. Охарактеризовать набором квантовых чисел каждую из следующих орбиталей: 1s, 2p, 3d. 99. Какова максимальная емкость слоев K, L, M, N? 100. Указать число орбиталей, которые характеризуются следующими значениями орбитального квантового числа l: 3; 2; 1; 0. 101. Какой из атомов имеет большее значение энергии ионизации и чем это объяснить? а) N или О? б) Ве или В? 102. Какой из атомов имеет большее сродство к электрону и чем это объясняется? 11 а) N или О? б) Li или Ве? 103. Привести электронные конфигурации невозбужденных и возбужденных состояний атомов и ионов: C, Cl, S, Fe2+, Fe3+. 104. Какой тип гибридизации орбиталей центрального атома наиболее вероятен для молекул NH3, CH4, H2O, BH3, BeH2? 105. Молекула SnCl2 (в газовой фазе) имеет угловую форму, а молекула HgCl2−линейную. Объяснить эти данные. 106. Объяснить причины, по которым химическая связь в молекуле F2 менее прочная, чем связь в молекуле Cl2. Наблюдается ли аналогичное упрочнение связи в молекулах кислорода и серы ? 107. По методу молекулярных орбиталей сопоставить прочность химической связи в частицах: а) Н2+, Н2, Н2–, Н22–; в) B2, C2, N2, O2; + – 2– б) О2 , О2, О2 , О2 ; г) Li2–, Li2, Li2+. 108. Ионы Li+ и Н– имеют одинаковое число электронов. Какой ион больше? Ответ обосновать. 109. Дипольные моменты молекул СО2 и СS2 равны нулю. Почему дипольный момент молекулы СОS высок? (6,61·10–30 Кл · м). 110. Указать, какие из следующих веществ имеют дипольный момент: SO2, СО2, CH3Cl, CCl4. 111. Описать природу химической связи в комплексе NH3·BF3 . 112. Почему валентный угол в молекуле NH3 больше, чем в молекуле Н2О? 113. Объяснить. природу химической связи в каждом из указанных ниже веществ. Как обусловлены физические свойства этих веществ типом химической связи? а) железо, б) алмаз, в) бром, г) молибден, д) поваренная соль, е) карборунд [карбид кремния], ж) глюкоза. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 114. Как с позиции метода ВС объяснить характер связей и координационное число в соединениях [Zn(NH3)4]SO4; [Ag(NH3)2]OH; K3[Fe(CN)6]; [Ni(CO)4]? 115. Чем объяснить различное пространственное строение комплексных ионов? Ион-комплексообразователь Соединение Форма Ag+ [Ag(NH3)2]+ Линейная Zn2+ [Zn(CN)4]2- Тетраэдрическая Cr3+ [Cr(OH)6]3- Октаэдрическая 12 116. Назвать следующие комплексные соединения: K[Al(OH)4(H2O)2]; [Fe(H2O)6]Cl3; [Cr(H2O)4Cl2]Cl; [Co(NH3)6]SO4; [Pt(NH3)2Cl2]. [Cu(NH3)4](SO4)2; [Pt(NH3)4][PtCl4]; 117. Написать уравнения диссоциации следующих комплексных соединений: [Cu(NH3)4]Cl; K[BiI4]; Cu2[Fe(CN)6]; [Cr(H2O)6]Cl3; Na[Cr(OH)4]; K2[HgI4] 118. Написать выражения констант нестойкости для следующих комплексных ионов: [Co(NO2)6]3ˉ; [PtCl2(NH3)4]2+; [Ag(NH3)2]+; [Fe(CN)6]4ˉ; [Ni(NH3)4]2+; [Cr(H2O)6]3+. 119. Вычислить концентрацию ионов серебра в 0,1М растворе хлорида диамминсеребра (I). Как изменится концентрация [Ag+], если к одному литру раствора соли добавить один литр 0,2 М раствора NН3? 120. Вычислить концентрацию ионов Ni2+ в 0,1 М растворе K2[Ni(CN)4]. Kнест.([Ni(CN)4]2–)=1·10–22. 121. Произойдет ли разрушение комплекса [HgCl4]2–,если к 1 л 0,1 М раствора K2[HgCl4] добавить 0,078 г Na2S? Kнест( [HgCl4]2-)=6·10-17, ПРHgS = 1,6·10-52. 122. Какие комплексные соединения называются кластерами, хелатами? Привести примеры. 123. Написать уравнения реакций в молекулярной и ионной форме: 1) K[Ag(CN)2] + K2S → , 2) K[Ag(NO2)2]+ KBr → , 3) [Cd(NH3)4]Cl2 + NaOH → , зная константы нестойкости комплексных ионов и произведение растворимости: ПРAg2S = 6·10-50, ПРAgBr = 6·10-13, ПРCo(OH)2 =2·10-14. 124. Через водный раствор K4[Fe(CN)6] пропустили Cl2. Написать уравнение реакции. 125. К водному раствору: 1) K2[SnCl6] добавили цинк; 2) [Ag(NH3)2]Cl добавили железо? Написать уравнения химических реакций. 126. Найти массу серебра, находящегося в виде ионов в 0,5л 0,1 М раствора ди(тиосульфато)аргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия. 13 РАСЧЕТЫ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ 127. С какими из перечисленных веществ и в каких количествах взаимодействует 2,24 л (н.у.) HBr: а) Ca(OH)2; б) PCl3, в) Н2SO4 (конц.), г) KI, д) Mg, е) KСlO3? При этом HBr проявляет свойства: 1) кислоты; 2) основания; 3) окислителя; 4) восстановителя. 128. Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСlO3, чтобы восстановить 16,9г ее до HCl? 129. Требуется растворить некоторое количество меди в азотной кислоте. В каком случае расход азотной кислоты будет меньше – при применении 90% или 35%-ного (по массе) раствора HNO3 (в молях)? 130. Какой объем СО2 (н.у.) можно получить из 210г NaHCO3: а) прокаливанием; б) действием кислоты? 131. Кусочек латуни, массой 10 г (50% Cu, 50% Zn), растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой – избыток щелочи. В растворе или в осадке и в виде каких соединений находятся цинк и медь в обоих случаях? Определить массы веществ. 132. Как осуществить превращение: а) Cr2O3 → K2CrO4 → K2Cr2O7 → Cr2(SO4)3 → K3[Cr(OH)6]; б) Fe → FeCl2 → FeCl3 → Fe(NO3)3 → Fe2O3 → FeO → FeCl2 → Fe(OH)2 → Fe(OH)3; в) FeCl3 ? ? ? ?; + г) AgNO3 → [Ag(NH3)2] → AgI → [Ag(S2O3)2]3- → Ag2S; д) Zn → ZnSO4 → [Zn(NH3)4]2+ →[Zn(H2O)4]2+ →[Zn(OH)4]2- ; е) Hg → Hg(NO3)2 → HgO → Hg → HgS → Hg(NO3)2 ; ж) СuSO4 → CuBr2 → CuCl2 → Cu(NO3)2 → Cu(OH)2 → CuOH → Cu2O → Cu → CuSO4 133. Железо, содержащееся в 10 мл анализируемого раствора FeSO4, окислено до железа (III) и осаждено в виде гидроксида. Масса прокаленного осадка оказалась равной 0,4132 г. Вычислить молярную концентрацию FeSO4 в исходном растворе. 134. Для окисления 270 мг нитрита щелочно-земельного металла потребуется 30 мл подкисленного раствора перманганата калия с концентрацией с (KMnO4) = 0,04 моль/л. Какой металл входил в состав нитрита? 135. Соль Мора содержит 14,23% Fe2+, 9,2% NH4+, 49,00% SO42- и 27,57% Н2О. Составить формулу этой соли. Написать уравнение реакции соли Мора с подкисленным раствором KMnO4. 136. Амальгаму натрия (ω (Na) = 15%) массой 8 г обработали 100 мл воды. Определить массовую долю щелочи в образовавшемся растворе. 14 137. Какой объем двумолярного раствора аммиака необходимо взять для осаждения Al(OH)3 из 300 мл раствора AlCl3 с ω=20% и ρ=1,2 г/мл? Какой объем децимолярного раствора NaOH необходимо добавить к осадку для его полного растворения? 138. Смесь алюминия и углерода массой 5 г сильно нагрели, образовавшийся твердый осадок обработали избытком соляной кислоты. Вычислить объем выделившегося газа (н.у.), если известно, что масса нерастворившегося остатка составила 0,752 г. 139. 50 мл раствора щавелевой кислоты было приготовлено из кристаллогидрата H2C2O4·2H2O массой 0,063 г. На реакцию с ним было затрачено 8,3 мл раствора KMnO4, подкисленного серной кислотой. Определить молярную концентрацию эквивалента KMnO4. 140. Какой объем 0,1 М раствора KNO2 необходим для реакции с 2 мл 15%-го KI раствора (ρ = 1,12 г/см3)? В какой среде протекает эта реакция? Определить массу полученных продуктов. 141. Какой минимальный объем 20%-го раствора аммиака (ρ = 0,93 г/см3) потребуется для растворения 14,35 г хлорида серебра? 142. Какой объем кислорода выделится при взаимодействии избытка перхлората калия с раствором H2O2 (ρ = 1,09 г/мл) объемом 200 мл, в котором массовая доля Н2О2 составляет 20% ? 143. К 200г раствора 5% сульфата марганца (II) добавили избыток щелочи и 20 г 3% раствора Н2О2.Вычислить массу образовавшегося осадка. 144. На реакцию с 10 мл подкисленного раствора Н2О2 (ρ = 1 г/мл) израсходовалось 30 мл 0,05 М раствора KMnO4. Определить массовую долю Н2О2 в растворе. 145. Объем раствора, образовавшегося после гидролиза пероксида натрия, составил 750 мл. Для нейтрализации 5 мл этого раствора потребовалось 15 мл 0,2 н. раствора НCl. Сколько граммов пероксида натрия вступило в реакцию с водой? 15 ТЕСТОВЫЕ ЗАДАНИЯ Тестовый контроль включает тесты с выбором правильного ответа. В зависимости от формулировки выбирается один или несколько правильных ответов; Приступая к работе над тестами, следует внимательно изучить соответствующий материал по учебникам и лекциям. Необходимый справочный материал можно получить из таблиц (Периодической системы элементов Д.И. Менделеева, растворимости оснований и солей, шкалы относительной электроотрицательности элементов по Полингу), помещенных в конце пособия. Строение вещества 1.ИЗ УКАЗАННЫХ НИЖЕ СООТНОШЕНИЙ МОЖНО ОТНЕСТИ К ОСНОВНЫМ ПОЛОЖЕНИЯМ КВАНТОВОЙ ТЕОРИИ: а) периодический закон Д.И. Менделеева б) соотношение Де-Бройля между волновыми и корпускулярными свойствами в) соотношение Ньютона между силой и ускорением г) соотношение Эйнштейна между массой и энергией д) принцип Паули 2.ЭЛЕКРОННАЯ ОРБИТАЛЬ - ЭТО: а) набор четырех квантовых чисел б) траектория движения электрона в атоме в) функция, описывающая вероятность нахождения электрона в околоядерном пространстве г) совокупность электронных орбит атома д) форма и область пространства, где вероятность нахождения электрона менее 10% 3.ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО n ХАРАКТЕРИЗУЕТ: а) ориентацию орбитали в пространстве б) форму орбитали в) общую энергию электрона; г) число электронов в атоме д) энергию связи электрона с ядром 4.ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО ℓ ХАРАКТЕРИЗУЕТ: а) расстояние максимальной электронной плотности от ядра б) форму атомной орбитали; в) число электронов в атоме 16 г) ориентацию атомной орбитали в пространстве д) число электронов на уровне 5.МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО mℓ ХАРАКТЕРИЗУЕТ: а) ориентацию атомной орбитали в пространстве б) форму атомной орбитали в) общую энергию электрона; г) собственное вращение электрона д) число электронов на уровне 6.СПИНОВОЕ КВАНТОВОЕ ЧИСЛО s ХАРАКТЕРИЗУЕТ: а) энергию электрона б) собственное вращение электрона в) число электронов в атоме г) форму атомной орбитали д) радиус орбитали 7.МАКСИМАЛЬНОЕ ЧИСЛО ЭЛЕКТРОНОВ НА УРОВНЕ ОПРЕДЕЛЯЮТ ПО ФОРМУЛЕ: а) n2; б) 2n2 в) 2l +1; г) 2(2l +1) д) 2l2 8.ЭЛЕКТРОН ИМЕЕТ ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l = 2. ОН ЗАСЕЛЯЕТ ОРБИТАЛИ ТИПА : а) f б) р в) s г) d д) q 9.ЭЛЕКТРОН ЗАСЕЛЯЕТ ТРЕТИЙ КВАНТОВЫЙ СЛОЙ, А ЕГО АТОМНАЯ ОРБИТАЛЬ ИМЕЕТ ГАНТЕЛЕВИДНУЮ ФОРМУ. ЗНАЧЕНИЯ n И l У ЭТОГО ЭЛЕКТРОНА: а) n=3, l=3 б) n=3, l=1 в) n=3, l=0 г) n=3, l=2 д) n=3, l=4 17 10.АТОМНАЯ ОРБИТАЛЬ ЭЛЕКТРОНА, НАХОДЯЩЕГОСЯ НА 4 КВАНТОВОМ СЛОЕ ИМЕЕТ ФОРМУ 4-Х-ЛЕПЕСТКОВОЙ РОЗЕТКИ. УКАЖИТЕ ЗНАЧЕНИЯ ГЛАВНОГО И ОРБИТАЛЬНОГО КВАНТОВЫХ ЧИСЕЛ: а) n=4, l=3 б) n=4, l=2 в) n=4, l=1 г) n=4, l=0 д) n=4, l=4 11.3d104s2-КОНФИГУРАЦИЯ ВАЛЕНТНЫХ ЭЛЕКТРОНОВ ПРИНАДЛЕЖИТ ЭЛЕМЕНТУ: а) Ca б) Zn в) Ni г) Kr д) Сu 12.ЭЛЕКТРОННУЮ ФОРМУЛУ АТОМА 1s22s22p63s23p63d64s2 ИМЕЕТ ХИМИЧЕСКИЙ ЭЛЕМЕНТ: а) Ca б) Fe в) Co г) Ni д) Zn 13.ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ СООТВЕТСТВУЕТ БРОМИД-ИОНУ: а) 4s24p4 б) 4s24p5 в) 4s24p2 г) 4s24p3 д) 4s24p6 14.ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ ИОНА Cu2+ СООТВЕТСТВУЕТ ФОРМУЛЕ: а) 1s22s22p63s23p63d104s24p1 б) 1s22s22p63s23p6 в) 1s22s22p63s23p63d10; г) 1s22s22p63s23p63d9 д) 1s22s22p63s23p63d94s2 15.СРОДСТВОМ К ЭЛЕКТРОНУ НАЗЫВАЮТ: 18 а) способность атома данного элемента к оттягиванию на себя электронной плотности б) энергию, необходимую для отрыва электрона от нейтрального атома в) энергию, выделяющуюся при присоединении электрона к атому г) переход электрона на более высокий энергетический уровень д)способность атома данного элемента к отдаче электрона 16.ЭНЕРГИЕЙ ИОНИЗАЦИИ НАЗЫВАЮТ: а) энергию, необходимую для отрыва электрона от нейтрального атома б) способность атома к оттягиванию на себя электронной плотности в) переход электрона на более высокий энергетический уровень г) выделение энергии при присоединении электрона к атому или иону д) способность атома отталкивать от себя электронную плотность 17.ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ НАЗЫВАЮТ: а) энергию, необходимую для отрыва электрона от невозбужденного атома б) способность атома элемента оттягивать на себя электронную плотность в) переход электрона на более высокий энергетический уровень г) выделение энергии при присоединении электрона к атому или иону д) способность атома отталкивать от себя электронную плотность 18.ПРАВИЛЬНО УКАЗАН ХАРАКТЕР ИЗМЕНЕНИЯ В ГРУППЕ (А) СВЕРХУ ВНИЗ РАДИУСА АТОМА (R), ЭНЕРГИИ ИОНИЗАЦИИ (I), ЭНЕРГИИ СРОДСТВА К ЭЛЕКТРОНУ (Е), ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ (ЭО) В РЯДУ: а) r-увеличивается, I, Е, ЭО – уменьшается б) r-уменьшается, I, Е, ЭО – увеличиваются в) все эти параметры увеличиваются г) все эти параметры уменьшаются д) r, I- увеличиваются; E, ЭО-уменьшаются 19.ВОЗРАСТАНИЕ РАДИУСА АТОМОВ ПРОИСХОДИТ В РЯДУ ЭЛЕМЕНТОВ: а) Si, Al, Mg, Na б) Na, Mg, Al, Si в) Al, Si, P, S г) Sr, Ca, Mg, Be д) Cs, K, Na, Li 20.ВОЗРАСТАНИЕ ОТНОСИТЕЛЬНОЙ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ПРОИСХОДИТ В РЯДУ ЭЛЕМЕНТОВ : а) Mg, Ca, Sr, Ba б) S, Se, Te, Po 19 в) B, Al, Ga, In г) Be, B, C, N д) I, Br, F, Cl 21.КОЛИЧЕСТВО ЭЛЕКТРОНОВ, УЧАСТВУЮЩИХ В ОБРАЗОВАНИИ ХИМИЧЕСКИХ СВЯЗЕЙ В МОЛЕКУЛЕ N2, РАВНО: а) 4 б) 2 в) 6 г) 3 д) 8 22.МАКСИМАЛЬНАЯ ДОЛЯ ИОННОЙ СВЯЗИ В ВЕЩЕСТВЕ: а) MgCl2 б) CaCl2 в) SrCl2 г) BaCl2 д) BeCl2 23.ВЫБЕРИТЕ ПАРУ ВЕЩЕСТВ, ВСЕ СВЯЗИ В КОТОРЫХ – ИОННЫЕ: а) CHCl3, N2O3 б) KCl, CaO в) CO2, CaF2 г) PCl5, KI д) N2O5, BaO 24.ВЫБЕРИТЕ ПАРУ ВЕЩЕСТВ, ВСЕ СВЯЗИ В КОТОРЫХ – КОВАЛЕНТНЫЕ: а) NaCl, N2O б) CaO, HCl в) HBr, CCl4 г) CaBr2, LiBr д) NaF, HF 25.МОЛЕКУЛА ФОСФИНА РН3 МОЖЕТ ОБРАЗОВАТЬ ХИМИЧЕСКУЮ СВЯЗЬ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ С: 20 а) Н+ б) СН4 в) Н– г) Н2 д) SiCl4 26.ДОНОРОМ ЭЛЕКТРОННОЙ ПАРЫ ЯВЛЯЕТСЯ: а) BH3 б) NH3 в) SiH4 г) NH4+ д) AlCl3 27.АКЦЕПТОРОМ ЭЛЕКТРОННОЙ ПАРЫ ЯВЛЯЕТСЯ: а) AlCl3 б) NH4+ в) NH3 г) BF4— д) PCl3 28.УТВЕРЖДЕНИЕ ОШИБОЧНО: а) двойная и тройная связь всегда включают π - связь б) одинарная связь всегда σ - типа в) чем больше кратность связи, тем она менее прочная г) чем выше кратность связи, тем меньше ее длина д) чем больше кратность связи, тем она более прочная 29.НА ОСНОВАНИИ ХАРАКТЕРА МЕЖМОЛЕКУЛЯРНЫХ СВЯЗЕЙ УСТАНОВИТЕ, В КАКОМ РЯДУ РАСТЕТ ТЕМПЕРАТУРА КИПЕНИЯ ВЕЩЕСТВ: а) BaCl2 – HF – He б) He – BaCl2 – HF в) HF – He –BaCl2 г) He – HF – SrCl2 д) HCl – He – CaCl2 30.КРИСТАЛЛИЧЕСКУЮ РЕШЕТКУ МЕТАЛЛИЧЕСКОГО ТИПА ОБРАЗУЕТ ЭЛЕМЕНТ С ЭЛЕКТРОННОЙ КОНФИГУРАЦИЕЙ АТОМА: а) 2s1 21 б) 3s23p2 в) 4s24p5 г) 1s1 д) 2s2 Основы теории химических процессов 31.ЭНТАЛЬПИЯ - ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ - РАВНА: а) H = U – pV б) H = U + pV в) H = ∆U – p∆V г) H = ∆U – pV д) H = U + p∆V 32.В ИЗОЛИРОВАННОЙ СИСТЕМЕ ВОЗМОЖНЫ ЛИШЬ САМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ, СОПРОВОЖДАЮЩИЕСЯ: а) постоянством энтропии б) увеличением энтропии в) уменьшением энтропии г) постоянством температуры д) увеличением температуры 33.В СИСТЕМЕ, НАХОДЯЩЕЙСЯ ПРИ Т, Р = const,ВОЗМОЖНЫ ЛИШЬ ПРОЦЕССЫ СОПРОВОЖДАЮЩИЕСЯ: а) возрастанием энергии Гиббса б) убылью энергии Гиббса в) возрастанием энтропии г) убылью энтропии д) постоянством внутренней энергии 36.ЭНЕРГИЯ ГИББСА ЯВЛЯЕТСЯ КРИТЕРИЕМ НАПРАВЛЕННОСТИ И РАВНОВЕСИЯ ПРОЦЕССА: а) в изолированной системе б) в открытой системе в) в закрытой системе при T,P = const г) в закрытой системе при любых Т, Р д) для любых условий 22 37.ОЦЕНИТЕ ЗНАКИ ЭНТАЛЬПИЙНОГО И ЭНТРОПИЙНОГО ФАКТОРОВ РЕАКЦИИ: 4HCl(г) + О2 (г)= 2Сl2 (г) + 2Н2О(ж) а) ∆H=0, ∆S>0 б) ∆H<0, ∆S<0 в) ∆H<0, ∆S>0 г) ∆H<0, ∆S=0 д) ∆H=0, ∆S=0 38.ЭКЗЭРГОНИЧЕСКИМИ НАЗЫВАЮТСЯ ПРОЦЕССЫ, ДЛЯ КОТОРЫХ : а) ∆H<0 б) ∆G<0 в) ∆S>0 г) ∆H>0 д) ∆G>0 39.ЭНДЭРГОНИЧЕСКИМИ НАЗЫВАЮТСЯ ПРОЦЕССЫ, ДЛЯ КОТОРЫХ : а) ∆H>0 б) ∆G>0 в) ∆H<0 г) ∆G<0 д) ∆S>0 40.РАЗМЕРНОСТЬ СКОРОСТИ ГОМОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ: а) моль/с б) моль/л в) моль/(л.с) г) (моль.л/с) д) (л.с)/моль 41.ЭКСПЕРИМЕНТАЛЬНО УСТАНОВЛЕНО, ЧТО РЕАКЦИЯ H2O2 + 2HI = I2 + 2H2O ИМЕЕТ ПЕРВЫЙ ПОРЯДОК ПО КАЖДОМУ ИСХОДНОМУ ВЕЩЕСТВУ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС: а) υ = k[H2O2][HI] б) υ = k[H2O2]2[HI] в) υ = k[H2O][I2] г) υ = k[H2O2][HI]2 д) υ = k[H2O2]2[HI]2 23 42.ПЕРИОД ПОЛУПРЕВРАЩЕНИЯ НЕ ЗАВИСИТ ОТ НАЧАЛЬНОЙ КОНЦЕТРАЦИИ ТОЛЬКО ДЛЯ РЕАКЦИИ …ПОРЯДКА: а) нулевого б) первого в) второго г) третьего д) дробного 43.НА ВЕЛИЧИНУ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ НЕ ВЛИЯЮТ: а) температура б) концентрация в) катализатор г) природа реагентов д) природа растворителя 44.ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ КОНСТАНТЫ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ, ПРОТЕКАЮЩЕЙ В РАСТВОРЕ: а) изменение температуры б) изменение концентрации в) введение катализатора г) удаление продуктов реакции д) введение продуктов 45.ВЫХОД ПРОДУКТОВ В РЕАКЦИИ N2(г) + 3H2(г) = 2NH3(г) + 92 кДж МОЖНО ПОВЫСИТЬ: а) Р - понижать, Т – повышать б) Р – повышать, Т – понижать в) Р и Т – понижать г) Р и Т повышать д) Р и Т не влияют на выход продукта 46.ВЫХОД ПРОДУКТОВ В РЕАКЦИИ СаСО3(тв) = СаО(тв) + СО2 (г)– 178 кДж МОЖНО ПОВЫСИТЬ: а) Р - понижать, Т – повышать 24 б) Р – повышать, Т – понижать в) Р и Т – понижать г) Р и Т повышать д) Р и Т не влияют на выход продукта 47.НАИБОЛЕЕ СИЛЬНЫЙ ВОССТАНОВИТЕЛЬ : а) φ0(S4O62–/S2O32–) = 0,096 В б) φ0(Fe3+/Fe2+) = 0,776 B в) φ0(MnO4–/Mn2+) = 1,56 B г) φ0(Sn4+/Sn2+) = 0,156 B д) φ0(Ag+/Ag) = 0, 799 В 48.НАИБОЛЕЕ УСТОЙЧИВ КОМПЛЕКСНЫЙ ИОН: а) [Hg(CN)4]2–, ,KH = 4 · 10–12 б) [HgBr4]2–, KH = 1 · 10–21 в) [HgCl4]2–, KH = 8,5 · 10–15 г) [HgI4]2–, KH = 1,5 · 10–30 д) [Hg(NH3)4]2+, KH = 5 · 10–20 49.КОНСТАНТА НЕСТОЙКОСТИ КОМПЛЕКСНОГО ИОНА [Ag(CN)2]– ЭТО ВЫРАЖЕНИЕ: а) [Ag+][CN–] б) [Ag+]·2[CN–] [ Ag ][CN ] в) Ag (CN ) 2 [ Ag ][CN ] 2 г) Ag (CN ) 2 д) [Ag+][CN–] 2 50.РАСТВОР ПРЕДСТАВЛЯЕТ СМЕСЬ KBr и KI. ВЫБЕРИТЕ ОКИСЛИТЕЛЬ, КОТОРЫЙ ОКИСЛИТ ИОДИД-ИОН, НЕ ЗАТРАГИВАЯ БРОМИД-ИОН φ0Br2/2Br– = 1,06 B; φ0I2/2I– = 0,54 B. а)φ0Cl2/2Cl– = 1,36 B б)φ0Fe3+/Fe2+ = 0,77 B в)φ0MnO4–/Mn2+ = 1,51 B г)φ0SO42–/SO2 = 0,17 B д) φ0PbO2/Pb2+ = 1,46 B 25 51.В ПРОБИРКЕ ОДНОВРЕМЕННО НАХОДЯТСЯ РАСТВОРЫ HCl и HBr. РЕАКТИВ, КОТОРЫМ МОЖНО ОКИСЛИТЬ БРОМИД-ИОН, НЕ ЗАТРАГИВАЯ ХЛОРИД-ИОН (φ0Br2/2Br– = 1,06 B; φ0Cl2/2Cl– = 1,36 B) : а) K2Cr2O7 (φ0Cr2O72–/2Cr3+= 1,33 B) б) PbO2 (φ0 PbO2/Pb2+ = 1,46 B) в) KMnO4 (φ0MnO4–/Mn2+ = 1,51 B) г)NaNO2 (φ0NO2–/NO = 0,99 B) д)Na2SO4 ( φ0SO42–/SO2 = 0,17 B) 52.ПРОЦЕСС ОКИСЛЕНИЯ ИДЕТ В СЛУЧАЕ: а) б) в) г) д) SO2 SO32– MnO42– MnO2 Zn ZnO22– AsO43- AsO33S H2S 53.ПРОЦЕСС ВОССТАНОВЛЕНИЯ ИДЕТ В СЛУЧАЕ: а) ClO– Cl– б) MnO42– MnO4– в) NH4OH N2 г) P2O5 H3PO4 д) H2MnO3 MnO2 54.ТОЛЬКО ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ: а) NO б) NO3– в) NO2– г) NO2 д) N2O 55.И ОКИСЛИТЕЛЕМ, И ВОССТАНОВИТЕЛЕМ ЯВЛЯЕТСЯ: а) NaNO2 б) NH3 в) NaNO3 г) NH4OH д) N2O5 26 56.MnO4– MnO2. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА MnO4– – ИОНА РАВНА: а) М/5 б) М в) M/4 г) М/2 д) М/3 57.H2S SO42–. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА H2S РАВНА: а) М/8 б) М в) М/2 г) М/6 д) M/4 58.СТАНДАРТНЫЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ (ΔH0,кДж/моль) ВОДОРОДНЫХ СОЕДИНЕНИЙ Р-ЭЛЕМЕНТОВ VА ГРУППЫ ИМЕЮТ НИЖЕПРИВЕДЕННЫЕ ЗНАЧЕНИЯ: AsH3 PH3 SbH3 NH3 BiH3 + 66,0 +5,1 +142,1 –46,2 +251,2 САМОЕ ТЕРМИЧЕСКИ НЕУСТОЙЧИВОЕ: а) AsH3 б) PH3 в) SbH3 г) NH3 д) BiH3 Учение о растворах. Равновесные процессы в растворах электролитов 59.ФОРМУЛА P=CRT (ЗАКОН ВАНТ-ГОФФА), ПОКАЗЫВАЮЩАЯ ЗАВИСИМОСТЬ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ ОТ КОНЦЕНТРАЦИИ И ТЕМПЕРАТУРЫ, ПРИМЕНИМA : а) к любым растворам б) только к растворам неэлектролитов в) только к растворам электролитов 27 г) к растворам слабых электролитов д) к растворам сильных электролитов 60.ПЛАЗМОЛИЗ КЛЕТОК БУДЕТ НАБЛЮДАТЬСЯ ПРИ ПОМЕЩЕНИИ ИХ В РАСТВОР NaCl С МАССОВОЙ ДОЛЕЙ: а) 0,1 % б) 10 % в) 0,9 % г) 0 % д) 0,7% 61.ФОРМУЛА P=CRT (ЗАКОН ВАНТ-ГОФФА) МОЖЕТ БЫТЬ ПРИМЕНЕНА К РАСТВОРАМ ЭЛЕКТРОЛИТОВ ПОСЛЕ ВВЕДЕНИЯ В КАЧЕСТВЕ СОМНОЖИТЕЛЯ: а) константы диссоциации б) диэлектрической проницаемости в) изотонического коэффициента г) степени диссоциации д) константы автопротолиза 62.ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА, ПОКАЗЫВАЮЩИЙ ЗАВИСИМОСТЬ СТЕПЕНИ ДИССОЦИАЦИИ ОТ КОНЦЕНТРАЦИИ, ПРИМЕНИМ: а) только для слабых электролитов б) только для сильных электролитов в) только для труднорастворимых электролитов г) для любых электролитов д) для неэлектролитов 63.СТЕПЕНЬ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА УВЕЛИЧИВАЕТСЯ ПРИ а) добавлении одноименного иона б) разбавлении раствора в) увеличении давления г) повышении концентрации раствора д) понижение температуры 64.УВЕЛИЧЕНИЕ рН РАСТВОРОВ ПРОИСХОДИТ В РЯДУ ЭЛЕКТРОЛИТОВ РАВНОЙ КОНЦЕНТРАЦИИ: 28 а) Н2SO4- Н2SO3- Н2S б) Н2S- Н2SO4- Н2SO3 в) Н2SO3- Н2S- Н2SO4 г) Н2SO3- Н2SO4- Н2S д) Н2S- Н2SO3- Н2SO4 65.СОЛЬ НАИМЕНЕЕ, РАСТВОРИМАЯ В ВОДЕ (В СКОБКАХ ДАНА ВЕЛИЧИНА ПР): а) CaCO3 (510-9) б) BaC2O4 (1,110-7) в) BaSO3 (110-7) г) CaSO4 (110-5) д) СаC2O4(6,3 10-8) 66.КОНЦЕНТРАЦИЯ КАТИОНА А В НАСЫЩЕННОМ РАСТВОРЕ ТРУДНОРАСТВОРИМОЙ СОЛИ ТИПА АВ2 РАВНА 210-3 МОЛЬ/Л. ВЫЧИСЛИТЬ ПР ЭТОЙ СОЛИ. а) 410-6 б) 410-9 в) 3,210-8 г) 210-3 д) 810-6 67.КОНЦЕНТРАЦИЯ АНИОНА В В НАСЫЩЕННОМ РАСТВОРЕ ТРУДНОРАСТВОРИМОЙ СОЛИ ТИПА АВ2 РАВНА 210-4 МОЛЬ/Л. ВЫЧИСЛИТЬ ПР ЭТОЙ СОЛИ. а) 810-12 б) 1,410-2 в) 410-12 г) 410-8 д) 1,610-9 68.ОСНОВНУЮ СОЛЬ (ГИДРОКСОСОЛЬ) ПРИ ГИДРОЛИЗЕ ОБРАЗУЕТ: а) AgNO3 б) Na2CO3 в) AlCl3 г) Na3PO4 д) Na2SO4 29 69. КИСЛУЮ СОЛЬ ПРИ ГИДРОЛИЗЕ ОБРАЗУЕТ: а) ZnCl2; б) Cr2(SO4)3; в) Na2SO4; г) Na2S. д) CH3COONa 70.ПО КАТИОНУ ГИДРОЛИЗУЕТСЯ СОЛЬ: а) MgCl2 б) Sr(NO3)2 в) CH3COOK г) Na2CO3 д) Na2S 71.ПО КАТИОНУ И АНИОНУ ГИДРОЛИЗУЕТСЯ СОЛЬ: а) Na2S б) (NH4)2SO4 в) (NH4)2CO3 г) CH3COOK д) Na2SO4 72. НЕ ПОДВЕРГАЕТСЯ ГИДРОЛИЗУ СОЛЬ: а) K3PO4 б) CsCl в) Na2SO3 г) Na2CO3 д) KNO2 73.СОЛЬ, ГИДРОЛИЗУЮЩАЯСЯ ПО АНИОНУ: а) K2SO3 б) K2SO4 в) ZnSO4 г) NaNO3 д) KI 74.ЛАКМУС ОКРАШЕН В РОЗОВЫЙ ЦВЕТ, А ФЕНОЛФТАЛЕИН – БЕСЦВЕТЕН В РАСТВОРЕ СОЛИ: 30 а) BaCl2 б) K2CO3 в) NaCl г) ZnCl2 д) СH3COONH4 75.ПРИ СЛИВАНИИ РАСТВОРОВ CrCl3 И K2CO3 ИДЕТ: а) б) в) г) д) первая ступень гидролиза с образованием CrOHCO3 и KHCO3 обменная реакция с образованием Cr2 (CO3)3 и KCl взаимное усиление гидролиза с образованием Cr(OH)3 и CO2 окислительно-восстановительная реакция гидролиз с образованием Cr(OH)Сl2 и KHCO3 76.СТЕПЕНЬ ГИДРОЛИЗА К3РО4 УМЕНЬШАЕТСЯ ПРИ ДОБАВЛЕНИИ: а) KCl б) CO2 в) HCl г) KOH д) H2O 77.СТЕПЕНЬ ГИДРОЛИЗА ZnCl2 ВОЗРАСТАЕТ ПРИ: а) добавлении Na2CO3 б) уменьшении температуры в) добавлении HCl г) увеличении концентрации раствора д) добавлении CH3COOH 78.ПОРЯДОК РАСПОЛОЖЕНИЯ РАСТВОРОВ РАВНОЙ МОЛЯРНОЙ КОНЦЕНТРАЦИИ СООТВЕТСТВУЕТ ВОЗРАСТАНИЮ pH: а) СH3COONa –NaCl – NH4Cl –HCl б) NH4Cl –HCl –NaCl – СH3COONa в) HCl – NH4Cl –NaCl – СH3COONa г) HCl – NaCl – NH4Cl – СH3COONa д) HCl – NH4Cl – СH3COONa –NaCl 79.ПОРЯДОК РАСПОЛОЖЕНИЯ РАСТВОРОВ РАВНОЙ МОЛЯРНОЙ КОНЦЕНТРАЦИИ СООТВЕТСТВУЕТ УМЕНЬШЕНИЮ pH : а) СH3COONa –NaCl – NH4Cl –HCl б)NH4Cl –HCl –NaCl – СH3COONa 31 в)HCl – NaCl – NH4Cl – СH3COONa г)HCl – NH4Cl – СH3COONa –NaCl д)СH3COONa – NH4Cl –NaCl – HCl 80.ПОРЯДОК РАСПОЛОЖЕНИЯ РАСТВОРОВ РАВНОЙ МОЛЯРНОЙ КОНЦЕНТРАЦИИ СООТВЕТСТВУЕТ ВОЗРАСТАНИЮ pH : а) СH3COONa –Na2SO4 – (NH4)2SO4 –H2SO4 б)(NH4)2SO4 –H2SO4 –Na2SO4 – СH3COONa в)H2SO4 –(NH4)2SO4 – Na2SO4 – СH3COONa г)H2SO4 –Na2SO4 – (NH4)2SO4 – СH3COONa д)СH3COONa –(NH4)2SO4 – Na2SO4 – H2SO4 81.КОГДА В РАСТВОР ЩЁЛОЧИ ПРИЛИВАЮТ ИЗБЫТОК КИСЛОТЫ, pH СРЕДЫ МОЖЕТ ИЗМЕНЯТЬСЯ СЛЕДУЮЩИМ ОБРАЗОМ: а)возрастать с 7до 8 б)возрастать с 3 до 8 в)уменьшаться с 7 до 6 г)уменьшаться с 9 до 5 д)уменьшаться с 9 до 7 82.В РАСТВОР КИСЛОТЫ ПРИЛИВАЮТ ИЗБЫТОК ЩЁЛОЧИ, pH СРЕДЫ МОЖЕТ ИЗМЕНЯТЬСЯ СЛЕДУЮЩИМ ОБРАЗОМ: а)возрастать с 7до 8 б)возрастать с 3 до 8 в)уменьшаться с 7 до 6 г)уменьшаться с 9 до 5 д)уменьшаться с 3 до 7 83.ЕСЛИ В РАСТВОРЕ УВЕЛИЧИВАЕТСЯ КОНЦЕНТРАЦИЯ ИОНОВ H+, ТО: а) численное значение pH раствора растёт б) концентрация ионов гидроксида растёт в) численное значение pH раствора уменьшается г) раствор становится меннее кислым д) численное значение pOH уменьшается Химия элементов 32 84.МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА S2O32–-ИОНА В ОВ-ПЕРЕХОДЕ 2S2O32– S4O62– РАВНА: а) М б) М/4 в) М/2 г) 2М д) М/6 85.В РАСТВОРЕ СОДЕРЖИТСЯ 0,1 МОЛЬ СОЕДИНЕНИЯ PdCl2 · 3NH3. РЕАГИРУЯ С AgNO3, ОНО ОБРАЗУЕТ 0,1 МОЛЬ ОСАДКА AgCl. УСТАНОВИТЕ ФОРМУЛУ СОЕДИНЕНИЯ. а) [PdCl2](NH3)3 б) [PdCl(NH3)3]Cl в) [PdCl2(NH3)3] г) [Pd(NH3)3]Cl2 д) [Pd(NH3)2 Cl2]NH3 86.УКАЖИТЕ РЯД, СОДЕРЖАЩИЙ ТОЛЬКО КИСЛОТНЫЕ ОКСИДЫ а) б) в) г) д) P2O5; Al2O3; N2O5; SO2 Cr2O3; FeO3; Fe2O3; FeO CO2; SiO2; SO3; CO P2O5; CrO3; SeO3; Mn2O7 CrO3, PbO, TeO2, MnO3 87.УКАЖИТЕ ГРУППУ ОКСИДОВ, ВЗАИМОДЕЙСТВУЮЩИХ С ВОДОЙ а) P2O5, CaO б) P2O5, SiO2 в) NO, CO2 г) Li2O, CO д) SO3, CuO 88.УКАЖИТЕ ГРУППУ ОКСИДОВ, ВЗАИМОДЕЙСТВУЮЩИХ С РАСТВОРОМ NaOH а) Al2O3, CrO б) CO, P2O5 в) FeO, SO2 г) ZnO, P2O5 д) Cr2O3, NiO 33 89.РАСТВОРЕНИЕМ В ВОДЕ СООТВЕТСТВУЮЩЕГО ОКСИДА МОЖНО ПОЛУЧИТЬ: а) NH4OH б) Al(OH)3 в) Ba(OH)2 г) Fe(OH)2 д) Be(OH)2 90.КАК ОТРИЦАТЕЛЬНУЮ, ТАК И ПОЛОЖИТЕЛЬНУЮ СТЕПЕНЬ ОКИСЛЕНИЯ ИМЕЕТ: а) йод б) хром в) фтор г) неон д) алюминий 91.АЗОТСОДЕРЖАЩЕЕ СОЕДИНЕНИЕ, ОБРАЗУЮЩЕЕСЯ В РЕЗУЛЬТАТЕ РЕАКЦИИ: KMnO4 + KNO2 +H2SO4 MnSO4 + K2SO4 + … + H2O: а) HNO2 б) KNO3 в) NH4NO3 г) NO д) N2 92.ВЫ НЕ СОГЛАСНЫ С УТВЕРЖДЕНИЕМ : АЗОТНАЯ КИСЛОТА, КАК СИЛЬНАЯ КИСЛОТА а) при взаимодействии с металлами образует нитраты б) хорошо диссоциирует на ионы Н+ и NO3– в) взаимодействует с активными металлами с образованием водорода г) является очень сильным окислителем д) в смеси с соляной кислотой образует «царскую водку» 93.ДОПИШИТЕ НЕДОСТАЮЩИЙ ПРОДУКТ РЕАКЦИИ Bi(NO3)3 + Br2 +KOH … + KBr + H2O. а) Bi(OH)2NO3 б) KBiO3 в) Bi2O3 г) Bi(OH)3 34 д) Bi 94.ВСТАВЬТЕ В УРАВНЕНИЕ РЕАКЦИИ НЕДОСТАЮЩИЙ ПРОДУКТ As2O3 + Zn + H2SO4 … + ZnSO4 + H2O. а) H3AsO3 б) H3AsO4 в) AsH3 г) HAsO3 д) As 95.В РЕАКЦИИ NH3 + H2PO4– NH4+ + HPO42– ДИГИДРОФОСФАТ-ИОН ВЕДЕТ СЕБЯ КАК а) акцептор протонов б) донор протонов в) окислитель г) восстановитель д) основание Льюиса 96.СОЕДИНЕНИЕ СВИНЦА, УЧАСТВОВАВШЕЕ В РЕАКЦИИ: ____ + MnSO4 + H2SO4 PbSO4 + HMnO4 + H2O? а) PbO; б) PbO2 в) Pb(OH)2 г) Pb д) PbS 97.ВЕЩЕСТВА, ОБРАЗУЮЩИЕСЯ В РЕАКЦИИ: Al2(SO4)3 + K2CO3 + H2O ___ а) [Al(OH)2]2SO4 + H2CO3 б) Al2(CO3)3 + K2SO4 в) AlOHSO4 + KHCO3 г) Al(OH)3 + K2SO4 д) Al(OH)3+ CO2+ K2SO4 98.d- И p-ЭЛЕМЕНТЫ ОДНОЙ ГРУППЫ РАЗЛИЧАЮТСЯ МЕЖДУ СОБОЙ: а) высшей положительной степенью окисления б) числом наружных электронов в) числом валентных электронов 35 г) формулой высшего оксида д) формулой высшего гидроксида 99.ПРОЦЕСС ВОССТАНОВЛЕНИЯ ХРОМА ПРОИСХОДИТ В СЛУЧАЕ: а) хромат-ион гидроксид хрома(III) б) дихромат ион хромат-ион в) хромат-ион дихромат ион г) хром (III)-ион дихромат ион д) гидроксид хрома (II) гидроксид хрома (III) 100.ВЫ НЕ СОГЛАСНЫ СО СЛЕДУЮЩИМ УТВЕРЖДЕНИЕМ ОТНОСИТЕЛЬНО ЭЛЕМЕНТОВ ПОДГРУППЫ ЦИНКА: а) простые вещества являются восстановителями б) высшая степень окисления +2 в) отрицательных степеней не образуют г) оксиды этих элементов обладают основными свойствами д) не все металлы подгруппы цинка растворяются в соляной кислоте 101.В РЕАКЦИИ As2O3 + HCl + SnCl2 As + SnCl4 + H2O ХЛОРИД ОЛОВА (II) ЯВЛЯЕТСЯ: а) окислителем б) восстановителем в) и окислителем, и восстановителем г) кислотой д) не проявляет окислительно-восстановительных свойств 102.ИЗ ПРИВЕДЁННЫХ КИСЛОТ НNO3, HClO4, H3PO4, HClO, H2SO4 НАИБОЛЕЕ СИЛЬНОЙ ЯВЛЯЕТСЯ: а) H3PO4 б) НNO3 в) HClO г) HClO4 д) H2SO4 103.ОСНОВАНИЮ [Pb(H2O)2(OH)2] СООТВЕТСТВУЕТ СОПРЯЖЕННАЯ КИСЛОТА: а) Pb (OH)2 б) [Pb(OH)3 H2O]в) [Pb(H2O)4]2+ 36 г) [Pb(OH)4]2д) [Pb(H2O)3OH]+ 104.В ОСНОВЕ КАЧЕСТВЕННЫХ РЕАКЦИЙ НА МЫШЬЯК ЛЕЖИТ ОБРАЗОВАНИЕ АРСИНА, КОТОРЫЙ МОЖЕТ БЫТЬ ПОЛУЧЕН: а) As2S3+ HCl б) As2O3 + HCl в) As2O3 + Zn + H2SO4 г) As + HNO3 д) As2S3 + NaOH 105.ДЛЯ ГИДРОКСИДА АЛЮМИНИЯ ХАРАКТЕРНО: а) амфотерные свойства б) основные свойства в) нерастворимость в воде г) желудке образует гель, нейтрализующий кислоты д) растворимость в воде 1)все 2)а, в, г, 3) а, в 4) а, г, д 5) а, г 106.ДЛЯ ГАЛОГЕНОВ ХАРАКТЕРНО: а. уменьшение окислительной способности от фтора к йоду б. величение окислительной способности от фтора к йоду в. более активный галоген вытесняет менее активный из его соединений с металлами г. галогенид анионы при комплексообразовании выступают в качестве лигандов; д. восстановительные свойства галогенид-анионов уменьшаются от фтора к йоду 1)все 2)а, в, г 3)б, в, г 4)а, в 5)а, в, д 37 107.К ОРГАНОГЕНАМ ОТНОСЯТСЯ: а) С, O, H, S, Mg, Ca б) C, H, P, Na, Mg в) C, O, H, Fe, S, P, N г) C, O, H, N, S, P д) C, O, H, K, Na, Fe 108.К МАКРОЭЛЕМЕНТАМ ОТНОСЯТСЯ: а) Fe, Si, Cu, Zn б) F, Cl, Co, H в) Mg, Na, Cl, Co г) Ca, Mg, C, I д) Na, Cl, N, O 109.К МИКРОЭЛЕМЕНТАМ ОТНОСЯТСЯ: а) Mg, Y, As, Cu б) Cl, Br, I, At в) F, Br, Sr, Na г) Mo, Sr, Co, Cu д) Zn, Mg, Br, Cu 38

