Лабораторная работа № 1 : Тема:
реклама
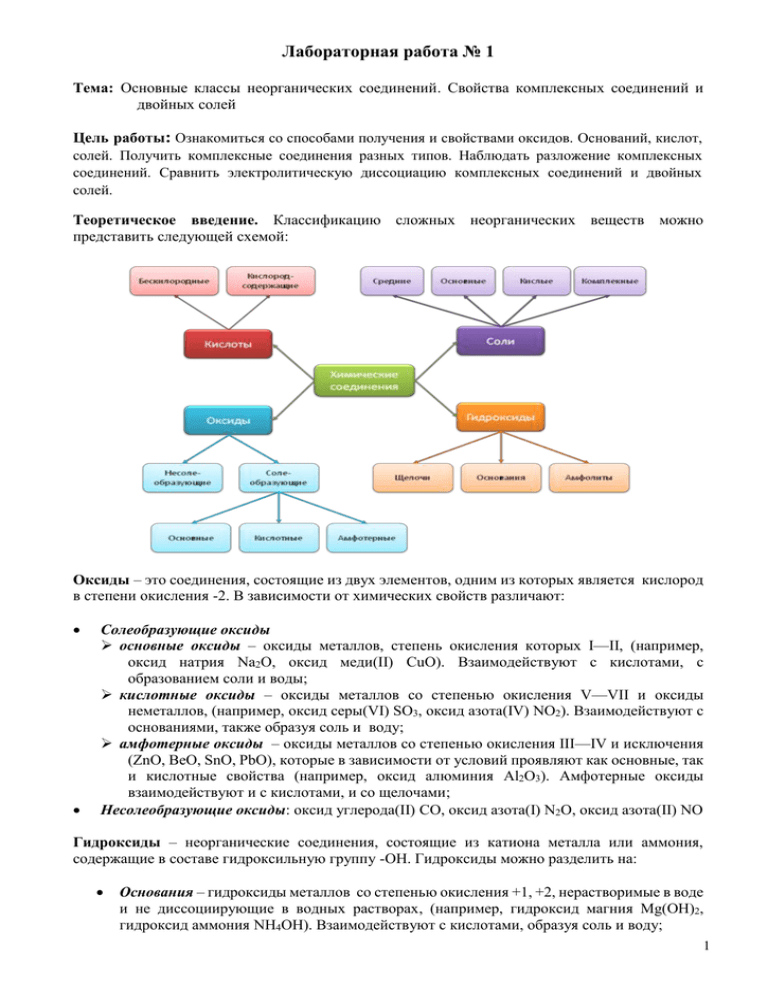
Лабораторная работа № 1 Тема: Основные классы неорганических соединений. Свойства комплексных соединений и двойных солей Цель работы: Ознакомиться со способами получения и свойствами оксидов. Оснований, кислот, солей. Получить комплексные соединения разных типов. Наблюдать разложение комплексных соединений. Сравнить электролитическую диссоциацию комплексных соединений и двойных солей. Теоретическое введение. Классификацию сложных неорганических веществ можно представить следующей схемой: Оксиды – это соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. В зависимости от химических свойств различают: Солеобразующие оксиды основные оксиды – оксиды металлов, степень окисления которых I—II, (например, оксид натрия Na2O, оксид меди(II) CuO). Взаимодействуют с кислотами, с образованием соли и воды; кислотные оксиды – оксиды металлов со степенью окисления V—VII и оксиды неметаллов, (например, оксид серы(VI) SO3, оксид азота(IV) NO2). Взаимодействуют с основаниями, также образуя соль и воду; амфотерные оксиды – оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO), которые в зависимости от условий проявляют как основные, так и кислотные свойства (например, оксид алюминия Al2О3). Амфотерные оксиды взаимодействуют и с кислотами, и со щелочами; Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO Гидроксиды – неорганические соединения, состоящие из катиона металла или аммония, содержащие в составе гидроксильную группу -OH. Гидроксиды можно разделить на: Основания – гидроксиды металлов со степенью окисления +1, +2, нерастворимые в воде и не диссоциирующие в водных растворах, (например, гидроксид магния Mg(ОН)2, гидроксид аммония NH4OH). Взаимодействуют с кислотами, образуя соль и воду; 1 Щелочи – основания, растворимые в воде, диссоциирующие в водных растворах на ионы металлов и гидроксильных групп (ОН-): NaOH ↔ Na+ + OH–, (например гидроксид кальция Ca(ОН)2, гидроксид калия). Взаимодействуют с кислотами, кислотными оксидами, с растворами солей; Амфолиты - это вещества, при диссоциации которых образуются как ионы водорода, так и и гидроксильные ионы: 2H+ + ZnO22- ↔ Zn(OH)2 ↔Zn2+ + 2OH-. В зависимости от условий амфолиты могут проявлять свойства оснований и кислот Кислоты – неорганические соединения, состоящие из протона водорода и кислотного остатка. Кислоты диссоциируют в водных растворах на ионы водорода и кислотного остатка: H2SO4 = 2H+ + SO42-. Кислоты бывают кислородсодержащие (серная кислота H2SO4, азотная кислота HNO3) и бескислородные (хлороводороная кислотв HCl, бромоводородная кислота HBr). Число ионов водорода, способных замещаться на металл, определяет основность кислоты. Взаимодействуют с металлами, основными оксидами, основаниями и солями. Соли – неорганические соединения, состоящие из ионов металла и кислотного остатка. Растворимые соли диссоцируют в водных растворах: KCl = K+ + Cl-, K2SO4 = 2K+ + SO42-. Характерными для солей являются реакции взаимодействия со щелочами, с кислотами, друг с другом и с более активными металлами. В зависимости от состава различают следующие виды солей: Средние – образуются при полном замещении ионов водорода в молекулах кислоты ионами металла (например, сульфат натрия Na2SO4, фосфат натрия Na3PO4); Кислые – образуются при неполном замещении ионов водорода в молекуле кислоты ионами металла (например, гидросульфат натрия NaHSO4). Диссоциация кислых солей происходит согласно уравнению: NaHSO4 = Na+ + HSO4-. Основные – образуются при замещении гидроксильных групп кислотными остатками не полностью (например, оксигидрохлорид магния MgOHCl); Комплексные – соли, в состав которых входит комплексный катион или комплексный анион (например. тетрагидроксоцинкат калия K4[Zn(OH)4]) ГЕНЕТИЧЕСКАЯ СВЯЗЬ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 2 Обеспечение работы: Посуда и принадлежности • Пробирки • Штатив для пробирок • Спиртовка или газовая горелка • Пипетка • Газоотводная трубка • Металлический штатив с лапкой • Предметное стекло • • • • • • • • • • • • • • • • • • • • • • Реактивы (часть 1) Оксид кальция, порошок Оксид железа (III), порошок Оксид меди (II), порошок Раствор метилового оранжевого Раствор лакмуса Соляная кислота, разб Азотная кислота, разб Серная кислота, разб Цинк, гранулы Медь, стружка, проволока Гидроксид кальция, раствор Гидроксид меди (II) Сульфат цинка, раствор Гидроксокарбонат меди (II), порошок Cu2(OH)2CO3 Сульфат меди (II), раствор Железо, опилки Хлорид бария, раствор Карбонат кальция, порошок Гидроксид калия, раствор Гидроксид натрия, раствор Соляная кислота Азотная кислота • • • • • • • • • • • • • • • • • • • • Реактивы (часть 2) Сульфат меди (II) Гидроксид аммония, 8% Гидроксид аммония, 25-27% раствор Спирт этиловый К3[Fe(CN)6], раствор Нитрат серебра, 1% р-р Хлорид натрия ,0.1M Азотная кислота, 2М Хлорид бария, 10% р-р Гидроксид натрия, р-р Роданид аммония, р-р Соль Мора – сульфат аммония-железа (II), кристаллическая Хлорид аммония, р-р Хлорид кобальта, крист Азотнокислый кадмий, р-р Zn, гранулы NaCl, насыщенный р-р NaOH, 2M Al2(SO4)3, р-р ZnSO4, р-р Ход работы Часть 1 Опыт 1. Взаимодействие основных оксидов с водой. Поместить в пробирку немного оксида кальция, добавить в пробирку воду так, чтобы ее объем не превышал 1/3 объема пробирки. Перемешать содержимое пробирки. Добавить к полученному раствору раствор метилоранжа. Повторить опыт, заменив оксид кальция на оксид железа (III), оксид меди (II). Написать уравнения соответствующих реакций в молекулярной форме. Опыт 2. Взаимодействие основных оксидов с кислотами. Поместить в пробирку немного оксида кальция, добавить раствор соляной кислоты так, чтобы ее объем не превышал 1/5 объема пробирки. Перемешать содержимое пробирки. Если оксид кальция не растворяется, слегка подогреть содержимое пробирки, но не кипятить. 3 Повторить эксперимент с соляной кислотой, заменив оксид кальция на оксид железа. Заменив соляную кислоту азотной, провести эксперимент с оксидом кальция и оксидом железа (III). Написать уравнения реакций в молекулярной и ионной формах. Опыт 3. Взаимодействие кислот с металлами. В пробирку поместить гранулу цинка, налить 2-3 мл раствора соляной кислоты. Повторить опыт в другой пробирке, заменив раствор соляной кислоты раствором серной кислоты. В третью пробирку поместить медную проволоку или медные стружки, налить 2-3 мл раствора соляной кислоты. Если признаков реакции нет, попробовать подогреть содержимое пробирки, но не кипятить. В четвертой пробирке провести реакцию между медью и раствором серной кислоты. Написать уравнения соответствующих реакций и объяснить причину в случае, если реакция отсутствует. Опыт 4. Реакция обмена между оксидом меди (II) и серной кислотой. Демонстрационный опыт! Налить в химический стакан около 1-2 мл раствора серной кислоты. Нагреть кислоту (но не кипятить!). Добавить в горячий раствор серной кислоты немного оксида меди (II), перемешать раствор стеклянной палочкой до полного растворения оксида меди (II). Добавлять порциями оксид меди до тех пор, пока очередная порция не перестанет растворяться. Нагрев прекратить. Пипеткой перенести 1-2 капли полученного раствора на предметное стекло, подогреть. Напишите уравнение реакции. Опыт 5. Взаимодействие оснований с кислотами. В одну пробирку с гидроксидом меди (II) (получить сливанием CuSO4 и NaOH), добавить раствор соляной кислоты, в другую - раствор серной кислоты. Что происходит? В третью пробирку налить раствор гидроксида кальция, добавить 2-3 капли раствора лакмуса. В эту же пробирку добавить по каплям раствор соляной кислоты, встряхивая после добавления каждой капли. В четвертую пробирку налить раствор гидроксида кальция, добавить 2-3 капли раствора лакмуса. Приливать по каплям раствор серной кислоты. Написать уравнения соответствующих реакций в молекулярной и ионной форме. Опыт 6. Взаимодействие амфотерных оснований с растворами кислот и оснований. В две пробирки налить по 1 мл раствора сульфата цинка. В каждую из них добавить по каплям раствор гидроксида натрия до тех пор, пока не образуется осадок. В первую пробирку прилить раствор соляной кислоты до полного растворения осадка. Во вторую пробирку прилить раствор гидроксида натрия до полного растворения осадка. Написать уравнения соответствующих реакций в молекулярной и ионной формах. Опыт 7. Разложение дигидроксокарбоната меди (II) - основного карбоната меди. Подобрать к пробирке пробку с газоотводной трубкой. Проверить герметичность собранного прибора. Насыпать в пробирку порошок дигидроксокарбоната меди (II) - не более 1/5 объема пробирки. Закрыть пробкой с газоотводной трубкой. Закрепить собранный прибор в штативе. Прогреть всю пробирку, затем сосредоточить нагревание на дне пробирки. По мере изменения окраски дигидроксокарбоната меди (II) передвигать спиртовку (газовую горелку) к отверстию пробирки. Опустить газоотводную трубку в пробирку с раствором гидроксида кальция. Следить за изменениями, которые происходят с дигидроксокарбонатом меди (II), с раствором гидроксида кальция. Обратить внимание на внутренние стенки пробирки около пробки. Написать уравнение реакции. Опыт 8. Взаимодействие сульфата меди (II) с железом. Взять две пробирки. В каждую из них налить по 4-5мл раствора сульфата меди (II). Одну использовать в качестве «свидетеля». Во вторую пробирку насыпать немного железных опилок. Порошок железа лучше не брать, т.к. от него раствор станет мутным. Перемешать содержимое пробирок до тех пор. Пока не исчезнет синяя окраска раствора. Прикоснуться рукой к нижней части пробирки. Что ощущаете? Отфильтровать раствор и сравнить цвет фильтрата с цветом исходного раствора. Написать уравнение реакции. 4 Опыт 9. Взаимодействие солей с кислотами. Налить в пробирку 1 мл раствора хлорида бария. Прилить к нему несколько капель раствора серной кислоты. Во вторую пробирку аккуратно положить немного карбоната кальция, прилить несколько капель соляной кислоты. Написать уравнения реакций в молекулярной и ионной формах. Опыт 10. Взаимодействие солей со щелочами. В две пробирки налить, по 1 мл раствора сульфата меди (II). В первую пробирку добавить несколько капель раствора гидроксида натрия, а во вторую - столько же капель гидроксида калия. Напишите уравнение реакций. Часть 2 Опыт 1. Аммины (комплексные соединения аммиака, аммиакаты). Получение и свойства . 1.1 В четыре пробирки налить по 1 мл раствора сульфата меди. В одну пробирку по каплям добавить 6-8 капель 8% раствора аммиака (гидроксида аммония), взболтать и затем прибавить еще примерно 15 капель 25-27% раствора аммиака, пока первоначально образовавшийся осадок гидроксида меди (II) не растворится и получится прозрачный, темно-синий, не содержащий осадка раствор амминокомплекса. Написать уравнения реакций, описывающие образование труднорастворимого гидроксида меди(II) и его переход в растворимый амминокомплекс. В другую пробирку добавить 4-6 капли гидроксида натрия, взболтать. Какой осадок образовался? В третью пробирку добавить 4-6 капли раствора хлорида аммония. Образуется ли здесь амминокомплекс меди? В четвертую пробирку поместить одну гранулу цинка (опыт начать одновременно с опытом 1.2) и проследить, образуется ли на поверхности цинка слой меди. Описать, что происходит при добавлении вышеназванных реактивов и взбалтывании (перемешивании) раствора, написать соответствующие уравнения реакций. В амминокомплексе меди координационное число меди равно 4. 1.2. Прозрачный раствор амминокомплекса меди, полученный в предыдущем опыте, поровну разделить по двум пробиркам. В одну пробирку добавить 10 капель 2М раствора гидроксида натрия. Произойдет ли разложение комплекса и образование осадка гидроксида меди (II)? Во вторую пробирку поместить одну гранулу цинка и примерно через 20 минут сравнить результаты опыта с результатами опыта 1.1. Обосновать, почему в одном случае наблюдается образование слоя меди на поверхности цинка, а в другом случае нет. Описать, что происходит при добавлении вышеназванных реактивов и взбалтывании (перемешивании) раствора. Написать соответствующие уравнения реакций. Опыт 2. Ацидокомплексы. Получение. В пробирку налить примерно 0,5 мл 1% раствора нитрата серебра и 0,5 мл раствора хлорида натрия, взболтать и затем добавить примерно 3 мл насыщенного раствора хлорида натрия. Почему растворяется образовавшийся осадок хлорида серебра? Описать уравнением реакции. Координационное число Ag = 2. Опыт 3. Аквакомплексы. Получение и свойства. В одну пробирку налить примерно 0,5 – 1 мл воды, а в другую (NB!! Пробирка должна быть сухой!) столько же этанола. В обе пробирки добавить по несколько кристалликов хлорида кобальта, взболтать и немного подогреть. В этанольный раствор соли кобальта по каплям прибавлять воду до прекращения реакции (изменений). Описать, что происходит при добавлении вышеназванных реактивов и взбалтывании (перемешивании) раствора, написать соответствующие уравнения реакций, зная, что синюю окраску раствору придает 2 комплексный ион CoCl4 ¯А розовую окраску – комплексный ион Co(H2O)62+. Опыт 4. Гидроксокомплексы. Получение и свойства 5 В пробирку налить примерно 0,5 см3 раствора сульфата алюминия и при перемешивании добавлять по каплям 2М раствор гидроксида натрия до прекращения реакции (изменений). Наблюдать за образованием осадка гидроксида алюминия и его последующим растворением в избытке щелочи с образованием гидроксокомплекса. В пробирку налить примерно 0,5 см3 раствора сульфата цинка и, взбалтывая содержимое, по каплям прилить 2М раствор гидроксида натрия до прекращения реакции (изменений). Описать, что происходит при добавлении вышеназванных реактивов и взбалтывании (перемешивании) раствора. Написать соответствующие уравнения реакций. Координационное число цинка и алюминия в гидроксокомплексе равно 4. Опыт 5. Диссоциация двойной соли и комплексного соединения. 5.1. В три пробирки налить по 2 мл раствора соли Мора, приготовив его растворением кристаллической соли Мора в воде непосредственно в пробирке. В одну пробирку добавить несколько капель раствора роданида аммония. Если в растворе присутствуют ионы Fe3+, то по причине образования ионов [Fe(SCN)]2+ раствор покраснеет. Во вторую пробирку добавить несколько капель раствора концентрированного гидроксида натрия и нагреть. Если в растворе есть ионы NH4+, будет чувствоваться запах аммиака. В третью пробирку добавить 0,5 - 1 мл раствора хлорида бария. Если в растворе имеются ионы SO4-2, то образуется труднорастворимый осадок сульфата бария. Были ли в растворе названные ионы? Написать уравнение диссоциации соли и уравнения реакций, подтверждающих наличие данных ионов. 5.2 Налить в две пробирки по 2 мл раствора К3[Fe(CN)6]. В одну пробирку добавить несколько капель раствора роданида аммония. Имеются ли в растворе ионы Fe3+? Во вторую пробирку добавить раствор, содержащий ионы Сd2+. Если образуется осадок Сd3[Fe(CN)6]2, это подтвердит наличие комплексных ионов в растворе. Если бы в растворе были ионы CN-, осадка бы не образовалось, так как Сd(CN)2 растворим. Написать уравнение диссоциации К3[Fe(CN)6]. Опыт 6. Разрушение комплекса. В пробирку внести 4-5 капель раствора нитрата серебра и столько же раствора хлорида натрия. Получившийся осадок хлорида серебра растворить в 25-27% растворе аммиака. К полученному раствору комплексной соли серебра добавить 2М раствор азотной кислоты до образования белого осадка хлорида серебра. Написать уравнения: Взаимодействие хлорида серебра с аммиаком (координационное число Ag равно 2); Электролитической диссоциации комплексной соли серебра и ее комплексного иона; Молекулярное и ионное уравнения взаимодействия аммиака с азотной кислотой; Реакции разрушения аммиачного комплекса серебра под действием азотной кислоты. Самостоятельно 1. Написать уравнения реакций в молекулярной и ионной формах. Mg MgSO4 Mg ( NO3 )2 MgO (CH3COO)2 Mg 2. Сколько литров аммиака (н.у.) потребуется для превращения 5,47 г гидроксида меди (II) в гидроксид тетраамминмеди (II)? 3. Сколько граммов комплексной соли образуется при обработке суспензии, содержащей 177,15 г иодида серебра, избытком раствора цианида калия? 4. Найдите формулы гидроксидов, имеющих следующий состав (в % по массе): a) Mn – 61.8%, O – 36.0 %, H – 2.3% , б) Sn – 77.7%, O – 21.0 %, H – 1.3% , в) Pb – 75.3%, O – 23.2 %, H – 1.5% 6 5. К раствору, содержащему 10,4 г хлорида бария, прибавили 24 грамма 18 % раствора, серной кислоты. Осадок отфильтровали и высушили. Какая масса сухого осадка получилась? Какие вещества будут находиться в растворе? 6. При нагревании 1,36 г технического тригидрата ацетата натрия с избытком разбавленной фосфорной кислоты было получено 0,6 г уксусной кислоты. Какова массовая доля чистого ацетата натрия в этом образце тригидрата ацетата натрия? Студент ................................................................................................. Работа выполнена: ............................................ Преподаватель: ................................. Дата Работа защищена: ................................................................................ Подпись преподавателя, дата:............................................. 7
