Каназырская - БГПУ им.М.Акмуллы
реклама

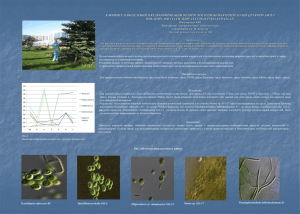
Виорика Юрьевна Каназырская Башкирский государственный педагогический университет им. М.Акмуллы Научный руководитель: Суханова Н.В. К ВОПРОСУ О ВЫДЕЛЕНИИ И КУЛЬТИВИРОВАНИИ ВОДОРОСЛЕЙ И ЦИАНОБАКТЕРИЙ Введение. Водоросли – древнейшие про- и эукариотические фотосинтезирующие организмы, ведущие свободный и симбиотический образ жизни. Распространенные по всему земному шару, в самых разнообразных местообитаниях, они играют огромную роль в жизни природы и человека. Биоразнообразие микроводорослей и цианобактерий огромно. Для решения вопросов изучения биоразнообразия микрофототрофов, их морфологии, физиологии, перспектив использования в биотехнологии, важно создавать и поддерживать коллекцию культур водорослей и цианобактерий. Такая коллекция создана в Лаборатории экологии почвенных водорослей им. Л.Хайбуллиной на кафедре ботаники, биоэкологии и ландшафтного проектирования БГПУ им. М.Акмуллы. Выделение микроводорослей в культуру с помощью традиционных методов является хорошо изученной процедурой. Выбор подходящей среды является важным условием для успешного культивирования водорослей. Часто первым шагом на пути к успешной изоляции водорослей из их природной среды являются комплексные данные об их среде обитания [3]. Например, для прибрежных морских водорослей важными факторами являются температура и соленость воды. Для успешного культивирования необходимы и знания таксономии. Для выращивания диатомовых водорослей необходим кремний, эвгленовых – аммоний, некоторые виды нуждаются в селене. Миксотрофные виды нуждаются в добавление источников питания для бактерий, бесцветные фаготрофы могут требовать эукариотических источников питания. При культивировании нужно учитывать уничтожение загрязнителей, особенно тех, которые могут конкурировать с нужным видом. Среди методов выделения водорослей наиболее распространенными являются изоляция с помощью разведения, изоляция отдельных клеток с помощью микропипеток, изоляция при помощи агара и др. Иногда желаемый вид растет на начальных стадиях изоляции, но потом погибает после нескольких пересевов на свежую среду[1]. Это является показателем того, что питательная среда лишена специфических элементов или органических веществ, недостаток которых сразу не проявляется. К сожалению, исследователь узнает об этом слишком поздно, когда оригинальный изолят уже погиб. Организм может подавляться отходами жизнедеятельности, что отравляет его среду обитания, приводя к гибели. В природе эти отходы обычно нейтрализуются другими организмами [1]. Целью нашей работы являлся подбор методов выделения и культивирования водорослей для пополнения коллекции микроводорослей и цианобактерий, а также поддержание ее хорошем состоянии. Решаемые нами задачи: 1) изучение данных литературы об основных методах выделения и культивирования водорослей, 2) проведение сравнительной характеристики питательных сред для культивирования водорослей и цианобактерий. По данным литературы [3,4] составлен перечень используемых для культивирования водорослей и цианобактерий сред, дана их характеристика, приведены группы водорослей, для которых рекомендуется (табл.1). Таблица 1. Питательные среды для культивирования водорослей и цианобактерий Состав среды 1.Среда 3NNB Макроэлементы: NaNO3 Ca Cl₂×2H2O MgSO4×7H2O K₂HPO₄ KH₂PO₄ Содержание солей, г/л воды Водоросли, для рекомендуются которых 25 2,5 7,5 7,5 17,5 2,5 Хлорококковые, вольвоксовые, нитчатой зеленой водоросли Klebsormidium flaccidum (Kutzing) S.Mattox et Blackwell[5],желтозеленой водоросли Heterococcus endolithicus Darling et Friedmann [6]. NaCl Щелочной раствор ЭДТА 1мл Кислый раствор железа 1мл Раствор Бора 1мл Раствор микроэлементов 1мл: ZnSO₄× 7H₂O MnCl₂ ×4H₂O MoO₃ CuSO₄×5H₂O Co(NO₃)₂×6H₂O 2. Среда Данилова 250 мл почвенной вытяжки 750 мл воды Ca (NO₃)₂ K₂HPO₄ 3. Среда Бристоль (в модификации Голлербаха) NaNO₃ KH₂PO MgSO₄×7H₂O CaCl₂ NaCl Fe₂Cl₆ 4. Среда Громова KNO3 K₂HPO₄ MgSO₄ ×7H₂O ZnSO₄× 7H₂O MnSO₄×7H₂O CuSO₄×5H₂O Na₃BO₃×4H₂O (NH4)6×Mo7O24×4H2O FeSО4×7H2O CaCl2×2H2O Co (NO₃)2×H2O ЭДТА – 10 Агар-агар – 1,5% 5. Среда Кнопа Ca (NO₃)₂ MgSO₄× 7H₂O KH₂PO₄ KCl Fe2Cl6 – одна капля 1% раствора 8,82 1,44 0,71 1,57 0,49 Все группы водорослей почвенных Все группы водорослей почвенных Универсальная применяемая разведениях среда, разных 0,2 0,2 0,25 0,25 0,15 0,05 0,05 следы (3 капли 1%-го р-ра) 100 66,7 33,3 0,022 1,81 0,079 2,63 1 9,3 1,2 0,02 в Для зеленых водорослей 0,25 0,06 0,06 0,08 6. Среда Прата KNO₃ K₂HPO₄ MgSO₄×7H₂O FeCl₃×6H₂O Агар-агар – 1,2% 0,10 0,01 0,01 0,001 Для хранения культур коллекции Универсальная среда 7. Z-8 Medium NaNO₃ Ca(NO₃)₂ K₂HPO₄ MgSO₄×7H₂O Na₂CO₃ Fe-EDTA(1 мл) Trace Element Solution(1мл) 46,7 5,9 3,1 2,5 2,1 Все питательные среды для культивирования водорослей можно разделить на три группы: синтетические, обогащенные и почвенные вытяжки. Синтетические (искусственные) среды были созданы прежде всего для того, чтобы обеспечить культивирование водорослей как для экспериментальных исследований, так и для поддержания жизнеспособности штаммов. К ним относят среды Болда, Кнопа, Прата, Бристоль, Данилова. Эти среды могут быть как жидкими, так и агаризованными. Обогащенные среды готовятся путем добавления питательных веществ к естественной озерной или проточной воде или обогащением синтетической среды раствором почвенной вытяжки, растительных экстрактов (например, торфяного мха), экстракта дрожжей и т.д. [1]. Водоросли, растущие на почвенной вытяжке, обычно имеют нормальную морфологию, и эти культуры можно поддерживать длительное время [2]. Материалы и методы. Для сравнительного анализа питательных сред нами были выбраны: среда 3NNB, среда Данилова, среда Бристоль, среда Громова, среда Кнопа, среда Прата, среда Z-8. Для эксперимента были отобраны из коллекции штаммы следующих видов: 1)Scotiellopsis rubescens S8, 2)Interfilum terricola S11-2, 3)Elliptochloris cf. subsphaerica S11-11, 4)Nostoc sp. S11-17, 5)Pseudophormidium hollerbachianum S1. Эти виды были выделены из микробиотичеких корочек, степной зоны РБ, в окрестностях г.Сибай. Каждую культуру выращивали в 50 мл анализируемой среды (состав приведен в табл. 1) в течение одного месяца на люминостате при температуре +240С. Колбы с культурами ежедневно встряхивали. Плотность культуры оценивали путем измерения оптической плотности на спектрофотометре ПЭ-5400УФ. Для каждой среды была вычислена длина волны, проводились в кюветах в 5 мл. Данные были внесены в таблицу 2. Результаты. Для каждой среды изначально была вычислена необходимая длина волны. Для среды Z-8 она составляла 315нм, для среды 3NNB и Бристоль – 750нм, для сред Прата, Кнопа, Громова и Данилова составляла 590нм. Далее была измерена оптическая плотность при данной для этой среды длине волны для каждого вида, культивируемой водоросли. Результаты исследования показали наибольшие значения оптической плотности для штамма Nostoc sp. S11-17 при культивировании на среде Данилова и Громова; для штамма Scotiellopsis rubescens S8 - на среде 3NNB и Бристоль, для штамма Pseudophormidium hollerbachianum S1 - на среде Кнопа, Interfilum terricola S11-2 - на среде Бристоль, Elliptochloris cf.subsphaerica S11-11 - на среде Кнопа. В среднем самое высокое значение плотности культур для всех видов водорослей было установлено при выращивании их на среде Бристоль. Таблица №2. Значения оптической плотности культур водорослей Питательная среда Z-8 3NNB Бристоль Прата Кнопа Громова Данилова Водоросли и цианобактерии Nostoc sp. Scotiellopsis S11-17 rubescens S8 Pseudophormidium Interfilum hollerbachianum terricola S1 S11-2 0,092 0,001 0,620 0,060 0,080 1,603 1,684 0,110 0,619 0,659 0,059 1,684 0,062 0,113 0,296 0,751 0,682 0,230 0,240 0,371 0,220 0,060 0,593 0,641 0,204 0,094 0,090 0,147 Elliptochloris cf. subsphaerica S11-11 0,231 1,002 0,687 0,420 1,845 0,069 0,399 Заключение. Довольно широкий разброс значений оптической плотности, скорее всего, связан с индивидуальными особенностями каждого штамма водорослей и цианобактерий. Подбор среды для культивирования водорослей необходимо проводить с учетом физиологических и биохимических особенностей каждого вида или отдела. СПИСОК ЛИТЕРАТУРЫ 1) Andersen R.A., Kawachi M. Traditional microalgae isolation techniques / Andersen R.A. Algal culturing techniques. Elsevier Academic Press, 2005. P. 82-100. 2) Watanabe M.M. Freshwater culture media / Andersen R.A. Algal culturing techniques. Elsevier Academic Press, 2005. P. 13-20. 3) Гайсина Л.А., Фазлутдинова А.И., Кабиров Р.Р. Современные методы выделения и культивирования водорослей: учебное пособие [Текст]. – Уфа: Изд-во БГПУ, 2008. – 152с. 4)Ф.Х. Хазиев, Р.Р.Кабиров Количественные методы почвенно- альгологических исследований.- Уфа: БФАН СССР, 1986.172с. 5) Floyd G. L., Stewart K. D., Mattox K. R. Cellular organization, mitosis, and cytokinesis in the ulotrichalean alga, Klebsormidium // J. Phycol. 1972. Vol. 8. P. 176-184 6) Darling R. B., Friedmann E. I., Broady P. A. Heterococcus endolithicus (Xanthophyceae) and other terrestrial Heterococcus species from Antarctica: Morphological changes during life history and response to temperature // J. Phycol. 1987. Vol. 23. P. 598-607.