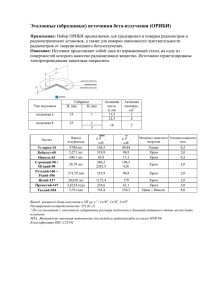
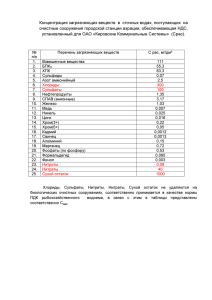
****** * **** ** ************ * ********* ********* ******** ******* H2CrO4,
реклама

Хроматы – соли не существующей в свободном состоянии хромовой кислоты H2CrO4, получаемой лишь в виде водных растворов с концентрацией не выше 75% количества разбавленной серной кислоты ионы CrO42- превращаются в дихроматные ионы Cr2O72-, отщепляя воду, и приобретают оранжевый цвет: 2CrO42- + 2 H3O+ Cr2O72- + 3H2O • В отличие от хроматов, почти все солидихроматы хорошо растворимы в воде. Дихроматы – сильные окислители. В кислой среде для них характерна полуреакция: • Cr2O72- + 14H+ + 6 е- = 2Cr3+ + 7H2O, • где каждый атом хрома(+VI) в анионе принимает по три электрона и превращается в катион Cr3+, тотчас же присоединяющий к себе молекулы воды, переходя в гексааквакатион. Раствор при этом становится зеленым. • Особые свойства у дихромата аммония: он легко разлагается. При слабом нагревании дихромат аммония (NH4)2Cr2O7 самовоспламеняется с выбрасыванием искр (этот опыт называют химическим вулканом) – раскаленных частичек оксида хрома(III) Cr2O3, газообразного азота N2 и паров воды. • Хромат калия K2CrO4 плавится без разложения при 968° С, а дихромат калия K2Cr2O7 разлагается в соответствии с уравнением реакции: • 4K2Cr2O7 = 4K2CrO4 + 2 Cr2O3 + 3O2 • Хромат калия K2CrO4 – кристаллы желтого цвета, при нагревании краснеют. • Дихромат калия K2Cr2O7 – оранжевокрасные кристаллы • Техническое название дихромата калия K2Cr2O7 - хромпик. Широко используется как окислитель в спичечной промышленности, пиротехнике и как реагент в хроматометрии. • Смесь равных объемов насыщенного на холоде раствора K2Cr2O7 и концентрированной серной кислоты (хромовая смесь) обладает очень сильным окислительным действием и применяется в лабораториях для мытья химической посуды. • Хроматы встречаются в природе, в первую очередь это, например, минерал крокоит PbCrO4. Именно этот минерал, привезенный во Францию с Урала («сибирский красный свинец»), послужил в 1797 сырьем для получения оксида хрома, из которого Никола Воклен впервые выделил новый элемент – хром. • Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности. Хром пассивируется разбавленной и концентрированной азотной кислотой, царской водкой, и даже при кипячении металла с этими реагентами растворяется лишь незначительно. Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида: • Cr + 2HCl = CrCl2 + H2 • Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется. • При нагревании металлический хром соединяется с галогенами, серой, кремнием, бором, углеродом и некоторыми другими элементами: • Cr + 2F2 = CrF4 (с примесью CrF5) • 2Cr + 3Cl2 = 2CrCl3 • 2Cr + 3S = Cr2S3 • Cr + C = смесь Cr23C6 + Cr7C3.