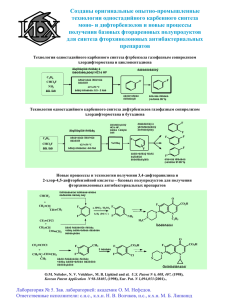
Вторичная структура белка
реклама
вторичная первичная Структура белков третичная четвертичная Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Пептидная связь образуется за счет -карбоксильной группы одной аминокислоты и -аминной группы другой. Полипептидная цепь скрученная в спираль, удерживающуюся посредством образования водородных связей между остатками карбоксильной и аминной групп разных аминокислот H N CH C H R1 O N O CH R2 C H N CH C H R3 O N O CH R4 C N CH C H R5 O • Фрагменты пространственной структуры биополимера, имеющие периодическое строение полимерного остова, рассматривают как элементы вторичной структуры. • Если на протяжении некоторого участка цепи однотипные углы, приблизительно одинаковы, то структура полипептидной цепи приобретает периодический характер. Существует два класса таких структур – спиральные и растянутые (плоские или складчатые). • Спиральной считается структура, у которой все однотипные атомы лежат на одной винтовой линии. При этом спираль считается правой, если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, и левой – если удаляется против часовой стрелки. Полипептидная цепь имеет спиральную конформацию, если все атомы C находятся на одной винтовой линии, все карбонильные атомы Ck - на другой, все атомы N – на третьей, причем шаг спирали для всех трех групп атомов должен быть одинаков. Одинаковым должно быть и число атомов, приходящихся на один виток спирали, независимо от того, идет ли речь об атомах Ck, C или N. Расстояние же до общей винтовой линии для каждого из этих трех типов атомов свое. • • • • • Главными элементами вторичной структуры белков являются -спирали и -складки. Спиральные структуры белка. Для полипептидных цепей известно несколько различных типов спиралей. Среди них наиболее распространена правая -спираль. Идеальная спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6, что означает полную периодичность на пяти витках спирали через каждые 18 аминокислотных остатков. Значения торсионных углов для идеальной -спирали = – 57 = – 47 , а расстояния от атомов, образующих полипептидную цепь, до оси спирали составляет для N 0,15 нм, для C 0,23 нм, для C k 0,17 нм. Любая конформация существует при условии, что имеются факторы, стабилизирующие ее. В случае -спирали такими факторами являются водородные связи, образуемые каждым карбонильным атомом (i+4)-го фрагмента. Важным фактором стабилизации -спирали также является параллельная ориентация дипольных моментов пептидных связей. Складчатые структуры белка. Одним из распространенных примеров складчатой периодической структуры белка являются т.н. -складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом. -складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга. Структура, образующаяся в результате таких взаимодействий, представляет собой гофрированную структуру. Это сказывается на значениях торсионных углов и . Если в плоской, полностью растянутой структуре они должны были бы составить 180, то в реальных -слоях они имеют значения = – 119 и = + 113. Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической. Спираль, в свою очередь, свернута в форме глобулы и шара. Эта структура стабилизируется водородными, ионными, ковалентными, дисульфидными связями и гидрофобными взаимодействиями. Каждому белку свойственна в определенной среде своя особая пространственная структура. Полипептидная связь CH2 Функциональные группы в боковых радикалах O H Tyr NH (CH2)4 H Lys O CH2 C O OH Водородная связь Asp C NH Пептидные цепи CH2 COO- +NH 2 C NH (CH2)3 CH2 SH HS [O] CH2 CH2 S [H] NH2 Ионная связь CH2 Дисульфидная связь Arg Asp S CH2 SH HS Пептидные цепи CH2 [O] [H] CH2 S S CH2 В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков: • Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара или не слишком вытянутого эллипсоида глобулы. Как правило, значительная часть полипептидной цепи таких белков формирует -спирали и -складки. Соотношение между ними может быть самым различным. Например, у миоглобина (подробнее о нем на стр.28) имеется 5 спиральных сегментов и нет ни одной -складки. У иммуноглобулинов (подробнее на стр.42), наоборот, основными элементами вторичной структуры являются -складки, а -спирали вообще отсутствуют. В вышеприведенной структуре фосфоглицераткиназы и те и другие типы структур представлены примерно одинаково. В некоторых случаях, как это видно на примере фосфоглицераткиназы, отчетливо просматриваются две или более четко разделенные в пространстве (но тем не менее, конечно, связанные пептидными мостиками) части – домены. Зачастую различные функциональные зоны белка разнесены по разным доменам. • Фибриллярные белки. Эти белки имеют вытянутую нитевидную форму, они выполняют в организме структурную функцию. В первичной структуре они имеют повторяющиеся участки и формируют достаточно однотипную для всей полипептидной цепи вторичную структуру. Так, белок -креатин (основной белковый компонент ногтей, волос, кожи) построен из протяженных -спиралей. Фиброин шелка состоит из периодически повторяющихся фрагментов Gly – Ala – Gly – Ser , образующими складки. Существуют менее распространенные элементы вторичной структуры, пример – полипептидные цепи коллагена, образующие левые спирали с параметрами, резко отличающимися от параметров -спиралей. В коллагеновых волокнах три спиральные полипептидные цепи скручены в единую правую суперспираль: