Fe 2+
реклама
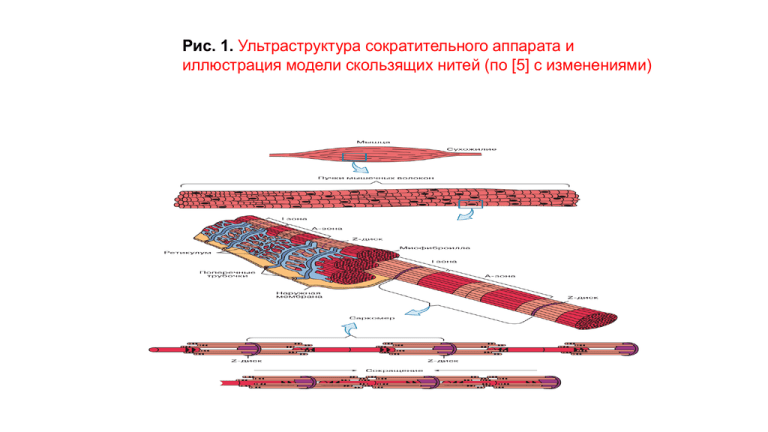
Рис. 1. Ультраструктура сократительного аппарата и иллюстрация модели скользящих нитей (по [5] с изменениями) Рис. 2. Строение актинового филамента (а), влияние актинсвязывающих белков на полимеризацию G-актина и образование структурных элементов цитоскелета (б). Для иллюстрации асимметрии глобулярного актина и полярности нити фибриллярного актина часть шарика актина заштрихована (по [6] с модификациями) Рис. 3. Строение молекулы миозина скелетных мышц (а) и упрощенная схема одной из возможных моделей упаковки миозина в биполярный толстый филамент (б) (по [7] с модификациями) Рис. 4. Строение головки миозина (а) и гипотетический механизм перемещения головки миозина по поверхности актина (б) а – головка миозина ориентирована таким образом, что актинсвязывающий центр (окрашен красным) расположен в правой части. Ясно видна щель (“раскрытая пасть”), разделяющая две половинки (две “челюсти”) актинсвязывающего центра б – схема одиночного шага головки миозина по нити актина. Актин изображен в виде гирлянды шариков. В нижней части головки изображена щель, разделяющая две части актинсвязывающего центра. Аденозин обозначен А, а фосфатные группы – в виде маленьких кружков. Между состояниями 5 и 1 схематически показана переориентация шейки миозина, происходящая при генерации тянущего усилия (по [1] с изменениями и упрощениями) а б . Миозиновый тип регуляции сократительной активности. А – гипотетическая схема механизма регуляции сокращения мышц моллюсков. Изображены одна головка миозина с легкими цепями и нить актина в виде пяти кружков. В состоянии расслабления (а) легкие цепи миозина уменьшают подвижность шарнира, соединяющего головку со стволом миозинового филамента. После связывания Са2+ (б) подвижность шарнира повышается, головка миозина осуществляет колебательные движения и проталкивает актин относительно миозина. Б – схема регуляции сократительной активности гладких мышц позвоночных. СаМ – кальмодулин; КЛЦМ – киназа легких цепей миозина; ФЛЦМ – фосфатаза легких цепей миозина; Р-миозин – фосфорилированный миозин (по [3] с упрощениями и изменениями) Рис. 5 Рис. 6. Структурные основы актинового типа регуляции сокращения мышц а – актиновый филамент с расположенным в канавках спирали непрерывным тяжем молекул тропомиозина; б – взаимное расположение тонких и толстых филаментов в саркомере поперечнополосатых и сердечных мышц. Укрупненное изображение части актинового филамента в состоянии расслабления (в) и сокращения (г). TnC, TnI и TnT соответственно тропонин С, тропонин I и тропонин Т. Буквами N, I и C обозначены соответственно N-концевая, ингибиторная и С-концевая части тропонина I (по [4] с изменениями и упрощениями) Биофизика биомеханики • Упругость–свойство тел менять размеры и форму под действием сил и самопроизвольно восстанавливать их при прекращении внешних воздействий. Упругость тел обусловлена силами взаимодействия его атомов и молекул. При отсутствии внешнего воздействия тело самопроизвольно возвращается в исходное состояние. Вязкость –внутреннее трение среды. Тогда Вязкоупругость –это свойство материалов твердых тел сочетать упругость и вязкость. • Деформация – это относительное изменение длин: ε =Dl/l , где l – начальная длина, Δl –значение удлинения. Напряжение механическое –мера внутренних сил, возникающих при деформации материала. Для однородного стержня: σ = F/S, где S –площадь сечения, F –сила, приложенная к стержню. Упругая деформация возникает и исчезает одновременно с нагрузкой и не сопровождается рассеянием энергии. Для упругой деформации справедлив закон Гука: σу= εЕ, где Е– модуль Юнга, определяемый природой вещества. При растяжении, в общем случае, Е= f(ε). При малых растяжениях считают Е= const. В случае вязкой среды напряжение σв определяется скоростью деформации: σв= η de/dt , где η – коэффициент вязкости среды. Для вязкоупругой деформации характерна явная зависимость от динамики загрузки, причем при удалении нагрузки деформация с течением некоторого времени самопроизвольно стремится к нулю. Биофизика биомеханики Зависимость скорости сокращения от величины нагрузки является важнейшей параметром при изучении работы мышцы, исследуя закономерности мышечного сокращения и его энергетики. Она была подробно изучена при разных режимах сокращения Хиллом. b(P0 − P) V(P) = . P+a Это выражение называется «уравнение Хилла» и является основным уравнением механики мышечного сокращения. Ро–максимальное изометрическое напряжение, развиваемое мышцей, или максимальный груз, удерживаемый мышцей без ее удлинения; b –константа, имеющая размерность скорости, а–константа, имеющая размерность силы. Из уравнения следует, что максимальная скорость развивается при Р = 0: b. Vmax = P0 a .При Р= Ро получаем V = 0, то есть укорочение не происходит. Обратите внимание на то, что работа, производимая мышцей при одиночном укорочении на величину Δl равна А = PΔl. Эта зависимость, очевидно, нелинейная, так как V = f(P), но на ранних фазах сокращения этим можно пренебречь, считая что V = const. Тогда Δl = VΔt, а развиваемая мышцей мощность W = dA/dt имеет вид: W = PV. В результате получаем зависимость мощности от развиваемой силы: W(P) = PV = b(P0 − P) P/ P + a Развитие во времени потенциала действия (А) и изометрического сокращения мышцы, приводящей большой палец кисти (Б). 1 — фаза развития напряжения; 2 — фаза расслабления Одиночные (а) и тетанические (б,в,г,д) сокращения скелетной мышцы. Накладывание волн сокращения друг на друга и образование тетануса при частотах раздражения: 5 -15 раз/с; в — 20 раз/с; г — 25 раз/с; д — более 40 раз в 1 сек (гладкий тетанус). Биофизика зрения Рис. 72. Механизм зрительного родопсина функционирования Рис. 73. Сравнение путей передачи гормонального и зрительного сигнала Биофизика обоняния . Диаграмма строения обонятельного жгутика и два химических механизма усиления сигнала запаха внутри обонятельного волоска I - мембранный интегральный комплекс - рецептор (R) + ГТФ-связывающий белок (G) + аденилатциклаза (АЦ); II - мембранный интегральный комплекс - рецептор (R) + ГТФ-связывающий белок + фосфолипаза С (ФЛС). Туг 278 Рис. 78. Схематическое изображение мембранного транспорта между внутриклеточными вакуолями и плазматической мембраной ЭР - эндоплазматический ретикулум, СГ - секреторная гранула, СВ - секреторная везикула, Л - лизосома, Э1 - периферическая эндосо-ма, Э2 - перинуклеарная эндосома, ОВ - окаймленная везикула, ОЯ окаймленная ямка, РВ - рециклируюшаяся везикула, ФЛ - фаголи-зосома, Ф - фагосома, Г - аппарат Гольджи. Таблица. Некоторые рецепторы, интернализуемые при эндоцитозе Группы рецепторов I. Рецептор возвращается к клеточной по¬верхности, лиганд поступает в лизосомы II. Рецептор и лиганд поступают в лизосомы Ш. Трансцитоз IV. Рецептор и лиганд возвращаются к одному и тому же домену плазматической мембраны Примеры рецепторов Рецепторы маннозы, асиалогликопротеи-на (галактозы), маннозо6-фосфата, у-макроглобулина, ЛНП Рецепторы ФРЭ, инсулиновыйIgA/IgM-рецептор, IgG-рецептор Трансферриновый рецептор Кинетика реакций цепного окисления липидов Свободные радикалы— частицы (как правило, неустойчивые), содержащие один или несколько неспаренных электронов на внешней электронной оболочке. • Радикал может образоваться в результате потери одного электрона нерадикальной молекулой: D→ e- + D+· • или при получении одного электрона нерадикальной молекулой: A + e- → A¯ • Радикалом может быть электронейтральная молекула: НО·, Cl · • органические радикалы: Разветвленная цепная реакция перекисного окисления липидов Продолжение цепи OO LH HO L Инициирование цепи OO LH LOO L LOOH HOH Fe 2+ àÌˈË˾ӂ‡ÌË ˆÂÔË Разветвление цепи LOO Fe3+ LO LH LOH OO L LOO Новая цепь Реакции обрыва цепей L• + L •. LL L• + LOO• LOOL LOO • + LOO• L=O + LOH + фотон (4) (5) (6) Реакции разветвления цепей Fe2+ + LOOH LO• + Fe3+ LO• + LH LOH + L• L• + O2 LOO• Кислород-независимые Кислород-зависимая (p) (p1) (3) Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 1) LH + HO· L· + HOH (k1) 2) O2 + L· LOO· (k2) Продолжение 3) LH + LOO· L· + LOOH (k3) 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp) 5) LH + LO· LOH + L· (k5) Разветвление 6) LOO· + LOO· продукты + свет (k6) 7) InH + L· LH + In· (k7) Обрыв 8) In· + L· продукты (k8) 9) Fe2+ + L· + H+ Fe3+ + LH (k9) Скорости парциальных реакций цепного окисления по закону действия масс Реакции 0) Fe2+ + O2 1) LH + HO· 2) L· + O2 3) LH + LOO· 4) Fe2+ +LOOH 5) LH + LO· 6) LOO· + LOO· 7) InH + L· 8) In· + L· 9) Fe2+ + L· Скорости v0 = k1 [Fe2+][O2] v1 = k1 [LH][HO·] v2 = k2 [O2]L·] v3 = k3 [LH][LOO·] vp = kp [Fe2+][LOOH] v5 = k5 [LH][LO·] v6 = k6 [LOO·]2 v7 = k7 [InH][L·] v8 = k8 [In·][L·] v9 = k9 [Fe2+ ][L·] Упрощение схемы химических Для упрощения системы химических реакций реакций используют два правила химической кинетики: Правило 1: Скорость нескольких последовательных реакций равна скорости самой медленной из них Правило 2: Скорость нескольких параллельных реакций в наибольшей мере определяется скоростью самой быстрой из них. Иногда можно пренебречь остальными реакциями при расчетах. Скорость нескольких последовательных реакций равна скорости самой медленной из них. Пример 1: Вместо двух реакций продолжения цепи: 2) O2 + L· LOO· v2 = k2 [O2]L·] 3) LH + LOO· L· + LOOH v3 = k3 [LH][LOO·] Пишем одну: L· + O2 (+ LH) LOOH + LOO· v2+3 = v2 [O2][L·] Пример 2: Вместо двух реакций разветвления цепи: 4) Fe2+ + LOOH Fe3+ + LO· + OH¯ v4 = k4 [Fe2+] LOOH] 5) LO· + LH LOH + L· v5 = k5 [LO·][LH] Пишем одну: Fe2+ + LOOH (+ LH) Fe3+ + L· v4+5 = k4 [Fe2+] LOOH] Примечание: На кинетику процесса в целом не влияют те продукты, которые не участвуют в дальнейших реакциях. Поэтому на схеме реакций мы можем их не указывать. Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 1) LH + HO· L· + HOH (k1) 2) O2 + L· LOO· (k2) Продолжение 3) LH + LOO· L· + LOOH (k3) 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp) 5) LH + LO· LOH + L· (k5) Разветвление 6) LOO· + LOO· продукты + свет (k6) 7) InH + L· LH + In· (k7) Обрыв 8) In· + L· продукты (k8) 9) Fe2+ + L· + H+ Fe3+ + LH (k9) Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 2) O2 + L· LOO· 3) LH + LOO· L· + LOOH 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· 5) LH + LO· LOH + L· 6) LOO· + LOO· продукты + свет 7) InH + L· LH + In· 8) In· + L· продукты 9) Fe2+ + L· + H+ Fe3+ + LH (k2) (k3) (kp) (k5) (k6) (k7) (k8) (k9) Продолжение Разветвление Обрыв Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 2) O2 + L· LOO· (k2) 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· 5) LH + LO· LOH + L· 6) LOO· + LOO· продукты + свет 7) InH + L· LH + In· 8) In· + L· продукты 9) Fe2+ + L· + H+ Fe3+ + LH (kp) (k5) (k6) (k7) (k8) (k9) Продолжение Разветвление Обрыв Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 2) O2 + L· LOO· (k2) 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp) Продолжение Разветвление 6) LOO· + LOO· продукты + свет 7) InH + L· LH + In· 8) In· + L· продукты 9) Fe2+ + L· + H+ Fe3+ + LH (k6) (k7) (k8) (k9) Обрыв Уравнения реакций цепного окисления липидов Реакция: Константа скорости 0) Fe2+ + O2 … Fe3+ + rHO· (k0) Зарождение 2) O2 + L· LOO· (k2) 4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp) Продолжение Разветвление 6) LOO· + LOO· продукты + свет 9) Fe2+ + L· + H+ Fe3+ + LH (k6) (k9) Обрыв Очень упрощенная схема ПОЛ из 5 реакций Fe2+ + O2 … Fe3+ + rL· Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· L· + O2 (+ LH) LOOH + L· Fe2+ + L· + H+ Fe3+ + LH LOO· + LOO· L=O + LOH + фотон (k0) (kp) (k2) (k9) (k6) Аналитическое решение уравнений кинетики ПОЛ Дальнейшее упрощение системы реакций Fe2+ + O2 … Fe3+ + rL· Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· L· + O2 (+ LH) LOOH + L· Fe2+ + L· + H+ Fe3+ + LH LOO· + LOO· L=O + LOH + фотон (k0) (kp) (k2) (k9) (k6) Скорость нескольких параллельных реакций в основном определяется самой быстрой из них. Пример 1: Скорость образования радикалов L· определяется двумя параллельно идущими реакциями: 1) LH + HO· L· + HOH v1 = k1 [LH][HO·] 4) Fe2+ + LOOH Fe3+ + LO· + OH¯ v4 = k4 [Fe2+] LOOH] При наличии Fe2+ скорость последней реакции гораздо выше, чем первой (т.к. концентрация HO· обычно бывает очень низкой). Поэтому основная масса радикалов образуется в реакции обрыва цепей: Fe2+ + LOOH Fe3+ + LO· + OH¯ v1+4 k4 [Fe2+] LOOH] Пример 2: Скорость реакции обрыва цепей определяется двумя параллельно идущими реакциями: Fe2+ + L· + H+ Fe3+ + LH (k9) LOO· + LOO· L=O + LOH + фотон (k6) При наличии Fe2+ скорость первой реакции гораздо выше, чем второй. Поэтому пока есть Fe2+, основная реакция обрыва цепи – это реакция: Fe2+ + L· + H+ Fe3+ + LH (k9) Дальнейшее упрощение системы реакций Fe2+ + O2 … Fe3+ + rL· Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· L· + O2 (+ LH) LOOH + L· Fe2+ + L· + H+ Fe3+ + LH LOO· + LOO· L=O + LOH + фотон (k0) (kp) (k2) (k9) (k6) Система 3-х реакций: Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· (kp) L· + O2 (+ LH) LOOH + L· (k2) Fe2+ + L· + H+ Fe3+ + LH (k9) Дифференциальные уравнения кинеткики в системе трех реакций d[LOOH] v 2 - v p k2 O2 L k p Fe2+ LOOH dt d[L ] v p v 9 k p Fe2+ LOOH k9 Fe2+ L dt d[Fe2 ] v p v 9 k p Fe2+ LOOH k9 Fe2+ L dt Стационарное приближение Боденштейна – Семенова d[L ] 0 dt 2+ 2+ k p Fe LOOH k9 Fe L L LOOH kp k9 d[LOOH] 2+ k2 O2 L k p Fe LOOH dt k2 d[LOOH] 2+ O2 Fe k p LOOH dt k9 d[LOOH] LOOH dt k2 2+ k p O2 Fe k9 Тригерная функция Fe2+ 1 d[LOOH] LOOH dt LOOH 3 LOOH0 t d[LOOH] dt LOOH 0 2 d[LOOH] dt LOOH LOOH 4 ln LOOH 0 LOOH 5 e t LOOH0 LOOH L v ПОЛ 6 LOOH L v ПОЛ-0 0 0 e t t Тригерная функция Fe2+ LOOH L 1 LOOH L 0 0 2 v ПОЛ e t v ПОЛ-0 k2 2+ k p O2 Fe k9 3 При = 0 k2 Fe O2 Fe2+ крит k9 2+ = kp([Fe2+]* – [Fe2+]) 4 5 При [Fe2+] > [Fe2+] *, < 0 6 При [Fe2+] < [Fe2+] *, > 0 Скорость цепного окисления Железо как про- и антиоксидант [Fe2+] < [Fe2+] * >0 [Fe2+] > [Fe2+] * <0 Алгоритм рассчета кривых кинетики реакции на ЭВМ Стадия 1. Составляем минимальную систему уравнений химических реакций Fe2+ + O2 … Fe3+ + rHO· Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· L· + O2 (+ LH) LOOH + L· Fe2+ + L· + H+ Fe3+ + LH LOO· + LOO· L=O + LOH + фотон (k0) (kp) (k2) (k9) (k6) Стадия 2. Находим начальные скорости частных реакций (v0)0 = k0 [Fe2+]0[O2] (vp)0 = kp [Fe2+]0[LOOH] (v2)0 = k2 [L·]0[O2] (v9)0 = k9 [Fe2+]0[L·] (v6)0 = k6 [LOO·]02 Стадия 3. Находим начальные скорости изменения концентраций реагентов: d[LOOH] v2 - v p dt d[L ] v p v0 v9 dt 2 d[Fe ] v 0 v p v 9 dt [LOOH] [L·] [Fe2+] Концентрации и скорости реакций относятся к нулевому времени! Стадия 4. Находим изменение концентрации за время Dt. Для малых приращений считаем Dt = dt и рассчитываем приращение концентраций за время Dt как произведение скоростей реакций на Dt Например, для гидропероксида: D[LOOH] = (v2 – vp ) ·Dt Для других компонентов: D[L·] = (rv0 + vp– v9 ) ·Dt D[Fe2+] = (– v0 – vp – v9 ) ·Dt Dt [LOOH] [L·] [Fe2+] Стадия 5 Находим концентрацию в момент времени t1 = 0 + Dt. [Fe2+]0 Для гидропероксида: [Fe2+] 1 [LOOH]1 = [LOOH]0 + D[LOOH] [LOOH]1 Для других компонентов: [LOOH]0 [L·]1 = [L·]0 + D[L·] [L·]1 [Fe2+]1 = [Fe2+]0 + D[Fe2+] Dt Многократно повторяем процедуры 2-5 Стадия 3 Стадия 2 v2 vLOOH Стадия 5 vLOOH [Fe2+]0 vL· [Fe2+]1 [Fe2+]2 vFe2+ vp [Fe2+] Dt [Fe2+]3 [LOOH]0 Стадия 4 D[LOOH] D[L·] D[Fe2+] [L·]0 Dt t2 t3 Антиоксиданты Антиоксидантная система водной фазы НОН О2 Доноры электронов е- ОО-* О2 ОО-* Fe3+ Каталаза Супероксиддисмутаза Fe2+ Хелаторы НООН Fe3+ НО* Инициация ПОЛ Антиоксиданты могут предотвращать цепное окисление липидов, реагируя с водорастворимыми радикалами или их предшественниками; мы назовем их антиоксидантами водной фазы (АВФ). Супероксиддисмутаза, каталаза и хелаторы ионов железа, а также карнозин относятся к классу АВФ. Супероксиддисмутаза Супероксиддисмутаза(СОД) - единственный известный в настоящее время фермент, субстратом которого являются свободные радикалы. Она катализирует следующую реакцию: O2*- + 2H+ O2 + H2O2 Фермент, обнаруженный МакКордом и Фридовичем имеет молекулярную массу 32 кД и состоит из двух субъединиц, каждая из которых содержит по одному атому Сu и одному атому Zn: Сu2+ Сu2+ Zn2+ Zn2+ Дисмутация О2*- супероксиддисмутазой Реакция катализируемая СОД состоит из двух стадий и заключается в переносе электрона с одного супероксидного радикала на другой. Промежуточным акцептором этого электрона служит атом меди, входящий в активный центр СОД: 1. СОД-Сu2+ + O2*- 2. СОД-Сu+ + O2 + 2H+ СОД-Сu+ + O2 СОД-Сu2+ + Н2О2 Zn2+ не учавствует в каталитическом цикле, хотя и входит в активный центр. Ионы металлов защищают молекулу СОД от воздействий различных протеаз. Деактивация перекиси водорода Перекись водорода (Н2О2) - основной источник самых токсичных радикалов в живых системах - НО* радикалов. Следовательно, снижение уровня Н2О2 приведет к снижению концентрации НО* радикалов. Удаление Н2О2 осуществляют два класса ферментов: каталаза 2Н2О2 каталаза пероксидазы Н2О2 + АН2 2Н2О + О2 пероксидаза 2Н2О + А Акцепторы радикалов В качестве системы защиты организма от повреждающего действия радикалов кислорода могут выступать низкомолекулярные вещества, имеющие высокую константу скорости взаимодействия с этими радикалами: •Аскорбиновая кислота (витамин С) •Сульфгидрильные соединения (глутатион, цистеин) •Одно- и многоатомные спирты (этанол, рибоза, глюкоза) •Мочевая кислота •a -токоферол Хелаторы ионов металлов Основной механизм образования НО* радикалов - это восстановление Н2О2 ионами Fe2+. Поэтому связывание железа комплексообразователями должно привести к снижению концентрации этих радикалов. Среди таких соединений наиболее известны: •ЭДТА (этилендиаминтетрауксусная кислота) •Десферал •Карнозин Воздействия физических полей Anthropogenic pollution Energy Cumulative Material Noncumulative Heat EMF Radiation Noise, vibration Light, LASER Biological Спектр электромагнитных волн Ионизирую щее облучение Неионизиру ющее облучение Gamma Rays частота 1021 X-Rays 1020 UV-Rays 1017 Visible Light 1015 Infrared Rays 1014 Microwaves 1012 Radiowaves 109 101 Дозы ионизирующего излучения Понятие «ДОЗЫ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ» является одним из основных понятий в радиационных исследованиях, включая радиационную биологию, радиационную экологию, радиационную гигиену, радиационную медицину, радиационный контроль и т.д. Без использования понятия «дозы ионизирующего излучения» невозможно количественное описание каких-либо биологических эффектов ионизирующего излучения. Эффективная доза Экспозиционная доза ЭКСПОЗИЦИОННАЯ ДОЗА (X) ионизирующего излучения — количественная характеристика поля γ- и рентгеновского излучений, основанная на их ионизирующем действии в воздухе. Представляет собой отношение суммарного заряда ионов одного знака dQ, образующихся под действием электромагнитного ионизирующего излучения в элементарном объеме воздуха*, к массе воздуха dm в этом объеме: Экспозиционная доза (рус.) – давлении 760 мм рт.ст.). Exposure (англ.) Единицы экспозиционной дозы Единица в системе СИ кулон/кг (Кл/кг) coulomb/kg (C/kg) (т.е. в 0,001293 г воздуха при 0˚С и Внесистемная единица За 1 Р принимают такое рентген (Р) количество roentgen (R) γ- или рентгеновского излучения, которое создает 2,08·10 пар ионов 9 в 1 см3 атмосферного воздуха Единица введена в 1928 г. 1 Р = 2,58·10-4 Кл/кг Официальное использование понятия «экспозиционной дозы» прекращено с 1 января 1990 г. Тем не менее, понятие «экспозиционная доза» и ее внесистемная единица «рентген» до сих пор продолжают довольно часто использоваться и в ПОГЛОЩЕННАЯ ДОЗА D= dm *Элементарный объем среды — это наименьший объем среды, который воспринимается как однородный. Поглощенная доза (рус.) – Absorbed dose (англ.) Поглощенная доза ПОГЛОЩЕННАЯ ДОЗА (D) ионизирующего излучения — отношение средней энергии de, переданной ионизирующим излучением (любого вида) веществу, находящемуся в элементарном объеме*, к массе dm вещества в этом объеме: de D= В отличие от экспозиционной дозы понятие ПОГЛОЩЕННОЙ ДОЗЫ распространяется: 1) не только на γ- и рентгеновское излучение, но и на любой другой вид ионизирующего излучения; 1) не только на воздух, и на любые другие материалы. Единица в системе СИ Внесистемная единица Единицы поглощенной дозы Дж/кг joule/kg (J/kg) – единица, получившая специальное наименование грей (Гр) gray (Gy) Единица введена в 1975 г. рад rad (от англ. radiation absorbed dose) рад = 100 эрг/г. Единица введена в 1953 г. Зачем введено понятие эквивалентной дозы? Переходим к понятию эквивалентной дозы Биологический эффект ионизирующего излучения зависит не только от поглощенной дозы, но и от вида ионизирующего излучения Многочисленные исследования показали, что различные виды ИИ даже при одинаковых поглощенных дозах вызывают неодинаковый по величине биологический эффект. Это связано с тем, что величина поглощенной дозы показывает лишь усредненное количество энергии, переданной облучаемому объекту. • В связи с тем, что разные виды ионизирующих излучений могут проявлять существенно различающуюся • относительную биологическую • эффективность, было введено понятие • «ЭКВИВАЛЕНТНАЯ ДОЗА». • Понятие ЭКВИВАЛЕНТНОЙ ДОЗЫ было введено в целях оценки радиационной безопасности для человека. Эквивалентная доза (рус.) – Equivalent dose (англ.) Эквивалентная доза ЭКВИВАЛЕНТНАЯ ДОЗА (HT,R) для любого вида ионизирующего излучения R определяется как произведение средней поглощенной дозы DT,R данного вида излучения в органе или ткани T на соответствующий этому виду излучения взвешивающий коэффициент WR: HT,R =WR×DT,R ЭКВИВАЛЕНТНАЯ ДОЗА (HT,R) для смешанного ионизирующего излучения (т.е. состоящего из нескольких видов излучения) определяется следующим образом. HT =∑WR×DT,R R Значения взвешивающих коэффициентов WR видов ИИ (из НРБ-99/2009) Виды излучения WR Рентгеновское и γ-излучение любых энергий Электроны любых энергий 1 α-частицы, осколки деления и тяжелые ядра Протоны с энергией более 2 МэВ 5 Нейтроны с энергией: менее 10 кэВ 5 от 10 кэВ до 100 кэВ от 100 кэВ до 2 МэВ для различных 1 20 10 20 При однонитевом разрыве ДНК, используется в качестве матрицы неповрежденная нить Двунитевый разрыв ДНК не может быть правильно репарирован даже при наличии в клетке репарационных ферментных систем, т.к. вторая нить, которая могла бы служить матрицей, также повреждена Для количественного сравнения биологической эффективности разных видов ионизирующих излучений используют понятие «относительной биологической эффективности» (ОБЭ). Радиобиологический эффект зависит от радиационных и биологических факторов Ионизирующее излучение вызывает в биологических объектах различные патологические изменения, крайним проявлением которых является гибель облученных организмов. Степень и характер проявления радиобиологических эффектов зависят от различных радиационных факторов, характеризующих условия облучения, и от биологических факторов, характеризующих объект облучения. 1. Место расположения источника излучения по отношению к облучаемому организму В зависимости от места расположения источника ионизирующего излучения по отношению к облучаемому биологическому объекту облучение может быть: ВНЕШНИМ — когда источник излучения находится во внешней среде вне облучаемого организма; ВНУТРЕННИМ — когда облучение происходит в результате воздействия излучения от попавших в организм радиоактивных веществ (радионуклидов); КОМБИНИРОВАННЫМ — в реальной экологической обстановке встречается наиболее часто. Пути инкорпорирования радионуклидов в организм Проникновение (инкорпорирование) в организм радиоактивных веществ может осуществляться различными путями: 1) ингаляционным путем (т.е. с вдыхаемым воздухом); 2) алиментарным, или пероральным путем (т.е. через рот – с пищей и водой; 3) перкутанным путем (т.е. через кожу); 4) через слизистые оболочки глаза; Типы распределения РН в организме В зависимости от типа распределения в организме (т.е. от того в каких органах и тканях они преимущественно накапливаются) радионуклиды подразделяют на 5 основных групп: Тип распределения Равномерный Остеотропный, или скелетный Гепатотропный, или печеночный Нефротропный, или почечный Характерные примеры Цезий (137Cs) Стронций (90Sr), радий (226Ra) Плутоний (239Pu) Уран (238U) Изменение содержания РН в организме Уменьшение количества радионуклидов в организме происходит в результате двух процессов: 1) биологического выведения; 2) радиоактивного распада и осуществляется во времени по экспоненциальному закону: C C et =⋅ 0 −λ=эфф⋅t C e0 −(λ λбиол+ расп)t где t – это время после поступления радионуклидов в организм, а λэфф – константа эффективного выведения, Эффективный период полувыведения Tэфф представляет собой время, в течение которого содержание радионуклида в организме (или в органе) снижается вдвое. Константа эффективного выведения λэфф и эффективный период полувыведения Tэфф связаны следующими соотношениями: равная сумме константы биологического выведения λбиол и константы радиоактивного распада λрасп. Эффективный период полувыведения РН Вместо константы эффективного выведения λэфф часто используют величину эффективного периода полувыведения Tэфф. Tэфф =λ0,693эфф или λэфф = 0,693Tэфф 2. Вид ионизирующего излучения Вид ионизирующего излучения Опасность (эффективность) при внешнем облучении при внутреннем облучении γ-излучение + + β-излучение +/- + α-излучение - 20+ Опасность α-излучения при внутреннем облучении чрезвычайно высока! α-Излучение из-за низкой проникающей способности Опасность β-излучения Проникающая способность β-излучения занимает практически не представляет опасности при ВНЕШНЕМ промежуточное положение между α- и γ-излучениями: пробег облучении биологических объектов, имеющих размеры, β-частиц с энергией 1 МэВ в живой ткани не превышает значительно превышающие пробег α-частиц – 100 мкм. 0,5 см. Однако при ВНУТРЕННЕМ облучении биологических объектов (т.е., когда процесс α-распада радионуклидов, попавших в организм, осуществляется в непосредственной близости от жизненно важных клеток организма) α-излучение является чрезвычайно опасным, т.к. является ПЛОТНИИОНИЗИРУЮЩИМ. Поэтому при ВНЕШНЕМ облучении относительно крупных организмов (например, человека) поражающему действию β-излучения подвержены в основном только внешние ткани — кожа и глаза. Наибольшую опасность β-излучение представляет (как и α-излучение) при ВНУТРЕННЕМ облучении. При ВНУТРЕННЕМ облучении опасность β-излучения така 3. Пространственное распределение дозы ионизирующего излучения в организме В зависимости от того, подвергается ли воздействию излучения весь организм или только какая-либо его часть, облучение разделяют на следующие типы: • ОБЩЕЕ (или ТОТАЛЬНОЕ) облучение — воздействию излучения подвергается все тело; • • СУБТОТАЛЬНОЕ облучение — воздействию излучения подвергается бóльшая часть тела при защитном экранировании (например, свинцовыми пластинами) отдельных его областей или органов (например, головы, области живота, грудной клетки, конечностей, половых органов, и т.д.); • • ПАРЦИАЛЬНОЕ облучение — воздействию излучения подвергается отдельная область тела (например, голова, живот, грудная клетка и т.д.); • • ЛОКАЛЬНОЕ облучение — воздействию узких пучков излучения подвергается отдельный орган или небольшой участок тела. • Общее облучение – наиболее опасно! 4. Временнóе распределение дозы dt ионизирующего излучения Одну и ту же дозу можно дать за короткий интервал времени (т.е. с высокой мощностью дозы) или за длительный интервал времени (т.е. с низкой мощностью дозы). Для большинства радиобиологических эффектов исключительно важное значение имеет временнóе распределение дозы, т.е.: 1) длительность облучения, а также 2) наличие или отсутствие перерывов в облучении. Основным показателем, характеризующим распределение дозы во времени, является мощность дозы. Например, мощность поглощенной дозы — это отношение приращения поглощенной дозы излучения dD за интервал времени dt к этому интервалу времени: • dD D= Типы временного распределения дозы В зависимости от длительности облучения, величины используемой мощности поглощенной дозы, наличия или отсутствия перерывов между облучениями условно можно выделить следующие 4 основные типа облучения: ОСТРОЕ (или КРАТКОВРЕМЕННОЕ) облучение — лучевое воздействие при большой мощности дозы (ориентировочно от 0,1 Гр/мин и выше) длительностью от нескольких секунд до 2 часов; ПРОЛОНГИРОВАННОЕ (или ПРОТЯЖЕННОЕ) облучение — лучевое воздействие при сравнительно небольшой мощности дозы (от 0,1 Гр/час и ниже) длительностью от 2 часов до нескольких недель; ДРОБНОЕ (или ФРАКЦИОНИРОВАННОЕ) облучение — многократное лучевое воздействие с любой мощностью дозы (чаще при высокой мощности дозы в каждой фракции) с временными интервалами между фракциями облучения; ХРОНИЧЕСКОЕ облучение — лучевое воздействие длительностью от нескольких месяцев до нескольких лет, осуществляемое: – либо постоянно (т.е. без перерывов) при низкой мощности дозы (порядка 0,01 Гр/сут и ниже); – либо фракционированно (т.е. с перерывами) в небольших разовых дозах при любой мощности дозы. Сильное ослабление радиобиологических эффектов наблюдается при снижении мощности дозы ниже десятых и особенно сотых долей Гр/мин. Почему радиационный эффект ослабляется при снижении мощности дозы? Увеличение мощности дозы выше нескольких единиц Гр/мин не приводит к усилению радиобиологических эффектов. Ослабление радиобиологического эффекта при снижении мощности дозы или при фракционировании дозы связано с осуществлением в клетке восстановительных (репарационных) процессов повреждений ДНК. Таким образом, зависимость величины радиобиологического эффекта от мощности дозы не является линейной. Как известно, двунитевые разрывы ДНК – наиболее губительны для клетки, т.к. не могут быть правильно репарированы. Двунитевые разрывы ДНК могут возникнуть: Что такое «двунитевый разрыв» ДНК? Если разрывы находятся точно в комплиментарных участках обеих нитей ДНК – это двунитевый разрыв (повреждение) ДНК. Если разрывы в нитях ДНК расположены друг от друга на расстоянии Δ, не превышающем 6-10 нуклеотидов, то этот вариант повреждения тоже считается двунитевым разрывом Δ ( повреждением) ДНК. Если разрывы в участках нитях ДНК находятся на расстоянии Δ, превышающем 6-10 нуклеотидов, то этот вариант повреждения следует считать двумя однонитевыми разрывами (повреждениями) ДНК. при последовательном пролете 2-х редкоионизирующих частиц (или квантов) излучения, вызвавших разрывы в комплиментарных 1) участках ОБЕИХ нитей ДНК – это т.н. двусобытийный процесс образования двунитевого разрыва; 2) при пролете 1-й плотноионизирующей частицы (α-частицы), вызвавших разрывы в комплиментарных участках ОБЕИХ нитей ДНК – это т.н. однособытийный процесс образования двунитевого разрыва. Образование двунитевого разрыва ДНК в результате двусобытийного процесса Образование двунитевого разрыва ДНК в результате однособытийного процесса плотноионизирующих излучений (например, α-излучения) разрывы в комплиментарных участках ОБЕИХ нитей ДНК происходят в результате однособытийного процесса (т.е. пролета одной αчастицы). Т.е. независимо от частоты пролета α-частиц через молекулу ДНК каждый такой пролет αчастицы приводит к образованию двунитевого разрыва ДНК. Это означает, что при действии αизлучения отсутствует зависимость величины радиобиологического эффекта от мощности дозы облучения. Зависимость радиационного эффекта от мощности дозы для разных тканей Ослабление радиационного эффекта при снижении мощности дозы более характерно для тех тканей организма, которые обладают высокой пролиферативной активностью (например, для слизистой тонкой кишки). 5. Доза облучения Наиболее важным фактором, определяющим в конечном итоге степень радиационного поражения биологического объекта, является доза облучения. Поэтому в радиобиологических экспериментах наиболее распространенным является исследование дозовой (или дозной) зависимости какого-либо радиационного эффекта, отражающего ту или иную сторону лучевого поражения организма. Одним из наиболее часто применяемых критериев оценки действия излучения на биологические объекты является такой четко регистрируемый интегральный показатель как гибель организма, являющаяся конечным итогом многочисленных нарушений, происходящих при лучевом поражении. Оценку летального действия излучения на биологические объекты проводят исследуя зависимость гибели или выживаемости организмов от дозы облучения (т.е. от поглощенной дозы). Дозовая кривая гибели (и выживаемости) имеет типичную Подобные зависимости, представленные графически, получили название дозовой кривой гибели и дозовой кривой выживаемости. S-образную форму. На ней можно выделить несколько характеристических точек. Дозовые кривые гибели и выживаемости В случае многоклеточных организмов при построении такой кривой по оси абсцисс откладывают величину дозы облучения (т.е. поглощенной дозы), а по оси ординат — процент гибели или процент выживаемости, наблюдающийся в группах биологических объектов, облученных в разных дозах. Срок наблюдения, через который регистрируют гибель (или выживаемость) зависит, в частности от вида используемого организма. При исследовании летального действия излучения на большинство видов млекопитающих срок наблюдения составляет обычно 30 суток (однако, для некоторых видов млекопитающих этот срок составляет — 60 суток). Дозовая кривая гибели Дозовая кривая выживаемости Одна из них – это точка, значение ординаты которой составляет 50% гибели облученных организмов. Значение дозы, соответствующее абсциссе этой точки называется полулетальной дозой. Т.о., полулетальная доза – это доза облучения, при действии которой погибает 50% облученных организмов. Эту дозу обозначают как ЛД50 или ЛД50/30 (ЛД50/60), где в знаменателе подстрочного индекса указывают срок (в сутках), через который подсчитывают гибель. Величина ЛД50 очень широко используется в радиобиологии . Вторая характеристическая точка имеет в качестве абсциссы т.н. минимальную абсолютно летальную дозу (МАЛД), т.е. минимальную дозу, вызывающую гибель всех облученных организмов (ордината – 100% гибели). Третья характеристическая точка имеет в качестве абсциссы т.н. минимальную летальную дозу (МЛД), т.е. практически ту максимальную дозу, которая не вызывает гибели ни одного из облученных организмов (ордината – 0% гибели). Строго говоря термины «минимальная абсолютно летальная доза» и «минимальная летальная доза» не совсем правомерны, т.к. кривая гибели приближается к отметкам 100% и 0% ассимптотически. Поэтому обычно за МАЛД принимают дозу, вызывающую гибель 99% объектов (ЛД99), а за МЛД – дозу, вызывающую гибель 1% объектов (ЛД1). Летальные, сублетальные и сверхлетальные дозы Дозы облучения, лежащие в диапазоне от минимальной летальной дозы до минимальной абсолютно летальной дозы, называют летальными дозами. Дозы, превышающие минимальную абсолютно летальную дозу, определяют как сверхлетальные. Дозы, лежащие ниже минимальной летальной дозы – как сублетальные. Определение явления кислородного эффекта Существует несколько определений кислородного эффекта в радиобиологии. 1. Кислородный эффект в радиобиологии – это явление усиления повреждающего действия ионизирующего излучения при наличии в среде кислорода во время облучения. 2. Кислородным эффектом в радиобиологии называют радиозащитное действие гипоксии (т.е. пониженного содержания кислорода). 3. Кислородным эффектом в радиобиологии называют радиосенсибилизирующее действие кислорода. Кислородный эффект является универсальным явлением и наблюдается при облучении различных объектов – целых организмов, клеток и простых модельных систем. Кислородный эффект на культивируемых клетках при действии разных видов ионизирующих излучений Наиболее четко кислородный эффект на культивируемых клетках наблюдается при облучении редкоионизирующими излучениями (γ- и рентгеновским). При облучении плотноионизирующими излучениями кислородный эффект гораздо менее выражен (в случае нейтронного излучения) или полностью отсутствует (в случае α-излучения). ЛД вусловияхгипоксии50 ККУ= ЛД внормальных условиях50 Кривая гибели животных после облучения в условиях гипоксии сдвигается в область более высоких доз. Значения ККУ при облучении животных При облучении животных заметное снижение радиочувствительности, по сравнению с нормальным Зависимость ККУ от ЛПЭ ионизирующего излучения Более подробно зависимость ККУ от ЛПЭ ионизирующего облучения при облучении культивируемых клеток почки человека представлена на нижеприведенном рисунке. Возможные причины снижения кислородного эффекта при повышении ЛПЭ излучения (1) Существует несколько объяснений снижения кислородного эффекта при действии плотноионизирующего излучения на клетки. 1-е объяснение. При действии плотноионизирующего излучения количество одномоментно происходящих попаданий в мишень так велико, что поражение мишени достигает максимального уровня и становится необратимым даже в бескислородных условиях . 2-е объяснение. При действии плотноионизирующего излучения в результате дополнительных реакций вторичных продуктов радиолиза воды образуется кислород. Это приводит к тому, что реальных аноксических условий при облучении плотноионизирующим излучением создать невозможно. Дополнительные реакции с участием вторичных продуктов радиолиза воды становятся возможны, поскольку плотность радикалов, возникающих при действии плотноионизирующего излучения гораздо выше, чем при действии редкоионизирующего излучения. Так, в частности, повышается вероятность осуществления реакции рекомбинации 2-х гидроксильных радикалов и реакции гидроксильного радикала с перекисью водорода с образованием перекисного радикала: Первоначальные представления о физикохимическом механизме кислородного эффекта Первоначально высказывались предположения, что кислородный эффект на физико-химическом уровне обусловлен появлением более активных продуктов радиолиза воды в присутствии кислорода, а именно супероксиданионрадикала O2–• и перекисного радикала HO2•. Однако, позже было показано, что реакционная способность этих радикалов не превышает реакционной способности ) пероксидация мишени приводит к потере ее функциональных свойств (например, ферментативной активности и т.д.) и затрудняет ее репарацию (например, у молекулы ДНК) или вовсе делает ее невозможной. Повреждение становится нерепарируемым. Иными словами, кислород закрепляет («фиксирует») повреждение мишени. Описанную гипотезу о механизме кислородного эффекта часто называют «гипотезой кислородной фиксации» или «гипотезой пероксидации мишени». Летальные и потенциально летальные повреждения мишени Как видно из рисунка на предыдущем слайде, кислородный эффект отражает конкуренцию между процессами 1)простого восстановления Гипотеза кислородной фиксации В 1956 г. Т. Альпер и П. Говард-Фландерс высказали гипотезу о механизме кислородного эффекта, основанную на следующих положениях: а) в результате облучения мишени образуется ее активированное состояние; б) это активированное состояние мишени существует в течение очень короткого времени (несколько миллисекунд, не более 20 мс), а затем мишень возвращается в стабильное состояние (т.е. восстанавливается); в) в активированном состоянии мишень является очень реакционноспособной по отношению к кислороду; г) если во время облучения в среде присутствует кислород, то мишень в активированном состоянии взаимодействует с ним с образованием перекиси (гидроперекиси), т.е. происходит пероксидация мишени; (реституции) и 2)необратимой фиксации первичных повреждений мишени путем их пероксидации. Невосстанавливаемые (т.е. нерепарируемые) повреждения мишени могут возникать и без участия кислорода. Таким образом, при действии излучения на мишень могут возникать повреждения 2-х типов: а) повреждения I типа — потенциально летальные повреждения (скрытые), могут стать явными (летальными) при определенных условиях (в частности, при взаимодействии с кислородом); б) повреждения II типа — летальные всегда, их образование не зависит от каких-либо других факторов среды (в частности от наличия кислорода). Кислородный эффект • Кислород является одним из наиболее сильных модификаторов радиационного поражения. • Радиосенсибилизирующее действие кислорода обусловлено, в основном, его взаимодействием с потенциально летальными повреждениями жизненно важных молекул и переводом их в разряд летальных. • Радиосенсибилизирующий эффект кислорода максимален в случае действия редкоионизирующих излучений и снижается с увеличением ЛПЭ излучения. • Учет кислородного эффекта очень важен при радиотерапии злокачественных опухолей и даёт возможность более эффективно применять против них ионизирующее излучение и минимизировать индуцированные радиацией побочные эффекты на нормальную ткань. • Радиомодифицирующее действие других химических модификаторов лучевого поражения может осуществляться опосредованно через кислородный эффект. В 1949 г. было сделано открытие, положившее начало новому и очень важному (в теоретическом и практическом плане) направлению в радиобиологии. Две группы исследователей независимого друг от друга обнаружили, что некоторые химические соединения при введении непосредственно перед облучением могут повышать радиоустойчивость животных. Такие химические соединения получили название «радиопротекторы» (или химические радиопротекторы). Радиопротекторы вызывают сдвиг кривой гибели животных в область более высоких доз облучения Области возможного применения радиопротекторов 1. Использование радиопротекторов для защиты военного персонала от воздействия ионизирующего излучения при применении ядерного оружия. 2. Использование радиопротекторов как инструмента при исследовании механизмов биологического действия ионизирующего излучения. 1. Использование радиопротекторов для защиты космонавтов от ионизирующего излучения при космических полетах. 5. Использование радиопротекторов для защиты работников и населения от ионизирующего излучения при техногенных авариях. Основные предполагаемые механизмы действия радиопротекторов Среди основных предполагаемых механизмов действия радиопротекторов следует отметить следующие: Основные предполагаемые механизмы действия радиопротекторов Среди основных предполагаемых механизмов действия радиопротекторов следует отметить следующие: 1) перехват свободных радикалов и активных форм кислорода (АФК) 2) индукция гипоксии в организме, 1) обратимое ингибирование синтеза ДНК, 2) образование смешанных дисульфидов (защита сульфгидрильных групп жизненно важных биомолекул), 5) ускорение реституции (восстановления) ДНК благодаря способности радиопротекторов легко отдавать (донировать) атом водорода, 6) ускорение регенерации системы кроветворения, 7) ингибирование апоптоза. Существовало и существует довольно много гипотез и о других возможных механизмах действия радиопротекторов. Основные химические классы радиопротекторов Вещества, обладающие радиозащитными свойствами, обнаружены среди очень многих классов химических соединений. Однако, большинство наиболее эффективных радиопротекторов принадлежит к 2-м классам химических соединений: Аминотиолы и другие серосодержащие радиопротекторы Простейшим эффективным радиопротектором из класса аминотиолов является 2-меркаптоэтиламин (другие названия – МЭА, цистеамин, меркамин): NH2—CH2—CH2—SH АЭТ и МЭГ Среди этих аналогов МЭА было найдено много эффективных радиопротекторов, например: МЭА является продуктом декарбоксилирования аминокислоты NH цистеина и более эффективным радиопротектором (ФИД = 1,7) чем цистеин. О радиозащитной эффективности МЭА впервые сообщил З. NH2—CH2—CH2—S—C Аминоэтилизотиуроний (АЭТ). ФИД = 1.7. Бак в 1952 г. Обнаружение радиозащитных свойств МЭА стимулировало огромный интерес к поиску эффективных радиопротекторов среди серосодержащих химических соединений, особенно среди аналогов NH2 Гаммафос (1) Наиболее известным эффективным радиопротектором среди меркаптоалкиламинов является гаммафос (известный также под названиями WR-2721, амифостин, этиофос): OH NH2 —(CH2)3—NH —CH2—CH2—S—P = O OH Этот радиопротектор был синтезирован в 1969 г. в США в Исследовательском армейском институте имени У.Рида (Walter Reed Army Institute of Research) и получил известность как Предполагают, что избирательная защита нормальных клеток обусловлена 2-мя причинами: 1) концентрация мембраносвязанной щелочной фосфатазы (фермент, который отщепляет фосфатную группу и, таким образом, активирует гаммафос, т.к. для проявления его радиозащитного действия требуется свободная SH-группа) в нормальных клетках в 275 раз выше, чем в опухолевых клетках; 2) кровоснабжение опухолей гораздо хуже, чем нормальных тканей и поэтому поступление гаммафоса из крови в опухолевую ткань происходит значительно медленнее, чем в нормальную ткань. В результате действия этих 2-х механизмов концентрация гаммафоса в нормальной ткани в 50-100 раз выше, чем в опухолевой ткани. К органам, в которые легко поступает гаммафос, относятся почки, костный мозг, печень, сердце и легкие. Механизмы радиозащитного действия аминотиолов и других меркаптоалкиламинов Предполагают, что основными механизмами радиозащитного действия аминотиолов и других меркаптоалкиламинов являются следующие: • перехват свободных радикалов, • реституция поврежденных молекул ДНК путем донирования атома водорода. • интервал времени между введением и облучением – 15- 30 минут. Радиопротекторы из класса индолилалкиламинов Среди препаратов из класса индолилалкиламинов в качестве наиболее эффективных радиопротекторов можно выделить производные триптамина: Мексамин (хлорид 5-метокситриптамина). ФИД = 1.7 для 30-дневной выживаемости у мышей. Основные группы противолучевых средств природного происхождения Препараты природного происхождения, обладающие противолучевыми свойствами, обнаружены во многих группах биологически активных веществ, включая: • Антиоксиданты (α-токоферол, β-каротин, супероксиддисмутаза и др.). • Полисахариды (из дрожжей, морской водоросли ламинарии, • корня женьшеня и др.). Эйкозаноиды (простагландины, их синтетические производные и др.). • Гормоны (и их синтетические производные). • Различные экстракты и гидролизаты растительного и животного происхождения.