48. Газовые законы
реклама

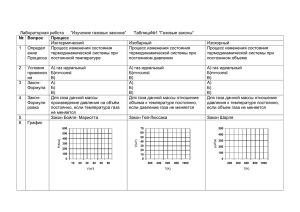
Каждый газ имеет право… Газовые законы 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 Газовые законы — количественные зависимости между двумя макроскопическими параметрами газа при неизменной массе и постоянстве третьего параметра. Изопроцессы — процессы, протекающие при неизменном значении одного из макроскопических параметров газа. Изопроцессы Изотермический Изобарный Изохорный 𝑇 = 𝑐𝑜𝑛𝑠𝑡 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑉 = 𝑐𝑜𝑛𝑠𝑡 Изотермический процесс 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 = 𝑐𝑜𝑛𝑠𝑡 𝑃𝑉 = 𝜈𝑅𝑇 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡 Закон Бойля-Мариотта 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡, при 𝑇 = 𝑐𝑜𝑛𝑠𝑡 Роберт Бойль 1627 — 1691 Эдм Мариотт 1620 — 1684 Изотермический процесс 𝑃 Изотерма 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 = 𝑐𝑜𝑛𝑠𝑡 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑉 𝑃= 𝑐𝑜𝑛𝑠𝑡 𝑃1 𝑉1 = 𝑃2 𝑉2 = ⋯ = 𝑃𝑛 𝑉𝑛 𝑃1 1 𝑇1 𝑃2 𝑉1 𝑇2 > 𝑇1 𝑇2 2 𝑉2 𝑉 Изобарный процесс 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑃𝑉 = 𝜈𝑅𝑇 𝑉 𝜈𝑅 = 𝑇 𝑃 𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑇 Закон Гей-Люссака 𝑉 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑃 = 𝑐𝑜𝑛𝑠𝑡 Жозеф Гей-Люссак 1778 — 1850 Изобарный процесс 𝑉 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑃 = 𝑐𝑜𝑛𝑠𝑡 Изобара 𝑃2 > 𝑃1 𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑉 = 𝑇 × 𝑐𝑜𝑛𝑠𝑡 𝑉2 𝑉1 𝑉2 𝑉𝑛 = =⋯= 𝑇1 𝑇2 𝑇𝑛 𝑉1 𝑃1 2 𝑃2 1 𝑇1 𝑇2 𝑇 Изохорный процесс 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑃𝑉 = 𝜈𝑅𝑇 𝑃 𝜈𝑅 = 𝑇 𝑉 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑇 Закон Шарля 𝑃 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑉 = 𝑐𝑜𝑛𝑠𝑡 Жак Шарль 1746 — 1823 Изохорный процесс 𝑃 𝑚 = 𝑐𝑜𝑛𝑠𝑡, 𝑉 = 𝑐𝑜𝑛𝑠𝑡 Изохора 𝑉2 > 𝑉1 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑃 = 𝑇 × 𝑐𝑜𝑛𝑠𝑡 𝑃2 𝑃1 𝑃2 𝑃𝑛 = =⋯= 𝑇1 𝑇2 𝑇𝑛 𝑃1 𝑉1 2 𝑉2 1 𝑇1 𝑇2 𝑇 𝑃𝑉 = 𝜈𝑅𝑇 𝑉 = 𝑐𝑜𝑛𝑠𝑡 МПа Манометр Закон Бойля-Мариотта (изотермический процесс) 1662 год 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡, при 𝑇 = 𝑐𝑜𝑛𝑠𝑡 1676 год Роберт Бойль 1627 — 1691 Эдм Мариотт 1620 — 1684 Закон Шарля (изохорный процесс) 1787 год 𝑃 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑉 = 𝑐𝑜𝑛𝑠𝑡 Жак Шарль 1746 — 1823 Закон Гей-Люссака (изобарный процесс) 1802 год 𝑉 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑃 = 𝑐𝑜𝑛𝑠𝑡 Жозеф Гей-Люссак 1778 — 1850 Уравнение Клапейрона 1834 год 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡, 𝑇 при 𝑚 = 𝑐𝑜𝑛𝑠𝑡 Бенуа Клапейрон 1799 — 1864 Уравнение Менделеева-Клапейрона 1874 год 𝑚 𝑃𝑉 = 𝑅𝑇 𝑀 Дмитрий Менделеев 1834 — 1907 Газ изотермически расширяется от объёма, равного 1 лл до объёма, равного33 лл. Если начальное давление газа было равно360 360 кПа кПа, то каким станет его давление, когда газ закончит расширяться? Дано: 𝑇 = 𝑐𝑜𝑛𝑠𝑡 𝑉0 = 1 л 𝑉 =3л 𝑃0 = 360 кПа 𝑃−? 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑃0 𝑉0 = 𝑃𝑉 1л 𝑉0 𝑃 = 𝑃0 𝑉 1 𝑃 = 360 × = 120 кПа 3 3л Воздушный шарик, изначально находящийся в комнате при температуре 𝟐𝟕 ℃, выносят на мороз. Если температура воздуха на улице равна −𝟐𝟑 ℃, то во сколько раз уменьшится объём шарика? Считать, что давление не изменилось, и шарик не пропускает воздух. Воздушный шарик, изначально находящийся в комнате при температуре 27 𝟐𝟕 ℃ ℃, выносят на мороз. Если температура воздуха на −23 ℃, ℃ то во сколько раз уменьшится объём шарика? улице равна −𝟐𝟑 Считать, что давление не изменилось, и шарик не пропускает воздух. Дано: 𝑇0 = 27 ℃ 𝑇 = −23 ℃ 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑚 = 𝑐𝑜𝑛𝑠𝑡 𝑉0 −? 𝑉 СИ 300 К 250 К 𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑉0 𝑉 𝑉0 𝑇0 = ⇒ = 𝑇0 𝑇 𝑉 𝑇 𝑉0 𝑇0 300 = = = 1,2 𝑉 𝑇 250 На графике показан некий процесс, происходящий с кислородом, масса которого 20 20 г.г Определите объём газа, соответствующий указанной на графике точке. Дано: 𝑚 = 0,02 кг 𝑂2 𝑉−? 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑚𝑅𝑇 𝑉= 𝑃𝑀 𝑀 𝑂2 𝑃 𝑉−? 80 кПа кг = 0,032 моль 300 К 𝑇 На графике показан некий процесс, происходящий с кислородом, масса которого 20 г. Определите объём газа, соответствующий указанной на графике точке. Дано: 𝑚 = 0,02 кг 𝑂2 𝑚𝑅𝑇 𝑉= 𝑃𝑀 𝑃 𝑉−? 80 кПа 𝑉−? 𝑀 𝑂2 кг = 0,032 моль 0,02 × 8,31 × 300 𝑉= = 0,019 м3 80000 × 0,032 300 К 𝑇 Основные выводы Название процесса Постоянный параметр Название закона Математическое описание закона Изотермический Температура, Т Бойля-Мариотта Изобарный Давление, Р Гей-Люссака 𝑉 = 𝑐𝑜𝑛𝑠𝑡 𝑇 Изохорный Объём, V Шарля 𝑃 = 𝑐𝑜𝑛𝑠𝑡 𝑇 𝑃𝑉 = 𝑐𝑜𝑛𝑠𝑡