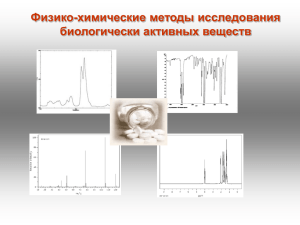
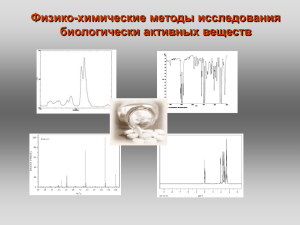
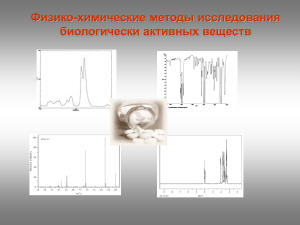
Лекция №1 - УФ-спектроскопия
реклама

КАФЕДРА БИОТЕХНОЛОГИИ И ОРГАНИЧЕСКОЙ ХИМИИ Физико-химические методы исследования биологически активных веществ Цель изучения дисциплины: формирование знаний, умений, навыков и компетенций в области использования современных физико-химических методов для анализа медицинских препаратов на подлинность и количественного определения действующего вещества в препарате. Структура курса: Лекции 16 ч Лабораторные занятия 32 ч Самостоятельная работа 64 ч Экзамен Методическое обеспечение курса: Сильверстейн Р., Вебетер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. - М.: БИНОМ. Лаборатория знаний, - 2011. – 520 с. Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир. 2006. -439с. (сетевые образовательные ресурсы в WebCT каф. ОХОС). Беккер Ю. Хроматография. Инструментальная аналитика: методы хроматографии и капиллярного электрофореза. –М.: ТЕХНОСИЛА. 2009. -470 с. Краснокутская Е.А. Физико-химические методы анализа биологически активных веществ. Томск: 2005. -142с. 5. Лебедев, А. Т. Масс-спектрометрия в органической химии. — М. : БИНОМ. Лаборатория знаний, 2003. — 493 с. (сетевые образовательные ресурсы в WebCT каф. ОХОС). Лекция №1 Введение Электромагнитный спектр. Электронная, или УФспектроскопия Контроль за ходом реакции Установление структуры вещества Контроль чистоты продукта Физико-химические методы исследования Спектральные методы: Масс-спектрометрия УФ-спектроскопия ИК-спектроскопия Комплексные методы: ЯМР-спектроскопия ГХМС ЖХМС Хроматографические методы: Тонкослойная хроматография Газовая хроматография Жидкостная хроматография ΔЕ = Ек – Ен ΔЕ > 0 поглощение энергии Спектр поглощения ΔЕ < 0 излучение энергии Эмиссионный спектр ΔЕ – изменение энергии системы; Ек и Ен – энергия системы в конечном и начальном состояниях Электромагнитный спектр с=ln с – скорость света [см/с] l – длина волны [см], n – частота(в циклах за секунду [с-1], или в герцах [Гц]). Размерность l, n С увеличением частоты излучения длина волны уменьшается Е=hn h – постоянная Планка, (9.534∙10-14 ккал∙с/моль), n – частота [Гц]. С увеличением частоты излучения возрастает и его энергия, с увеличением длины волны излучения его энергия падает Электромагнитный спектр Излучение λ, см Е, эв Процессы, происходящие при поглощении или излучении γ-Лучи 10-11- 10-8 ~ 107 Изменения в энергетическом состоянии ядер (спектроскопия γ-резонанса) Рентгеновские лучи 10-8- 10-6 ~ 105 Изменения в энергетическом состоянии внутренних электронов атомов (рентгеноспектроскопия) Ультрафиолетовое и видимое 10-6- 10-4 ~ 10 Изменение энергетического состояния внешних электронов (электронная спектроскопия) Инфракрасное 10-4- 10-2 ~ 10-1 Колебание атомов в молекуле (ИК-спектроскопия) Микроволновое 10-1- 10 ~ 10-3 Колебание атомов в кристаллической решетке; изменение вращательного энергетического состояния Радиоволны > 10 ~ 10-6 Изменение энергетического состояния спинов ядер и электронов (спектроскопия ЯМР и ЭПР) Электронная, или УФ-спектроскопия «Видимая» часть спектра 400 - 800 нм Ультрафиолетовая часть спектра 1- 400 нм Область вакуумного УФ-излучения (дальняя ультрафиолетовая область ) 1 – 200 нм λ=400 нм Е=? 3,10 Ближняя УФ-область (ультрафиолетовые лучи) 200 – 400 нм E=hν ν=1/λ 200 нм h=4.136*10-15 эВ*с 6.20 эВ Возбуждение и релаксация Электронные спектры поглощения наблюдаются в результате поглощения ультрафиолетового и видимого излучения В результате происходит переход (возбуждение) валентного электрона с занимаемого им уровня на уровень с более высокой энергией при облучении УФ излучением в-во не разрушается и не изменяется, что позволяет получать данные о его хим. составе и структуре положение полос и линий определяется разностью энергий разл. электронных состояний атомов и молекул Закон Бера-Бугера-Ламберта Экспериментально открыт П. Бугером (1729), теоретически выведен И.Г. Ламбертом (1760), для растворов исследован А. Бером (1852) Величина потока лучистой энегрии прямо пропорциональна числу частиц поглощаемого вещества П. Бугер И.Г. Ламберт - молярный коэффициент поглощения lg (I0/I) = alc При с [моль/л], b[см] , a = А = lg (I0/ I) Т = I/I0 А = - lgТ А = lc а - коэффициент поглощения, константа, зависящая от l, но не зависящая от концентрации; l - длина оптического пути; c - концентрация А – погашение (оптическая плотность D) Т - пропускание Величина молярного коэффициента поглощения пропорциональна вероятности определенного перехода Способы изображения электронных спектров Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны (Ǻ , нм) или частоты (см-1) Величина поглощения может быть выражена: процентом поглощения [(I0 – I)/ I0 · 100% ], процентом пропускания [(I/I0) · 100%], оптической плотностью D , коэффициентом молярного поглощения (ε) или его логарифмом (lgε) lмаксгексан = 235 нм ( 5400). Области поглощения растворителей, наиболее часто используемых в УФ-спектроскопии А = 0,2 до 0,7. сведения о концентрации раствора и толщине кюветы всегда должны сопровождать выдаваемый прибором спектр А = f(λ) Взаимосвязь электронных спектров и структуры органических молекул Для характеристики спектральных изменений, вызванных модификацией структуры, введены специальные термины: гипсохромный сдвиг (синий сдвиг) – для смещения полос поглощения в коротковолновую область спектра; батохромный сдвиг (красный сдвиг) – для смещения полос поглощения в область длинных волн; гиперхромный эффект – увеличение интенсивности поглощения; гипохромный эффект – уменьшение интенсивности поглощения. Гиперхромный эффект Оптическая плотность Гипохромный эффект Гипсохромный сдвиг Батохромный сдвиг Длинна волны, нм диэтиловый гексан эфир вода метанол этанол Гипсохромный сдвиг полосы n > p* при увеличении полярности растворителя 305 312 315 326 l, нм 327 Батохромный сдвиг полосы p -> p* при увеличении полярности растворителя 230 237 238 244 l, нм Взаимосвязь электронных спектров и структуры органических молекул Хромофоры Хромофор -простая функциональная группа, ответственная за поглощение с характеристическими величинами и l спектр соединения - сумма спектральных X--Y характеристик индивидуальных хромофоров X и Y X-Y новый, хромофор с новыми спектральными характеристиками Ауксохром – функциональная группа, которая сама по себе не поглощает в близком ультрафиолете, но может влиять на поведение сопряженного с ней хромофора Типичные ауксохромы: -SH, -NH2 , -OH Основные хромофорные группы Хромофор Тип перехода λmax log(ε) нитрилы n → π* 160 <1.0 алкины π→ π* 170 3.0 алкены π→ π* 175 3.0 спирты n→σ* 180 2.5 простые эфиры n→σ* 180 3.5 π→ π* 180 3.0 n → π* 280 1.5 π→ π* 190 2.0 n → π* 290 1.0 n→σ* 190 3.5 кислоты n → π* 205 1.5 сложные эфиры n → π* 205 1.5 амиды n → π* 210 1.5 тиоспирты n → π* 210 3.0 нитросоединения n → π* 271 <1.0 азосоединения n → π* 340 <1.0 кетоны альдегиды амины Электронные спектры поглощения основных классов органических соединений s → s* переходы Предельные углеводороды Соответствующие им полосы поглощения лежат в далеком ультрафиолете: · метан – 122 нм · этан – 135 нм · алканы - < 150 нм с гетероатомами (О, S, N, галогены) Насыщенные углеводороды s → s* и n → s* переходы соединение ls → s*, нм ln→ s*, нм CH3OH 150 177 CH3NH2 170 215 CH3Cl 150 173 В области 200 – 800 нм большинство углеводородов и их производных «прозрачны», что позволяет использовать их в качестве растворителей. Для функциональных производных эта область чуть уже: 250 – 800 нм. Электронные спектры поглощения основных классов органических соединений s → s* p → p* (lmax =165 нм, max > 104) переходы Этилены Алкильные заместители в этилене смещают p → p* полосу поглощения в красную область, и с ростом числа алкильных заместителей величина батохромного сдвига увеличивается. Соединения с сопряженными двойными связями Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы p →p* перехода Структура Фрагмента Величина инкремента, нм Диеновая система в одном кольце 36 Дополнительное сопряжение, двойная связь 30 Экзоциклическая двойная связь (двойная связь вне цикла) 5 Заместители: · алкил · -OR · -OCOR · SR · -NR2 · -Cl, -Br 5 6 0 30 60 5 2 двойные связи (1,4) в сопряжении (+2*30) d CH3 b CH e C 4H9 3 3 экзоциклические двойные связи (1,4, С=О: 3*5) 4 a 1 2 c 3 5 алкильных радикалов (a,b,c,d,e: 5*5) CH O CH33C OCO O Диеновый фрагмент (2,3 – диен в цикле: 217 + 36) lmax 217 36 2 * 30 3 * 5 5 * 5 353нм lexp max 356 нм Электронные спектры поглощения основных классов органических соединений Карбонилсодержащие соединения O R C R n → p* n → s* p → p* переходы Обнаруживается в УФ-спектре по полосе n → p* перехода. Положение чувствительно к полярности растворителя и характеру заместителей X, Y. В полярных растворителях (особенно склонных к образованию водородных связей) эта полоса смещается гипсохромно. Замена Н-атома другими заместителями X, Y также приводит к гипсохромному сдвигу. Электронные спектры поглощения основных классов органических соединений Ароматические соединения В бензоле p → p * переходы ε, л/моль см λ, нм 180 6104 203 8103 230-260 200 Полоса бензольного поглощения На положение полосы в области 200 – 300 нм значительное влияние оказывают заместители и растворители Влияния заместителей на положение полосы поглощения ароматическим кольцом определяется характером заместителя. Заместители с I-эффектом практически не меняют вид спектра > C=C - связь > C=O - связь Сопряжение > C=C-C=O p* p -> p* p n -> p* p -> p* p-p p* - p* p* p* p* n -> p* np p -> p* p pp H 3 CH C=O C2NH2 HH5O CH Cl 3 204 204 214 214 235 235 275 290 275 290 295 295 l, нм