Органическая химия Обобщение материала для подготовки к экзаменам.
реклама

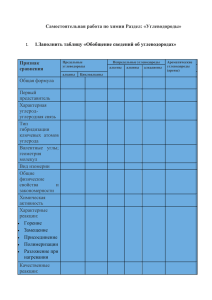
Органическая химия Обобщение материала для подготовки к экзаменам. Автор: учитель химии высшей категории МОУ «СОШ п. Учебный Ершовского района Саратовской области» Пятахина А.К. 2011год Лучший гарант успешной сдачи ЕГЭ – уверенное знание химии! Органическая химия • Раздел химии, изучающий строение, свойства, превращения, способы получения и области применения органических веществ, называется органической химией. • Органическая химия есть химия углеводородов и их производных. Изомеры • Вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а, следовательно, и различные свойства, называются изомерами. • Явление существования изомеров в химии называют изомерией. Типы структурной изомерии Углеродного скелета Положения кратной связи Положения функциональной группы Межклассовая изомерия С2Н6О : СН3-СН2-ОН СН3-О-СН3 Этиловый спирт Диметиловый эфир Типы химических реакций в органической химии 1. Реакции присоединения. • реакция гидрирования кат СН2=СН2 + Н2 СН3-СН3 этилен этан • галогенирования СН2=СН2 + Cl2 СН2Cl-СН2Cl этилен 1,2-дихлорэтанэтан • гидрогалогенирования СН2=СН2 + НBr СН3-СН2Br этилен бромэтан кат • гидратации СН2=СН2 + Н2О СН3-СН2-ОН этилен этиловый спирт Типы химических реакций в органической химии • 2. Реакции отщепления. • дегидрирования • дегидратации • кат СН3-СН3 СН2=СН2 + Н2 этан этилен кат СН3-СН2-ОН этиловый спирт СН2=СН2 + Н2О этилен дегидрогалогенирования: СН3-СН2Br + NaOH СН2=СН2 + NaBr + H2O бромэтан этилен Типы химических реакций в органической химии • 3. Реакции замещения. СН3Br + NaOH CH3OH + NaBr бромметан метиловый спирт свет CH4 + Cl2 CH3Cl + HCl метан хлорметан Типы химических реакций в органической химии • 4. Реакции изомеризации. кат СН3-СН2-СН2-СН3 СН3-СН-СН3 СН3 н-бутан изобутан Гомологический ряд. Гомологи. • Ряд веществ, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН2-, называется гомологическим рядом. Вещества такого ряда называются гомологами. Гомологический ряд метана • • • • • • СН4 метан С2Н6 этан С3Н8 пропан С4Н10 бутан С5Н12 пентан С6Н14 гексан • СnH2n+2 алкан Алкильные радикалы Формула Название СН3- метил С2Н5- этил С3Н7- пропил С4Н9- бутил С5Н11- амил С6Н13- гексил СnH2n+1- алкил Углеводороды. Алканы. • Алканы представляют собой предельные (насыщенные) углеводороды, молекулы которых содержат только простые углеродуглеродные связи С-С и незамкнутую цепь углеродных атомов. • Общая формула алканов СnH2n+2. Углеводороды. Алканы. • Для предельных углеводородов наиболее характерны реакции замещения, в частности, галогенирования. • Реакция дегидрирования позволяет из предельных углеводородов получать соединения с двойной углерод-углеродной связью – алкены. • Реакции с разрушением углеродного скелета (пиролиз, крекинг) широко используются в промышленности для получения практически важных веществ: водорода, сажи, ацетилена, непредельных углеводородов. Углеводороды. Алканы. • Получают алканы, главным образом, из природных источников: природного и попутного газа, нефти. Углеводороды. Алкены. • Этиленовые углеводороды (алкены) содержат в молекуле одну углеродуглеродную связь С=С • и имеют общую формулу СnH2n. Углеводороды Алкены. • Для алкенов характерны реакции присоединения: • Наибольшее значение имеют реакция гидратации (для получения этилового спирта) и особый тип реакции присоединения – полимеризация (для получения полимеров). Качественные реакции на этилен и его гомологи, как непредельные соединения, обесцвечивание: (а) бромной воды, (б) раствора перманганата калия. Углеводороды. Алкены. Алкены можно получить дегидрированием алканов или дегидратацией спиртов. Углеводороды. Алкадиены. • Диеновые углеводороды (алкадиены) содержат в молекуле две двойные углерод-углеродные связи С=С • и имеют общую формулу СnH2n-2. Углеводороды. Алкадиены. • Для алкадиенов как непредельных углеводородов характерны реакции присоединения. Они протекают ступенчато. На первой стадии происходит присоединение реагента по крайним атомам с перемещением двойной связи к центральным атомам углерода. На второй стадии присоединяется вторая молекула реагента. Подобно алкенам, алкадиены способны полимеризоваться, образуя при этом особый тип эластичных полимеров – каучуки. Углеводороды. Алкадиены. Алкадиены можно получить дегидрированием алканов при нагревании в присутствии катализаторов. Углеводороды. Алкины • Ацетиленовые углеводороды (алкины) содержат в молекуле одну тройную углерод-углеродную связь С С • и имеют общую формулу СnH2n-2. Углеводороды. Алкины • Ацетилен получают взаимодействием карбида кальция с водой и • неполным разложением метана. Углеводороды. Алкины • Для алкинов, как непредельных углеводородов, характерны реакции присоединения, многие из которых протекают ступенчато. Как непредельный углеводород, ацетилен обесцвечивает: • (а) бромную воду, • (б) раствор перманганата калия. Углеводороды. Алкины Алкины способны полимеризоваться (тримеризация, димеризация). Обладают кислотными свойствами, вступая в реакцию замещения с натрием, с концевой тройной связью реагируют с аммиачным раствором оксида серебра, образуя ацетилениды. Ацетилен – важное сырье для получения винилхлорида, уксусного альдегида, используется для сварки и резки металлов. Ароматические углеводороды. Арены. • Ароматическими углеводородами (аренами) называются углеводороды, содержащие в своем составе бензольное кольцо Атомы углерода в молекуле бензола связаны особыми ароматическими или полуторными связями. общая формула СnH2n-6. • Н Н Н С С С Н Н Н Н Н или С Н С С Н Н Н Ароматические углеводороды. Арены. • Бензол не дает качественных реакций на непредельные соединения (однако присоединяет хлор, водород), • для него более характерны реакции замещения ( при галогенировании и нитровании замещается один атом водорода). Бензол используют как растворитель органических веществ, важное сырье для производств. Природные источники углеводородов • Россия обладает богатыми запасами углеводородного сырья – нефти, природного газа, каменного угля. Это не только топливо, но и ценное химическое сырье. Основными процессами нефтепереработки являются ее перегонка и крекинг, а каменного угля – коксование. Важнейшие продукты нефтепереработки: бензин, керосин, лигроин, газойль, мазут. Продукция коксохимического производства – это кокс, каменноугольная смола, надсмольная вода, коксовый газ. Природные источники углеводородов • • • • • • • Ректификацией (перегонкой) называют разделение жидких смесей на фракции или отдельные компоненты на основании различия в их температуре кипения. Фракция Число атомов углерода в молекуле Углеводородный газ 3-4 Бензин 5-12 Лигроин 8-14 Керосин 12-18 Газойль (дизельное топливо) 17-22 Мазут > 20 Крекгинг • Крекгингом называется процесс переработки нефтепродуктов при повышенных температуре и давлении с целью получения продуктов с меньшей молекулярной массой. Вторичная переработка нефтепродуктов сопровождается протеканием химических реакций: to С16Н34 С8Н18 + С8Н16 гексадекан октан октен Риформинг • Риформингом называют переработку нефтепродуктов с целью получения ароматических углеводородов. Основу процесса риформинга составляют реакции дегидрирования предельных углеводородов с образованием бензола и других аренов: C6H14 > C6H6 + 4H2 Коксование • Коксование – это процесс высокотемпературного нагревания угля без доступа воздуха. • Продукция коксохимического производства – это кокс, каменноугольная смола, надсмольная вода, коксовый газ. Спирты • Спирты содержат в молекуле одну или несколько гидроксильных групп, связанных с углеводородным радикалом. Поэтому бывают однои многоатомные спирты. Имеют общую формулу R – (OH)n Спирты Этиловый спирт получают присоединением воды к этилену или брожением сахаристых веществ. Спирты Для предельных одноатомных спиртов характерны реакции дегидратации и окисления. Качественной реакцией на многоатомные спирты служит взаимодействие с гидроксидом меди (II), в результате которой осадок растворяется с образованием ярко-синего соединения меди. Спирты • Кроме того обладают кислотными свойствами (с Na), но кислотные свойства слабее, чем у воды. • Вступают в реакции замещения (с галогеноводородами и этерификация). Фенол Молекула фенола состоит из ароматического радикала фенила, связанного с гидроксильной группой, ОН имеет формулу С6Н5ОН. Н Н Н Н Н Фенол Фенол получают из каменноугольной смолы или из производных бензола (при нагревании хлорбензола со щелочью получают фенолят щелочного металла, который с соляной кислотой превращают в фенол). Фенол На примере фенола можно рассмотреть положение теории химического строения о взаимном влиянии атомов в молекулах органических соединений. Он проявляет кислотные свойства (с Na), и легко вступает в реакции замещения атомов водорода в бензольном кольце (с Br2). Альдегиды и кетоны Альдегиды содержат в молекуле карбонильную (альдегидную) О группу – С Н , связанную с углеводородным радикалом. имеют общую формулу R – СОН, а кетоны R-С- R1 О Альдегиды Альдегиды получают окислением соответствующих спиртов. Уксусный альдегид получают из ацетилена по реакции Кучерова. Альдегиды • Альдегиды окисляются в соответствующие карбоновые кислоты. Качественные реакции на альдегиды – взаимодействие с аммиачным раствором оксида серебра (реакция «серебряного зеркала» и с гидроксидом меди (II). • Формальдегид с фенолом вступает в реакцию поликонденсации с образованием фенолоформальдегидной смолы. Карбоновые кислоты • Карбоновыми кислотами называются органические вещества, содержащие карбоксильную группу –СООН, связанную с углеводородным радикалом. Общая формула R – СООН Карбоновые кислоты • Органические кислоты обладают кислым вкусом и изменяют окраску индикаторов, взаимодействуют с активными металлами, оксидами и гидроксидами металлов, солям, спиртами (реакция этерификации). Специфические свойства муравьиной кислоты Как сильный восстановитель вступает в реакцию серебряного зеркала с образованием помимо серебра углекислого газа и воды. Обладает бактерицидным действием. Карбоновые кислоты • Карбоновые кислоты используются как сырье, вкусовые добавки, консерванты, как сырьё для получения искусственных волокон, пластмасс, растворителей, лекарственных веществ, ядохимикатов, красителей. Сложные эфиры • Сложные эфиры – это продукт реакции этерификации (взаимодействия кислоты со спиртом). В природе сложные эфиры обусловливают запах многих плодов и фруктов, составляют основную часть воска. Сложные эфиры • Синтетические сложные эфиры используются в качестве пищевых добавок, растворителей, лекарственных веществ. Сложные эфиры гидролизуются. Сложные эфиры. Жиры Жиры представляют O собой сложные СН2 О С R1 эфиры O трехатомного СН О С R2 O спирта глицерина СН2 О С R3 и высших фрагмент кислотные карбоновых глицерина остатки кислот. С3Н7-СООН масля ная кислота С15Н31-СООН пальмитиновая кислота С17Н35-СООН стеариновая кислота С17Н33-СООН олеиновая кислота Сложные эфиры. Жиры • Жидкие жиры (растительные масла) содержат остатки непредельных кислот (олеиновой, линолевой C17H31COOH) и могут быть превращены в твёрдые жиры реакцией гидрирования. • Щелочной гидролиз жиров носит название омыления и приводит к получению мыла. Углеводы • Углеводы – органические вещества состав которых обычно соответствует общей формуле Сn(H2O)m. Различают моносахариды (глюкоза С6H12O6), дисахариды (сахароза С12H22O11) и полисахариды (крахмал и целлюлоза (С6H10O5)n). Углеводы • Моносахариды (С6H12O6) – это углеводы,которые не гидролизуются. • Глюкоза – это соединение с двойственной функцией, альдегидоспирт. Она восстанавливается в шестиатомный спирт сорбит и окисляется до глюконовой кислоты, вступая в реакцию «серебряного зеркала» и со свежеосаждённым гидроксидом меди(II); вступает в реакции брожения (спиртового, молочнокислого). • Глюкоза применяется в медицине, пищевой промышленности, играет важную биологическую роль. • Фруктоза- кетоноспирт (изомер глюкозы) – основная часть мёда. Углеводы • Дисахарид (сахароза С12H22O11)гидролизуется с образованием глюкозы и фруктозы. Углеводы • Полисахариды (С6H10O5)n : крахмал и целлюлоза – гидролизуются с образованием глюкозы. • Крахмал используется как продукт питания, в производстве спирта, в текстильной и пищевой промышленности. • Целлюлоза используется для производства гидролизного спирта, искусственного волокна, полимерных пленок, горючих и взрывчатых веществ. Амины • Амины – органические вещества, содержащие функциональную аминогруппу –NH2, связанную с углеводородным радикалом. Амины – органические основания. Взаимодействуют с кислотами с образованием солей. Основные свойства ослабевают в ряду: метиламин >аммиак >анилин Амины. Анилин • Анилин взаимодействует с кислотами с образованием солей. Свойства анилина отражают положение теории химического строения о взаимном влиянии атомов в молекуле (ослабление основных свойств). • Анилин, в отличие от бензола, вступает в реакции бромирования по трём положениям-2,4,6 -кач. р. Амины. Анилин • Анилин получают из нитробензола по реакции Зинина. Анилин применяют для производства красителей, лекарств и др. Аминокислоты • Аминокислоты содержат в молекуле карбоксильную группу –СООН и аминогруппу –NH2 и представляют собой амфотерные органические соединения. • Реагируют и с кислотами, и со щелочами с образованием солей. Аминоуксусная кислота (глицин) H2N-CH2-COOH Аминокислоты • В живой природе наиболее важны • -аминокислоты. • Они вступают в реакцию друг с другом, образуя пептиды, в том числе и такие важнейшие, как белки. • Аминокислоты с концевым расположением функциональных групп – сырье для получения полимеров (капрон). Белки • Белки – это природные полипептиды. Белки играют в живых организмах ряд важнейших функций: строительную, каталитическую, защитную, транспортную и др. Строение природных белков характеризуется первичной, вторичной, третичной структурами. Разрушение последних двух называется денатурацией. Белки горят, гидролизуются и дают две качественные цветные реакции – биуретовую и ксантопротеиновую Ферменты • Ферменты – это биологические катализаторы белковой природы. Характеризуются высокой активностью, селективностью, действуют в узких интервалах температур и значений рН. В живых организмах осуществляют все биохимические реакции, составляющие сущность химической природы жизни. Широко используются в промышленности, в том числе в биотехнологии. Витамины и гормоны • Витамины и гормоны – природные биологически активные соединения. Отсутствие, недостаток или избыток витаминов приводят к авитаминозам, гиповитаминозам и гипервитаминозам. Гормоны – это продукты желез внутренней секреции, имеющие различную химическую природу. Гормоны осуществляют гуморальную (химическую) регуляцию деятельности отдельных органов, систем органов и всего организма в целом). Например, недостаток инсулина приводит к сахарному диабету. УДАЧИ!