спектроскопии со спектроскопией Мандельштама
реклама
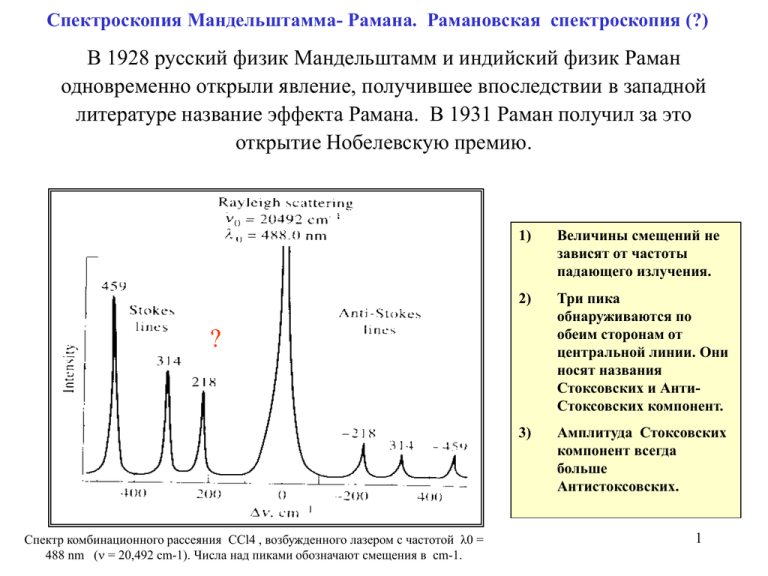
Спектроскопия Мандельштамма- Рамана. Рамановская спектроскопия (?) В 1928 русский физик Мандельштамм и индийский физик Раман одновременно открыли явление, получившее впоследствии в западной литературе название эффекта Рамана. В 1931 Раман получил за это открытие Нобелевскую премию. 1) Величины смещений не зависят от частоты падающего излучения. 2) Три пика обнаруживаются по обеим сторонам от центральной линии. Они носят названия Стоксовских и АнтиСтоксовских компонент. 3) Амплитуда Стоксовских компонент всегда больше Антистоксовских. ? Спектр комбинационного рассеяния CCl4 , возбужденного лазером с частотой λ0 = 488 nm ( = 20,492 cm-1). Числа над пиками обозначают смещения в cm-1. 1 Сравнение ИФ- спектроскопии со спектроскопией Мандельштама-Рамана Инден Амид I Спектры инфракрасной спектроскопии очень похожи на спектры спектроскопии Мандельштама-Рамана. Это связано с тем, что и спектроскопия Мандельштамма-Рамана и инфракрасная спектроскопия являются формами вибрационной спектроскопии, которая связана с переходами между колебательными уровнями энергии. Однако, принципиальное отличие первой от последней состоит в том, что спектроскопия Мандельштама-Рамана базируется на рассеянии света, тогда 2 как инфракрасная спектроскопия базируется на поглощении света. Колебательные движения в молекуле О=C=O О О C C О Симметричные колебания атомов не приводят к изменению дипольного момента молекулы CO2. Поэтому такие колебания не будут проявляться в ИФ-спектрах . О Асимметричные колебания атомов приводят к изменению дипольного момента молекулы CO2. Поэтому такие колебания будут проявляться в ИФспектрах Правила отбора для ИФ-спектров: Колебания атомов должны сопровождаться изменением дипольного момента молекулы Правила отбора для спектров Мандельштама-Рамана: колебания атомов должны сопровождаться изменением поляризуемости молекулы Вывод: колебания, активные в ИФ-спектроскопии не всегда активны в спектроскопии Мандельштама-Рамана и наоборот. 3 Вторичная структура белка и спектры Мандельштамма-Рамана Amide I Полоса для детекции фибрилл Тип структуры 1655 ±5 -спираль в H2O 1632±5 -спираль в D2O 1670±3 Антипараллельная -структура в H2O 1655±3 Беспорядочная структура в H2O 1658±2 Беспорядочная структура в D2O 4 Микроскопия Мандельштамма-Рамана Схематическая диаграмма микроскопа, основанного на рассеянии Мандельштама-Рамана и предназначенного для изучения одиночных белковых кристаллов. Сравнение структуры в кристалле и в растворе 5 Считается, что разворачивание и неправильное сворачивание белка, ведущее к образованию протяженных β-листов, служит причиной амилоидогенных заболеваний. Так, нативные растворимые белки частично разворачиваются и агрегируют, вероятно используя остаточный домен «β-лист» как ядро нуклеации. Это приводит к амилоидному фибрилогенезу и, как следствие, образованию нерастворимых волокон Пик при 1673 см-1 обусловлен образованием β-листа (Dong et al., 2003) Структура инсулиновых фибрил, образованных мягким перемешиванием 6 раствора белка в 60% этаноле с 0.25 M NaCl при 35oC.