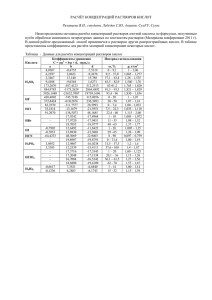
Среда водных растворов
реклама
СРЕДА ВОДНЫХ РАСТВОРОВ. Водородный показатель (рН растворов). Автор: Каталева В.В. учитель химии Ломовской С.О.Ш. Цель Рассмотреть количественные характеристики кислотной, щелочной и нейтральной сред водных растворов, способы их определения Среда растворов В природных растворах и в растворах, используемых в технике, часто ничтожно малые величины играют чрезвычайно большую роль. К таким величинам относится концентрация водородных ионов. Диссоциация воды Вода-слабый электролит. Она ( в незначительной степени) диссоциирует на ионы Н+ и ОН независимо от того, что в ней растворено. Н2О Н+ + ОН Поэтому ионы Н+ присутствуют не только в чистой воде и в растворах кислот, но и в растворах щелочей. Среда растворов В растворах кислот преобладают ионы водорода Н+, т.к. концентрация ионов Н+ превышает концентрацию ионов ОН, в растворах же щелочей, наоборот, концентрация ионов ОН превышает концентрацию ионов Н+. Среда растворов Если в водном растворе [Н+]=[ОН] среда раствора нейтральная [Н+]>[ОН] среда раствора кислая [Н+]<[ОН] среда раствора щелочная Водородный показатель В 1л чистой воды при 25С на ионы расщеплено лишь 10-7 моль молекул. Следовательно, концентрация ионов Н+ составляет 10-7 мольл, такова же концентрация в воде и ионов ОН Показатель степени в величине, обозначающей концентрацию ионов Н+ называется водородный показатель pН Шкала кислотности растворов рН [Н+] рОН характеристика 0 100 14 Сильнокислая 1 10-1 13 Сильнокислая 2 10-2 12 Сильнокислая 3 10-3 11 Умеренно кислая 4 10-4 10 Умеренно кислая 5 10-5 9 Слабокислая 6 10-6 8 Слабокислая 7 10-7 7 Нейтральная 8 10-8 6 Слабощелочная 9 10-9 5 Слабощелочная 10 10-10 4 Умеренно щелочная 11 10-11 3 Умеренно щелочная 12 10-12 2 Сильнощелочная 13 10-13 1 Сильнощелочная 14 10-14 0 Сильнощелочная Индикаторы Определить среду раствора можно с помощью индикаторов. Вещества, которые под действием растворов кислот и щелочей изменяют свой цвет, называются индикаторами ( от лат. indicator – указатель). К ним относятся, например, лакмус, метиловый оранжевый, фенолфталеин и многие другие. Исследование свойств растворов, применяемых в быту, и некоторых продуктов питания индикаторами. Оборудование и реактивы: универсальный индикатор, лакмус, фенолфталеин, растворы мыла, стиральной соды, питьевой соды, поваренной соли NaCl, аммиака в воде, вода, аскорбиновая, яблочная, лимонная, молочная кислоты, пробирки, фарфоровые чашки, пипетки. Ход работы. Разделить полученные растворы на 3 пробирки каждый. Исследовать растворы универсальным индикатором, лакмусом, фенолфталеином в классе, самодельным индикатором дома. Внимание! После каждого анализа необходимо тщательно мыть посуду, иначе результаты следующего опыта могут быть искаженными. Методика получения растворов органических кислот из продуктов питания. 1. Исследование яблочной и лимонной кислот. Выдавить в фарфоровую чашечку немного сока лимона или сочного яблока (5 мл) и подействовать на него индикатором. 2. Исследование молочной кислоты. а) В фарфоровую чашку налить кефир (5-10 мл) и исследовать его индикатором. б) 5 г творога настоять с водой в течение 30 мин. Отфильтровать и проверить фильтрат индикатором. 3. Исследование щавелевой кислоты. Листья и стебли щавеля тщательно растереть в ступке. Слить получившийся сок в пробирку или фарфоровую чашку и исследовать индикатором. 4.Исследование аскорбиновой кислоты. Ягоды клюквы размять в фарфоровой чашке, сок слить и исследовать его индикатором. В качестве результата работы можно дать задание учащимся составить рекомендации по мерам безопасности при хранении и работе в быту с исследованными веществами.