Качественный элементный анализ
реклама
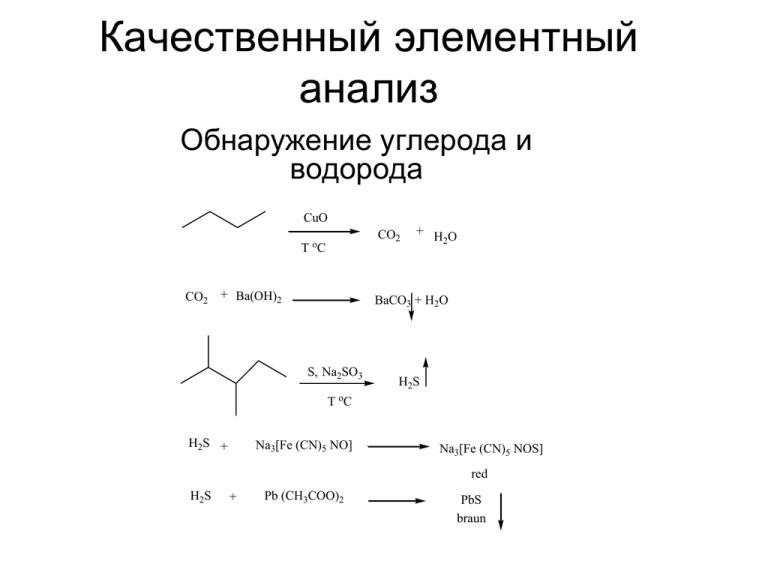
Качественный элементный анализ Обнаружение углерода и водорода CuO CO2 o T C CO2 + Ba(OH)2 + HO 2 BaCO3 + H2O S, Na2SO3 H2S o T C H2S + Na3[Fe (CN)5 NO] Na3[Fe (CN)5 NOS] red H2S + Pb (CH3COO)2 PbS braun Элементный анализ Основные различия между методами анализа органических веществ и неорганических веществ связано с особенностью строения органических веществ. Большая часть неорганических соединений – электролиты, которые в водном растворе диссоциируют на ионы и определяются в виде ионов. Органические вещества, в основном, не растворяются в воде и не диссоциируют на ионы. При анализе органических веществ решается ряд задач, которые сходны с задачами при анализе неорганических веществ. Первая задача состоит в том, чтобы определить какие химические элементы входят в состав данного вещества. Методами качественного анализа определяют из каких химических элементы состоит данное анализируемое вещество. Вторая задача состоит в том, чтобы определить сколько атомов каждого химического элемента входит в состав данного анализируемого вещества. Методами элементного количественного анализа определяют количественный элементный состав данного вещества. Иногда на основе этих данных можно установить к какой группе органических соединений относится исследуемое вещество. В ряде случаев количественный анализ служит средством оценки качества органического продукта. Наибольшее значение в производственных лабораториях имеют методы качественного и количественного анализа по функциональным группам. Таким образом, методы анализа органических соединений можно классифицировать: 1. Качественный элементный анализ 2. Количественный элементный анализ 3. Качественный анализ органических веществ по функциональным группам 4. Количественный анализ по функциональным группам 5. Простейшие физические методы анализа органических веществ (определение температуры плавления, температуры кипения, температуры кристаллизации или затвердевания, плотности и др.) Для анализа используются различные физические, химические и физико-химические методы. Анализ неизвестного органического соединения выполняется в определённой последовательности. Предварительные исследования 1. Характеристика внешнего вида образца Агрегатное состояние (газ, твердое, жидкое), цвет, запах. 2. Проводят пробу на прокаливание Небольшое количество вещества (0,1 г) помещают на фарфоровую или платиновую пластину, держа пластину тигельными щипцами, подносят к пламени газовой горелки и осторожно нагревают. При этом следует обратить внимание на цвет пламени, воспламеняемость вещества, не является ли вещество взрывчатым. Наблюдать, как вещество плавится, или не наблюдается плавления визуально и сразу происходит разложение вещества. Происходит ли разложение вещества с выделением определенного запаха или без запаха. Есть ли остаток после прокаливания. 3. Определение физических констант 3.1. Для жидких веществ Определение плотности (пикнометрический метод), температуры кипения, показателя преломления (рефрактометрический метод), вязкости. 3.2. Для твердых веществ Определение температуры плавления, растворимости, плотности, твердости, показателя преломления, магнитных и электрических свойств, кристаллографических характеристик (методом рентгенофазового анализа и поляризационным микроскопом). 3.3. Для газов Определение упругости пара, плотности газа, точки плавления, температуры кипения, молекулярной массы. 4. Проводят определение растворимости Исследуемый образец пытаются растворить в следующих растворителях: в воде, в эфире, ацетоне, бензоле, в растворе щелочи, растворе кислоты соляной или серной. 5. Разложение органического вещества (проба Лассеня) Большинство органических соединений состоит из сравнительно небольшого числа элементов: C, H, O, N, S, P, Cl … Для открытия многих элементов, входящих в молекулу органического вещества, последнее разлагают таким образом, чтобы перевести в неорганические соединения отдельные элементы, которые затем определяют обычными методами качественного неорганического анализа. Для разложения органических веществ используют реакцию сплавления с щелочными металлами (проба Лассеня), например, металлическим натрием. В результате сплавления образуются продукты реакции следующего состава. Если органическое вещество содержало азот, то продукт сплавления имеет состав NaCN; если исходное органическое вещество содержало серу S, то продукт реакции имеет состав Na2S. Если анализируемое вещество содержало элементы азот и серу (N,S), то продукт сплавления имеет состав NaSCN. Если в анализируемое вещество входил элемент хлор Cl, то образуется продукт с формулой NaCl. Если в анализируемом веществе содержался фосфор P, то продукт реакции будет Na3PO4 . Качественный элементный анализ Обнаружение углерода и водорода Проба Лассеня для N, S, Hal Cl Na N Br(F) I o T C NaCN + Na2S + NaCl (Br,I.F) FeCl3 Fe3[Fe(CN)6]4 SH NaCN + FeCl2 Na4[Fe(CN)6] Na2S + Na [Fe (CN) NO] 3 5 Na3[Fe (CN)5 NOS] red Na2S + Pb (CH3COO)2 NaCl + AgNO3 2 NaBr + CaOCl2 2 NaI + CaOCl2 HNO3 PbS braun AgCl + NaNO3 HCl CHCl3 Br2 + CaCl2 HCl CHCl3 I2 + CaCl2 Определение фосфора • • • Окисление азотной кислотой (конц.) исследуемого соединения до фосфорной кислоты Na3PO4+3NH4Cl+12(NH4)2MoO4+24 HNO3=(NH4)3H4[P(Mo2O7)6]+10 H2O+24NH4NO3+3NaCl Желтый крист. осадок фосфоромолибдата аммония






