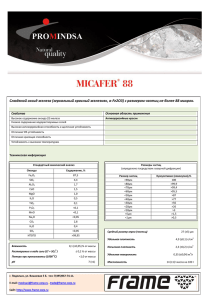
Лекция 09
реклама
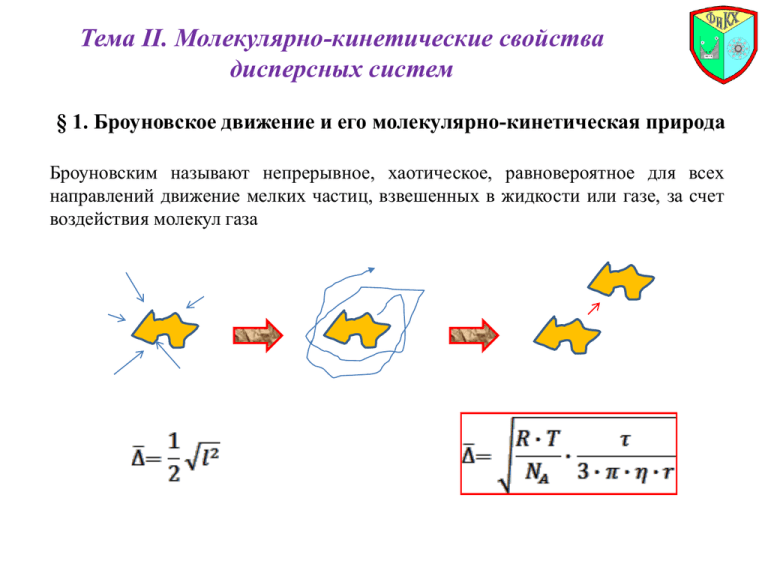
Тема II. Молекулярно-кинетические свойства дисперсных систем § 1. Броуновское движение и его молекулярно-кинетическая природа Броуновским называют непрерывное, хаотическое, равновероятное для всех направлений движение мелких частиц, взвешенных в жидкости или газе, за счет воздействия молекул газа Средний сдвиг частиц аэрозоля (за 1 с) r, м ,м 10-9 10-7 10-5 1.28*10-3 1.68*10-7 1.23*10-8 Броуновским движение наиболее ярко выражено у высокодисперсных систем, а его интенсивность зависит от дисперсности. Для высокодисперсных систем средний сдвиг составляет около 1мм, для среднедисперсных – около 1 мкм, в случае систем с размерами частиц больше 10 мкм броуновским движением частиц дисперсной фазы можно пренебречь § 2. Диффузия Диффузией называют самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. Различают молекулярную диффузию , ионную диффузию и диффузию коллоидных частиц 1-й закон Фика (одномерная стационарная диффузия) 2-й закон Фика (одномерная нестационарная диффузия) Значения коэффициентов диффузии D, м2/с (в жидкости) ионная молекулярная коллоидных частиц 10-8 10-9 10-10 Эйнштейн и Смолуховский, постулировав единство природы броуновского и теплового движения, установили количественную связь между средним сдвигом частиц (амплитудой смещения) и коэффициентом диффузии частиц D Уравнение Эйнштейна-Смолуховского Уравнение Эйнштейна Уравнение Эйнштейна-Смолуховского Если к движению частиц можно применить закон Стокса, то: Закон Стокса Уравнение Эйнштейна-Смолуховского В воздухе коэффициент диффузии частиц радиусом 1 нм составляет порядка 10-6 м2/с, 100 нм – 10-8 м2/с, 10 мкм – 10-10 м2/с. Для грубдодисперсных систем коэффициент диффузии пренебрежимо мал, а диффузией частиц можно пренебречь. Диффузия в полной мере проявляется у высокодисперсных систем, ослаблена у среднедисперсных и практически отсутствует у грубодисперсных. § 3. Осмотическое давление золей При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной), возникает поток растворителя от раствора с меньшей концентрацией (растворенного вещества) к раствору с большей концентрацией (растворенного вещества), приводящий к уравниванию концентраций. Этот процесс называется осмосом. раствор 1 (менее концентрированный) h мембрана С2>>C1 (µ2>>µ1) раствор 2 (более концентрированный) Осмотическое давление – это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану. Осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при той же температуре занимало бы тот же объем, что и раствор. Уравнение Вант-Гоффа (справедливо для разбавленных молекулярных растворов) Уравнение Вант-Гоффа (справедливо для разбавленных растворов слабых электролитов) Лиозоли ( - частичная концентрация) Осмотическое давление лиозоля увеличивается с ростом числа частиц в единице объема (даже при постоянной массе частиц дисперсной фазы) r1=r2, 12, c1c2 c1=c2, 12, r1 r2 Осмотическое давление коллоидных растворов (высокодисперсных систем с жидкой дисперсионной средой) невелико и составляет несколько миллиметров водного столба (1 мм.водн.ст. 10 Па) Осмотическое давление истинных растворов значительно выше и составляет: 35 атм – для сока сахарной свеклы, 25 атм – для экстракта кофе, 1, 5 атм – для фруктовых соков, 60 атм – для 6 %-ного раствора сахара