а) ГФУ. Реакция с раствором аргентум нитрата в среде
реклама

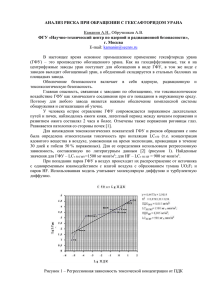
Лекция № 1 Тема: Предмет и содержание фармацевтической химии. Общие положения об организации контроля качества лекарственных средств в Украине. Неорганические лекарственные средства из группы галогенов доц. Яворская Л.П. План 1. Предмет и содержание фармацевтической химии, ее взаимосвязь с химическими, медико-биологическими и фармацевтическими дисциплинами. 2. Общие положения об организации контроля качества лекарственных средств в Украине. 3. Государственная Фармакопея Украины, Международная Фармакопея и другая аналитическая нормативная документация, которая регламентирует доброкачественность фармацевтических препаратов. 4. Классификация лекарственных средств. 5. Неорганические лекарственные средства из группы галогенов: получение, свойства (описание и растворимость), идентификация, испытание на чистоту, количественное определение, условия хранения, применение в медицинской практике препаратов: Флуора (натрия фторид); Хлора (кислота хлоридная, натрия и калия хлориды, известь хлорная); Брома (натрия и калия бромиды); Йода (йод и его спиртовые растворы, натрия и калия йодиды). Натрия фторид (ГФУ) Natrіum phthorіdum Natrіі fluorіdum NaF Химическое название: натрий флюорид. Натрия фторид содержит не менее 98,5 % и не более 100,5 % натрия фторида Na, в пересчете на сухое вещество. Получение 1. Спекание плавикового шпата СаF2 с песком SіO2 и содой Na2CO3 (метод Сажина): СаF2 + Na2CO3 + SiО2 →2NaF + CaSiО3 + CO2 Свойства Описание. Порошок белого цвета или бесцветные кристаллы. Растворимость. Растворимый в воде Р, практически нерастворимый в 96 % спирте Р. Идентификация 1. Реакции на катионы Натрия: а) ГФУ. Взаимодействие с калий гексагидроксостибатом(V) образуется густой осадок белого цвета: NaCl + K[Sb(OH)6] →Na[Sb(OH)6] + KCl. Осадок растворяется в минеральных кислотах и в растворах лугов. б). ГФУ. Взаимодействие с метоксифенилацетатной кислоты реактивом ; образуется объемный белый кристаллический осадок в) ГФУ, N. Пирохимическая реакция. Соль Натрия, смоченная кислотой хлоридною Р і внесенная в бесцветное пламя, окрашивает его в желтый цвет: Na+ + hV→Na+→ Na+ + hV1. г) Нефармакопейная реакция. Взаимодействие с раствором цинкуранил ацетата в среде ацетатной кислоты; образуется осадок желтого цвета (кристаллы октаедрической формы): Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO- + 9H2O → NaZn[(UO2)3(CH3COO)9] + 9HO 2. Реакции на фторид-иони: а) ГФУ, Черных. Реакция с раствором кальций хлорида образуется белый осадок 2NaF + CaCl2 = CaF2↓ + 2NaCl б) ГФУ. Реакция с раствором ализарина S и раствором цирконил нитрата – окрашивание раствора изменяется от красного до желтого NaF + HCl = HF + NaCl O O OH OH 2 SO3Na + Алізарин S 1,2-діоксиантрахінон3-сульфонат натрію жовте забарвлення OH ZrO(NO3)2 O цирконіл- 2+ ZrO SO3 O нітрат OH 2 червоне забарвлення + 2 NaNO3 в) Взаимодействие с насыщенным раствором плюмбум(ІІ) хлорида (нефармакопейная реакция) – образуется белый осадок PbCl2 + F– PbClF + Cl – Количественное определение 1. ГФУ. Ацидиметрия, неводное титрования Химизм процесса можна изобразить двома стадиями: NaF + СН3СООН (NaFН)+СН3СОО– СН3СООН + HClO4 СН3СООН2+ClO4– Прибавляє єти уравнения получим віражение: (NaFН)+СН3СОО– + СН3СООН2+ClO4– NaClO4 + НF + 2СН3СООН NaF + HClO4 NaClO4 + НF Еm(NaF) = M. м. Хранение. Список сильнодействующих веществ. В плотно закукопорених контейнерах, в защищенном от света месте. Применение. Профилактика кариеса зубьев, лечение и профилактика остеопороза Фтор, в основном, накапливается в костной и зубной тканях, образовывая мало растворимые фторапатиты. Стимулирует минерализацию твердых тканей зуба, оказывает содействие затвердению зубной эмали и потому применяется для профилактики кариеса зубьев и других зубных заболеваний в виде зубных паст. Обнаруживает бактерицидное действие относительно микроорганизмов, которые появляются при кариесе зубьев Форма выпуска: таблетки (драже) по 0,015 или 0,02 г для взрослых; таблетки светло-желтого цвета для детей, которые содержат 0,0011 г, таблетки белого цвета по 0,0022 г Na. За границей выпускают препараты: драже "Флюосен" (0,015 г препарата), "Короберон" (0,02 г), "Оссин" (0,04 г). В детской практике применяют "Витафтор", в состав таблеток кроме натрия фториду входят витамины A, C, D. Кислота хлористоводородная концентрированная ГФУ, доп. 1 Acіdum hydrochlorіdum concentratum HCl Химическое название: кислота хлоридная, кислота хлороводородная. Кислота хлористоводородная концентрированная содержит не менее 35,0 % (м/м) и не более 39,0 % (м/м) HCl. Кислота хлоридная (Acіdum hydrochlorіcum purum), что используется в медицинской практике, содержит 24,8-25,2 % HCl (плотность 1,125-1,127 г/см3). Другим врачебным препаратом является кислота хлоридная разбавленная (Acіdum hydrochlorіcum dіlutum), что содержит 8,2-8,3 % HCl (плотность 1,040-1,041 г/см3). Свойства Описание. ГФУ, доп. 1. Прозрачная, бесцветная, димлячая жидкость. ДФ Х и др. л-ра. Бесцветная, прозрачная, улетучивающая, кислая на вкус жидкость со своеобразным запахом. Растворимость. ГФУ, доп. 1. Смешивается с водой Р. (Относительная плотность составляет близко 1,18) Идентификация 1. ГФУ, доп. 1. Действие на индикаторы Субстанцию разводят водой Р. Полученный раствор должен иметь сильнокислу реакцию. ДФ Х: Хлоридна кислота - сильная кислота, что окрашивает метиловый оранжевый и метиловый красный в розовый цвет (за счет ионов гідроксонію H3O+). 2. Реакции на хлорид-ионы (см. натрия хлорид) а) ГФУ. Реакция с раствором аргентум нитрата в среде нитратной кислоты - образуется белый творожистый осадок. б) ГФУ. Действие окислителей с последующей идентификацией газа хлора При действии окислителей (ГФУ - калий дихромат К2Cr2O7), а также манган диоксид Mn2О и др.) выделяется газ хлор Cl2 (нюхать нельзя - отравляющий газ!): HCl + AgNO3 → AgCl↓ + НNO3; Cl– + Ag+ → AgCl↓ AgCl↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O. 14HCl + K2Cr2O7 = 3Cl2 + 2CrCl3 + 2KCl + 7H2O Cr2O72– + 14H+ + 6е 2Cr3+ + 7Н2О 2Cl– – 2е Cl2 MnО2 + 4HCl = MnCl2 + Cl2 + 2H2O MnО2 + 4H+ + 2е Mn2+ + 2H2O 2Cl– – 2е Cl2 NH O NH C NH NH C 6H5 + CL 2 C 6H5 -2 HCl N O N C 6H5 + CL2 C NH NH C 6H5 -2 HCl O N N C 6H5 N N C 6H5 C Количественное определение 1. ГФУ, доп. 1. Алкалиметрия, прямое титрование. Точно взвешивают закрытую коническую колбу с притертой стеклянной пробкой, которая содержит 30 мл воды Р. Прибавляют 1,5 мл субстанции, колбу закрывают пробкой и снова взвешивают. Полученный раствор титруют 1 М раствором натрий гидроксиду в присутствии индикатора раствора метилового красного Р к переходу окраски от розового до желтого (интервал перехода 4,2-6,2). HCl + NaOH = NaCl + H2O Еm(HCl) = M. м. 2. Нефармакопейный метод. Измерение плотности раствора кислоты. Приблизительную концентрацию раствора кислоты хлоридної можно установить путем измерения его плотности с помощью ареометра или пикнометра. Плотность концентрированного (36,5 %) раствора должны быть 1,19 г/см3, а 25 % раствора - 1,125 г/см3. 3. Нефармакопейный метод. Аргентометрия за методом Фольгарда, обратное титрование (см. натрия хлорид). Суть методики заключается в том, что к исследуемому раствору прибавляют двукратный излишек стандартного раствора аргентум нитрата AgNO3. Излишек аргентум нитрата відтитровують раствором аммоний тиоцианата NH4SCN в присутствии индикатора ферум(ІІІ) аммоний сульфата (NH4)Fe(SO4)2 к красно-розовой окраске. HCl + AgNO3 = AgCl + HNO3 AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + (NH4)Fe(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Еm(HCl) = M. м. Обратите внимание, использовать прямую аргентометрию за методом Мора нельзя , так как сильнокислая среда Хранение. Список сильнодействующих веществ. В контейнере из стекла или другого инертного материала, при температуре ниже 30 С. Применение. Средство, которое регулирует метаболические процессы Кислоту хлоридную разбавленную применяют в каплях и микстурах (часто вместе с пепсином) при недостаточной кислотности желудочного сока, который должны содержать 0,3-0,5 % HCl. Назначают вглубь 2-4 раза в день к или во время пищи по 10-15 капля на 0,25-0,5 склянки воды. 6 % раствор кислоты хлоридной применяют для лечения чесотки за Демьяновичем. Вместе с препаратами Ферума используют для лечения гипохромной анемии (кислота оказывает содействие лучшему всасыванию Ферума). В. г. д. вглубь для взрослых - 2 мл (40 капель) разбавленной HCl; В. д.д. Внутрь для взрослых - 6 мл (120 капель) разбавленной HCl. Замечание. Если в рецепте не указанная концентрация кислоты хлоридной, надо отпускать только кислоту хлоридную разбавленную Acіdum hydrochlorіcum dіlutum (8,2-8,4 %). Натрия хлорид ГФУ, доп. 1, Черных, С. 601 Natrіі chlorіdum SODІUM CHLORІDE Natrіum chloratum NaCl Химическое название: натрий хлорид Натрия хлорид содержит не меньше 99,0 % и не больше 100,5 % NaCl, в перерасчете на сухое вещество. Получение 1. Из воды озер и морей путем выпаривания. 2. Очищение технической каменной соли NaCl от примесей, которые осуществляют последовательно. Добавлением раствора барий хлорида ВаCl2 осаживают сульфаты и фосфаты: SO42– + Ba2+ BaSO4 HPO42– + Ba2+ BaHPO4 Осадок отфильтровуют, а к фильтрату прибавляют излишек натрий карбоната (соды) Na2CO3 для осаждения примесей солей Магния, Кальция и Бария: Mg2+ + CO32– MgCO3 Ca2+ + CO32– CaCO3 Ba2+ + CO32– BaCO3 Для устранения излишка соды фильтрат подкисляют с помощью хлоридної кислоты HCl: Na2СО3 + 2HCl = 2NaCl + H2O + CO2 Свойства Описание. ГФУ, доп. 1. Кристаллический порошок белого цвета, бесцветные кристаллы или белые крупинки. ДФ Х. Белые кубические кристаллы или белый кристаллический порошок без запаха, соленый на вкус. Растворимость. ГФУ, доп. 1. Легко растворимый в воде Р, практически нерастворимый в этаноле Р. Идентификация 1. Реакции на ионы Na+ (см. натрия фторид) а) ГФУ. Взаимодействие с калий гексагидроксостибатом(V); образуется белый осадок. б) ГФУ. Реакция с метоксифенилацетатной кислоты реактивом; образуется белый осадок. в) ГФУ. N. Пирохимическая реакция. Окраска бесцветного пламени улетучивающими солями Натрия в желтый цвет. г) Нефармакопейная реакция. Взаимодействие с раствором цинк уранилацетату; образуется желтый осадок. 2. Реакции на хлорид-анионы а) ГФУ. Реакция с раствором аргентум нитрата в среде нитратной кислоты б) ГФУ. Действие окислителей в кислой среде со следующей идентификацией газа Количественное определение 1. ГФУ, доп. 1. Аргентометрия, прямое титрование с потенциометрической фиксацией точки эквивалентности NaCl + AgNO3 = AgCl + NaNO3 Еm(NaCl) = M. v. 2. ГФУ, доп. 1, N, Черных. Тиоцианатометрия NaCl + AgNO3 = AgCl + NaNO3 AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + (NH4)Fe(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Еm(NaCl) = M. м. 3. ДФ Х. Аргентометрия за методом Мора. Прямое титрование исследуемого раствора препарата стандартным раствором аргентум нитрата AgNO3 в нейтральной среде в присутствии индикатора калий хромата K2CrO4 NaCl + AgNO3 = AgCl↓ + NaNO3 Еm(NaCl) = M. м. 2AgNO3 + K2CrО4 = Ag2CrО4↓ + 2KNO3 4. Аргентометрия за методом Фольгарда, обратное титрование (см. метод 2) Суть методики заключается в том, что к исследуемому раствору прибавляют двукратный излишек стандартного раствора аргентум нитрата AgNO3. NaCl + AgNO3 = AgCl + NaNO3 Еm(NaCl) = M. м. AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + (NH4)Fe(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Еm(NaCl) = M. м. 5. Аргентометрия за методом Фаянса. Прямое титрование исследуемого раствора препарата стандартным раствором аргентум нитрата AgNO3 в присутствии адсорбционного индикатора - флуоресцеина. Флуоресцеин используют при титровании хлоридов, бромидов, йодидов при рн = 10. При определении хлоридов эозин не применяют, так как изменение цвета осадка наблюдается еще к достижению точки эквивалентности NaCl + AgNO3 = AgCl + NaNO3 Еm(NaCl) = M. м. 6. Меркуриметрия. Прямое титрование исследуемого раствора стандартным раствором меркурий(ІІ) нитрата Hg(NO3)2 в присутствии индикатора дифенилкарбазону к изменению окраски от желтокрасного до синего 2NaCl + Нg(NO3)2 = НgCl2 + 2NaNO3 Еm(NaCl) = M. м. В точке эквивалентности лишняя капля титранта Нg(NO3)2 взаимодействует с индикатором дифенилкарбазоном с образованием комплекса синего цвета N 2O N C NH NH C 6H5 N + Hg(NO3)2 C 6H5 O C 6H5 C 6H5 N N N C Hg C NH N N C 6H5 C 6H5 NH O + 2 HNO3 Преимущества меркуриметрии. 1. Титрование галогенидов в кислой среде. 2. Не используется дорогой реактив (аргентум нитрат AgNO3). 3. Соли Меркурию(ІІ) легко регенерируются. Применение.Плазмозаменитель Ионы Na+ - это основные внеклеточные Ионы. Натрия хлорид содержится в крови (0,5 %) и в тканевых жидкостях, обеспечивая осмотическое давление крови (7,7-7,8 атм). Он есть основной составной частью всех солевых растворов, которые применяются как плазмозаменители. Изотонический (0,9 %) раствор натрия хлорида (Solutіo Natrіі chlorіdі іsotonіca pro іnjectіonіbus) применяют подкожно, интравенозно (чаще всего капельним путем) и в клизмах как дезинтоксикациойное средство и при обезвоживании организма, при кровотечениях, шоке (иногда - до 3 л на пор). Нельзя вливать изотонический раствор натрия хлорида при гипернатриемии, циркуляторных нарушениях, которые угрожают возникновению отека мозга и легких, при лечении большими дозами кортикостероидов. Введение больших объемов этого раствора может привести к хлоридному ацидозе, гипергидратации, усиление вывода Калия из организма. Калия хлорид ГФУ, доп. 1 Kalіі chlorіdum KCl Химическое название: калий хлорид Калия хлорида содержит не менее 99,0 % и не больше 100,5 % КCl, в перерасчете на сухое вещество Получение 1. Очищение естественных солей Калия от примесей (осуществляют аналогично натрия хлорида). Необходимое высушивать. Влаги не содержит вещество Свойства Описание. ГФУ, доп. 1. Кристаллический порошок белого цвета или бесцветные кристаллы. Растворимость. ГФУ, доп. 1. Легко растворимый в воде Р, практически нерастворимый в этаноле Р. Идентификация 1. Реакции на катионы Калия а) ГФУ. Реакция с тартратной (виннной) кислотойобразуется белый кристаллический осадок: O O C + K HO C CH OH HO CH OH + + HO CH HO CH OH C + H . OK C O O б) ГФУ. Реакция с натрий кобальтнитритом - сразу образуется желтый или оранжево-желтый осадок 2KBr + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaBr. + + 2К + Na + [Co(NO2)6]3– → K2Na[Co(NO2)6]↓ в) ГФУ, N. Пирохимическая реакция. Соль Калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет (при рассматривании сквозь синее стекло - пурпурово-красный) К+ + hν → *К+ → К+ + hν1. 2. Реакции на хлорид-анионы а) ГФУ. Реакция с раствором аргентум нитрата в среде нитратной кислоты KCl + AgNO3 → AgCl↓ + KNO3; Cl– + Ag+ → AgCl↓ AgCl↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O б) ГФУ. Действие окислителей в кислой среде со следующей идентификацией газа хлора. При действии окислителей (ГФУ - калия дихромат К2Cr2O7) в присутствии кислоты сульфатной (или хлоридной) выделяется газ хлор Cl2 (нюхать нельзя - ядовитый газ!). Для идентификации газа хлора Cl2, что выделяется, ГФУ предлагает поместить возле отверстия пробирки кусочек фильтровальной бумаги, пропитанной раствором дифенилкарбазида Р - см. натрия хлорид. 6KCl + K2Cr2O7 + 7H2SO4 = 3Cl2 + Cr2(SO4)3 + 4K2SO4 + 7H2O Cr2O72– + 14H+ + 6е 2Cr3+ + 7Н2О 2Cl– – 2е Cl2 Количественное определение 1. ГФУ, доп. 1. Аргентометрия, обратное титрование (тиоцианатометрия) КCl + AgNO3 = AgCl + КNO3 Еm(КCl) = M. м. AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + (NH4)Fe(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 2. Аргентометрия за методом Мора (см. натрия хлорид) Еm(КCl) = M. м. 3. Аргентометрия за методом Фаянса (см. натрия хлорид) Еm(КCl) = M. м. 4. Меркуриметрия (см. натрия хлорид) Еm(КCl) = M. м. Применение. Источник йонов Калия, антиаритмическое средство Ионы Калия являются основными внутриклеточными йонами. Взаимодействие йонов Калия с йонами Натрия, которые являются основными внеклеточными йонами. Калия хлорид применяют для приготовления плазмозаменителей, при гипокалиемии (значительном удалении йонов Калия из организма вследствие приема диуретиков; при недостатке Калия при лечении препаратами группы кортизона); при интоксикациях сердечными гликозидами, что вызывают нарушение сердечного ритма (антиаритмическое средство). Принимают калия хлорид орально по 1 г 4-7 раз в день; в случае трудных интоксикаций вводят 500 мл 0,4-0,5 % раствора препарата интравенозно крапельним методом; быстрое интравенозное введение препарата может вызвать смерть. Формы выпуска: порошок, таблетки по 0,5 г и 1 г (предварительно надо подробить и растворить в воде), 4 % раствор для инъекций; 10 % раствор для приема внутрь Известь хлорная ДФ ІX Calcarіa chlorata Известь белильная OCl 3 Ca * Ca(OH)2 * nH2O Cl Хлорная известь - это смесь кальций гипохлорита Ca(ClО)2 и кальций хлорида CaCl2: Ca(ClО)2CaCl2 = Ca2O2Cl4 = 2CaOCl2 Получение Прожарывание естественных минералов Кальция со следующим насыщением хлором В природе существуют минералы Кальция: кальцит CaCO3 (известняк, мел, мрамор) и доломит CaCO3 *MgCO3, прожарыванием которых (t = 1000 C) получают негашеную известь СаО, которая с водой образовывает гашеную известь Ca(OH)2 Свойства Описание. Белый с желтоватым или сероватым оттенком сухой порошок со специфическим запахом хлора. Легко поглощает углекислый газ из воздуха, т.е. выветривается (превращается в камень). Растворимость. Частично растворимый в воде, нерастворимый в спирте. Идентификация 1. Действие на индикаторы Субстанцию растворяют в воде (1:10) и фильтруют. Фильтрат окрашивает лакмус в синий цвет (присутствие луга Са(ВОН)2), а потом обесцвечивает его (присутствие активного хлора Cl2). 2. Взаимодействие с минеральными кислотами При взаимодействии хлорной извести с хлоридною кислотой (HCl) или сульфатной кислотой (H2SO4) выделяется хлор (хлорный распад): CaOCl2 + HCl = CaCl2 + H2O + Cl2; CaOCl2 + H2SO4 = CaSO4 + H2O + Cl2. б) ГФУ. Взаимодействие раствора препарата в ацетатной кислоте с калий гексацианофератом(ІІ) - образуется белый кристаллический осадок аммоний-калий-кальций гексацианоферата(ІІ): Ca2+ + К + + 2NH4+ + [Fe(CN)6]4- →(NH4)2КCa[Fe(CN)6] в) ГФУ, N. Реакция с аммоний оксалатом CaOCl2 + 2СН3СООН→ (СН3СОО)2Ca + Cl2 + H2O; (СН3СОО)2Ca+ (NH4)2C2O4 → CaС2O4 ↓ + 2СН3СООNH4 Ca2+ + C2O42– → CaС2O4↓. г) ГФУ, N. Пирохимическая реакция. Соль Кальция, смоченная кислотой хлоридною Р і внесенная в бесцветное пламя, окрашивает его в оранжево-красный цвет. Са2+ + hν → *Са2+→ Са2+ + hν1. Количественное определение 1. ДФ ІХ. Йодометрія, косвенное титрование (за заместителем) CaOCl2 + 2HCl = CaCl2 + Сl2 + H2O; Cl2 + 2KI = I2 + 2KCl; I2 + 2Na2S2O3 = 2NaI + Na2S4O6. CaOCl2 + 2H+ + 2e CaCl2 + H2O Еm(Cl2) = М. м./2 Применение. Применяют 0,2-0,5 % растворы для дезинфекции помещений, туалетов, неметаллических приборов. Применение хлорная известь обусловлена его способностью под влиянием CO2 выделять хлор Cl2 и атомарный Оксиген, которые обнаруживают антисептическое действие 2CaOCl2 + CO2 = CaCl2 + CaCO3 + Cl2O; Cl2O = Cl2 + O. Поэтому хлорная известь используют как дегазатор для дезинфекции помещений Натрия бромид Natrіі bromіdum SODІUM BROMІDE Natrіum bromatum NaBr Калия бромид Kalіі bromіdum POTASSІUM BROMІDE КBr Kalіum bromatum Обе субстанции содержат не меньше 98,0 % и не больше 100,5 % соответственно NaBr или KBr, в перерасчете на сухие вещества. Получение 1. Обработка железных ошурок бромом: 3Fe + 4Br2 = Fe3Br8 Фактически эта реакция идет в две стадии с образованием феррум (ІІ) бромида и феррум(ІІІ) бромида: Fe + Br2 = FeBr2 2FeBr2 + Br2 = 2FeBr3 Тому FeBr22FeBr3 = Fe3Br8 Полученный раствор ферума(ІІ) бромида и ферума(ІІІ) бромида нагревают с раствором натрий карбоната Na2CO3 или калий карбоната К2CO3: 4H2O + Fe3Br8 + 4Na2CO3 = Fe(OH)2 + 2Fe(OH)3 + 8NaBr + 4CO2 4H2O + Fe3Br8 + 4К2CO3 = Fe(OH)2 + 2Fe(OH)3 + 8КBr + 4CO2 Свойства Описание. ГФУ, доп. 1. Натрия бромид - гранулированный порошок белого цвета или мелкие, бесцветные, прозрачные или матовые кристаллы. Слабо гигроскопический. Калия бромид - кристаллический порошок белого цвета или бесцветные кристаллы. В ГФ Х отмечается, что обе субстанции без запаха, имеют соленый вкус. Растворимость. ГФУ, доп. 1. Натрия бромид - легко растворимый в воде Р, растворимый в 96 % спирте Р. Калия бромид - легко растворимый в воде Р і глицерине Р, мало растворимый в 96 % спирте Р. Идентификация 1. Реакции на Ионы Na+ (см. натрия фторид): а) ГФУ. Взаимодействие с калий гексагидроксостибатом(V); образуется белый осадок. б) ГФУ. Реакция с метоксифенилацетатної кислоты реактивом; образуется белый осадок. в) ГФУ. N. Пирохимическая реакция. Окраска бесцветного пламени улетучивающими солями Натрия в желтый цвет. г) Нефармакопейная реакция. Взаимодействие с раствором цинк уранилацетата; образуется желтый осадок. 2. Реакции на катионы Калия (см. калия хлорид): а) ГФУ. Реакция с тартратной кислотой; образуется белый осадок. б) ГФУ. Реакция с натрий кобальтнитритом; образуется желтый осадок. в) ГФУ, N. Пирохимическая реакция. Окраска бесцветного пламени в фиолетовый цвет 3. Реакции на бромиды-ионы а) ГФУ. Реакция с раствором аргентум нитрата в среде нитратной кислоты KBr + AgNO3 → AgBr↓ + KNO3; Ag+ + Br– = AgBr↓ AgBr↓ + 2NH4OH → [Ag(NH3)2]Br + 2H2O б) ГФУ. Реакция с плюмбум(ІV) оксидом в среде ацетатной кислоты 2KBr + PbО2 + 4CH3COOH = Br2 + Pb(CH3COO)2 + 2CH3COOK + 2H2O PbО2 + 4H+ + 2е Pb2+ + 2Н2О 2Br– – 2е Br2 Бром Br2, что выделился, действует на индикаторную бумагу, пропитанная раствором фуксина обесцвеченного Р і как окислитель восстанавливает снова структуру фуксина: + H2N H2N NH C HCl NHSO3H C SO3H Na2SO3 Cl NH2 NH2 в) ГФУ, N. Взаимодействие с раствором хлорамина в кислой среде и присутствии хлороформа - хлороформный пласт приобретает желто-бурую окраску (Br2): O S O O Na + N Cl 2HCl S O NH2 + Cl2 + NaCl; 2KBr + Cl2 → Br2 + 2KCl 2Br– + Cl2 Br2 + 2Cl– Количественное определение натрий бромида и калий бромида 1. ГФУ, доп. 1, Черных. Тиоцианатометрия NaBr + AgNO3 = AgBr + NaNO3 AgNO3 + NH4SCN = AgSCN + NH4NO3 3NH4SCN + (NH4)Fe(SO4)2 = Fe(SCN)3 + 2(NH4)2SO4 Еm(NaBr) = M. м. 2. Аргентометрия за методом Мора - см. натрия хлорид. Еm(NaBr) = M. м. 3. Аргентометрия за методом Фольгарда, обратное титрование - см. натрия хлорид. Еm(NaBr) = M. м. 5. Меркуриметрия - см. натрия хлорид. Еm(NaBr) = M.м. 6. Йонообменная хроматография Суть метода заключается в том, что определенный объем исследуемого раствора бромида пропускают сквозь колонку с катионитом KatН+ со скоростью 20-25 капель за минуту; промывают водой (50-70 мл) к нейтральной реакции за метиловым оранжевым. Фильтрат и промывные воды собирают в колбу и полученный раствор титруют 0,1 Г раствором NaOH в присутствии метилового оранжевого к переходу окраски от розового до желтого: Kat Н+ + NaBr → Kat Na+ + HBr HBr + NaOH = NaBr + H2O Еm(NaBr) = M. м. Хранение. В воздухонепроницаемом контейнере. В плотно закупоренных стеклянных сосудах желтого цвета, в сухому, защищенному от света месте. Применение. Седативные средства Бромиды - успокоительные средства. Они проявляют способность концентрировать и усиливать процессы торможения в коре главного мозга; могут восстанавливать равновесомую между процессами возбуждения и торможение, особенно при повышенной возбуждаемости ЦНС Бромиды применяют при лечении неврастении, неврозов, истерии, повышенной раздражительности, эпилепсии, хорее и др. Формы выпуска: порошок, таблетки по 0,5 г. Интервал разовых терапевтических доз: натрия бромида 0,0051,0; калия бромида 0,1-1,0. Йод ГФУ, доп. 1 Іodum ІODІNE І2 Химическое название: йод. Йод содержит не меньше 99,5 % и не больше 100,5 % І2. Распространение в природе Йод отдельных покладов не образовывает. Источниками его получения есть морские водоросли - морская капуста Lamіnarіa saccharіna (0,5 %) и Phylophora rubens (0,7-2,0 %), а также буровые воды. Свойства Описание. Пластинки или мелкие кристаллы сероватофиолетового цвета с металлическим блеском. Растворимость. Очень мало растворимый в воде Р, растворимый в 96 % спирте Р, мало растворимый в глицерине Р, очень легко растворимый в концентрированных растворах йодидов. Идентификация 1. Возгонка йода Нагревают несколько пластинок или кристаллов йода в пробирке; выделяются фиолетовые пары и образуется синечерный кристаллический сублимат. 2. Специфическая реакция с крахмалом К насыщенному раствору субстанции прибавляют раствор крахмала Р; появляется синяя окраска**. Полученный раствор нагревают к обесцвечиванию***. Окраски снова появляется при охлаждении. ** образуется адсорбционное соединение: атомы Йода проникают во внутренние каналы макромолекул амилозы крахмала. *** Это объясняется принципом Ле Шателье: поскольку взаимодействие йода с крахмалом является экзотермическим процессом, поэтому при нагревании равновесие смещивается в сторону исходных веществ, т.е. окраска исчезает. Таким образом, чувствительность йодкрахмальной реакции уменьшается с повышением температуры 3. Нефармакопейная реакция. Реакция с натрий тиосульфатом При добавлении раствора натрий тиосульфата Na2S2O3 раствор йода обесцвечивается: I2 + 2Na2S2O3 = 2NaI + Na2S4O6 I2 + 2е 2I– 2S2O32– – 2е S4O62– I2 + 2S2O32– 2I– + S4O62 – 4. Окраска эфирного пласта в фиолетовый цвет Количественное определение 1. Титрование раствором натрий тиосульфата 0,200 г субстанции помещают в колбу, которая содержит 1 г калий йодида KІ и 2 мл воды Р, прибавляют 1 мл кислоты ацетатной разбавленной Р СН3СООН. После растворения к полученному раствору прибавляют 50 мл воды Р і титруют 0,1 Г раствором натрий тиосульфата Na2S2O3, используя как индикатор раствор крахмала Р (крахмал прибавляют под конец титрования и титруют к обесцвечиванию раствора). I2 + 2Na2S2O3 = 2NaI + Na2S4O6 I2 + 2е 2I– 2S2O32– – 2е S4O62– I2 + 2S2O32– 2I– + S4O62– Em(I2) = M. м./2 = А. м.; Em(Na2S2O3) = M. м.; k(Na2S2O3) = 1 Хранение. Список сильнодействующих веществ. В стеклянных банках с притертыми пробками, в прохладному, защищенному от света месте. Применение. Противомикробное действие. Антисептическое средство Йод - важный микроэлемент; вбирается щитовидной железой, принимает участие в синтезе тироксина; коагулирует белки; адсорбированная часть йода проникает у ткани и органы. При недостатке Йода в организме удручается функция щитовидной железы. Малые дозы Йода используются для лечения больных с гиперфункцией щитовидной железы. Применяют внешне в хирургической практике как антисептик для подготовки операционного поля, обеззараживание ран. Спасибо за внимание !