Требования к радиофармпрепаратам.
реклама

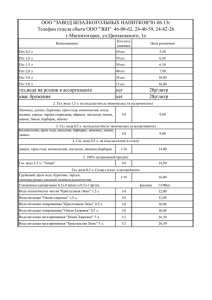
Прикладные аспекты радиационной биофизики 1. 2. 3. Радионуклидная диагностика. Использование радиофармпрепаратов. Использование позитронной эмиссионной томографии (ПЭТ) в медицине. Использование ионизирующего излучения в сельском хозяйстве и пищевой промышленности. Использование радиофармпрепаратов в диагностике Радиофармпрепараты (РФП) – это комплексные химические соединения, содержащие радионуклид, фармакокинетика которых в организме животного или человека позволяет решить конкретную диагностическую задачу. Требования к радиофармпрепаратам. • Обладать высокой специфичностью к поглощению, фиксации, участию в биохимических или физиологических процессах в критическом органе. • Поглощаться из крови критическим органом с высокой степенью экстракции, чтобы получалось максимальное отношение активностей орган/фон. • Препараты должны быстро и в максимальных количествах поглощаться исследуемым органом и не перераспределяться в течение времени, необходимого для получения должного объема диагностической информации. • Препараты должны создавать минимальные лучевые нагрузки. • РФП должен быть недорогим и доступным. Самый оптимальный вариант – это получение радионуклидов на ускорителях прямо в медицинских учреждениях по мере необходимости их использования в диагностике и терапии. Позитронно-эмиссионная томография Позитрон после эмиссии из ядра атома проходит в окружающих тканях расстояние, равное 1-3 мм, теряя энергию при соударении с другими молекулами. В момент остановки позитрон соединяется с электроном и масса обеих частиц превращается в энергию в виде двух высокоэнергетических гамма-квантов, разлетающихся в противоположные стороны. Этот процесс называется аннигиляцией. В позитронноэмиссионном томографе происходит регистрация этих гамма-квантов с помощью нескольких колец детекторов, окружающих пациента. Основные этапы ПЭТ • Эмиссия позитрона из ядра атома Позитрон представляет собой положительно заряженную частицу, по массе равную электрону. После эмиссии из ядра атома позитрон проходит в окружающих тканях расстояние, равное 1-3 мм, теряя энергию при соударении с другими молекулами. • Аннигиляция В момент остановки позитрон соединяется с электроном и масса обеих частиц превращается в энергию в виде двух высокоэнергетических гамма-квантов, разлетающихся в противоположные стороны. Этот процесс называется аннигиляцией. • Регистрация гамма-квантов. Формирование линии ответа. В позитронно-эмиссионном томографе происходит регистрация этих гамма-квантов с помощью нескольких колец детекторов, окружающих пациента. При помощи блока совпадений, томограф выделяет только те гамма-кванты, которые зарегистрированы одновременно, формируя так называемую «линию ответа». • Реконструкция изображения. Затем ПЭТ- система суммирует все линии ответа от пар детекторов, зарегистрированные за время записи и реконструирует изображение по определенному алгоритму, сходному с используемыми в КТ, МРТ и ОЭКТ. Фармпрепараты для ПЭТ В ПЭТ применяют изотопы химических элементов, представленных в живых биологических системах в большом количестве. Чаще всего для мечения РФП при ПЭТ используют углерод, азот, кислород и фтор, которые могут замещать стабильные изотопы, имеющиеся в норме в биологических молекулах, и при этом не изменять физиологических характеристик этих молекул. Изотопы, испускающие позитроны, обычно обладают настолько высокой удельной радиоактивностью, что для получения интересующей информации, как правило, бывает достаточно очень незначительного количества РФП. Относительно короткий период полураспада изотопов, используемых в ПЭТ, способствует снижению дозы облучения и позволяет проводить повторные исследования через короткие промежутки времени. Например: 13N-аммоний - для количественной оценки миокардиального кровотока; 18F-фтордезоксиглюкоза (18F-ФДГ) - для исследования скорости утилизации экзогенной глюкозы; 11С-жирные кислоты и 11С-ацетат - для изучения скорости окислительного метаболизма в миокарде. Физические характеристики основных позитрон испускающих изотопов Изотоп Период полураспада (мин) Длина пробега (мм) 11С 20,4 4,1 13N 9,96 5,4 15O 2,07 8,2 18F 109,8 2,4 Применение позитронной эмиссионной томографии в кардиологии. Рис. 1. Пациент с афункциональным участком миокарда в базальном отделе боковой стенки. Слева: данные ПЭТ с меченой жирной кислотой - 11С-бутират натрия. Резко выраженное снижение перфузии (зона гипоперфузии указана стрелкой). В центре: 11С-бутират натрия. Отсутствие окислительного метаболизма (аметаболическая зона указана стрелкой). Справа: при исследовании с 18F-ФДГ наблюдался сохраненный метаболизм глюкозы, что свидетельствует о жизнеспособности миокарда этого региона за счет процессов гликолиза (гибернирующий миокард). Сохраненный метаболизм глюкозы (зона указана стрелкой). Позитронная эмиссионная томография при злокачественной шванноме мозжечка. Рис. 2. Очаг повышенного накопления 18F-ФДГ у пациента со злокачественной шванномой в левом полушарии мозжечка. Опухоль указана стрелкой (слева). В послеоперационном периоде в левом полушарии мозжечка определяется зона гипометаболизма глюкозы, что свидетельствует о радикальном удалении опухоли. Послеоперационная зона указана стрелкой (справа). Количественная оценка физиологических параметров методом ПЭТ Метод ПЭТ позволяет количественно оценить основные параметры мозгового кровообращения и метаболизма: Мозговое кровообращение (МК, мл/100 г в 1 мин); Объем крови, циркулирующей в сосудах мозга (ОКМ, мл/100 г); фракция извлечения кислорода (ФИК) из притекающей артериальной крови; уровень обмена кислорода (УОК, мл/100 г в 1 мин); уровень обмена глюкозы (УОГ, мл/100 г в 1 мин). Одновременная количественная оценка МК и ОКМ позволяет рассчитать их соотношение, которое изменяется пропорционально церебральному перфузионному давлению и может служить индексом так называемого гемодинамического резерва, то есть способности резистивных мозговых сосудов расширяться в ответ на снижение церебрального перфузионного давления, как это бывает при стенозах или окклюзиях магистральных артерий головного мозга. Схема практического использования ионизирующего излучения в зависимости от дозы. 105 Обезвреживание отходов с.х. Уничтожение салмонеллы Методы борьбы с насекомыми вредителями с. х. Инактивация ферментов Лучевое консервирование 104 Увеличение сроков хранения пищевых продуктов 103 Уничтожение гельминтов в мясе Получение полезных мутаций с.х. растений 102 Стимуляция роста и развития семян растений 10 1 Гр Задержка прорастания картофеля, лука и др. Денситограмма общих растворимых белков мяса птицы, разделенных на полиакриламидном геле с додецилсульфатом натрия А Б Атомная масса, тыс. А-контроль, Б-облучение в дозе 10 кГр 1-тяжелые фракции миозина, 2--актины и -фосфорилаза, 3-актин, 4-тропомиозин, 5-легкие фракции миозина Основные параметры ускорителей МОДЕЛЬ ПАРАМЕТРЫ УЭЛР-10-10С УЭЛВ-8-5С УЭЛВ-3-2.5С УЭЛР-3-1С ИСТОЧНИК СВЧ-ЭНЕРГИИ Клистрон Магнетрон Клистрон Магнетрон ЭНЕРГИЯ УСКОРЕННЫХ ЭЛЕКТРОНОВ, МэВ 10 8 3 3 СРЕДНЯЯ МОЩНОСТЬ ПУЧКА, кВт 10 5 2.5 1 СРЕДНИЙ ТОК ЭЛЕКТРОННОГО ПУЧКА, мА 1 0.625 0.833 0.333 ЧАСТОТА ПОВТОРЕНИЯ ИМПУЛЬСОВ, Гц 300 500 360 300 ДЛИТЕЛЬНОСТЬ ИМПУЛЬСОВ, мкс 16 3 8.5 4.5 РАЗМЕР ПОЛЯ ОБЛУЧЕНИЯ НА ФОЛЬГЕ ВЫПУСКНОГО ОКНА, мм 500 Х 20 500 Х 10 350 Х 20 550 Х Стерилизаторы на базе линейных ускорителей электронов УЭЛВ-3-2,5С, УЭЛР-3-1С На базе ускорителя УЭЛВ-3-2.5 создана установка с индивидуальной радиационной защитой для стерилизации пучком электронов продуктов питания и почтовой корреспонденции. Стерилизуемое изделие помещается в специальную кассету, которая устанавливается оператором в устройство перемещения, расположенное в камере облучения. Устройство позволяет осуществлять как одностороннее, так и двухстороннее облучение изделия На базе ускорителя УЭЛР-3-1С с индивидуальной радиационной защитой создан компактный медицинский электронно-лучевой стерилизатор ЭЛС-900, предназначенный для радиационной стерилизации медицинских изделий повседневного пользования непосредственно в медицинских учреждениях, а также для обеззараживания отходов инфекционных больниц перед их утилизацией.