Магний
реклама

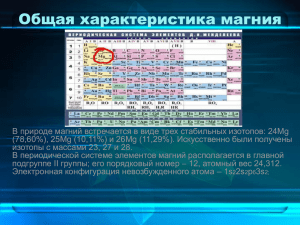
Магний (лат. Magnesium), Mg, химический элемент, расположенный в 3 периоде II группе главной подгруппе периодической системы Менделеева Электронная конфигурация невозбужденного атома – 1s22s22p63s2 Валентные электроны наружного слоя определяют валентность и объясняют типичные характер восстановительных реакций, в которые вступает магний Строение внешних электронных оболочек атома Mg (3s2) соответствует его нульвалентному состоянию (Mg0); обычное возбужденное состояние атома – 3s3p (Mg2+) Природный магний состоит из трех природных изотопов 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%) Магний входит в состав кристаллических горных пород Большое количество магния содержится в водах морей и океанов Магний в пресной воде, обусловливает, наряду с кальцием, ее жесткость Магний всегда содержится в растениях, так как входит в состав хлорофиллов Доломит MgCa(CO3)2 Магнезит MgCO3 Эпсомит MgSO4·7H2O Карналлит K2MgCl4·6H2O Лангбейнит K2Mg2(SO4)3 Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается оксидной пленкой, придающей ему матовый цвет Mg активно реагирует с большинством неметаллов, особенно при нагревании 2Mg(к) + O2(г) = 2MgO(к); DG° = –1128 кДж/моль 3Mg(к) + N2(т) = Mg3N2(к); DG° = –401 кДж/моль (воспламеняется в присутствии галогенов и влаги) При действии водорода под давлением 200 атм при 150° С магний образует гидрид MgH2 Mg + 2H2O = Mg(OH)2 + H2 (с кипящей водой) Магний разрушается под действием горячего концентрированного раствора хлорида аммония Mg + 2NH4Cl = MgCl2 + 2NH3– + H2 При действии водяного пара продуктами являются оксид или гидроксид магния и водород Магний легко реагирует с кислотами, давая соответствующие соли: Mg0 + 2HCl=MgCl2+H2 Окси́д ма́гния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO, бесцветные кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен Оксид магния получают обжигом минералов магнезита и доломита: MgCO3=MgO+CO2 Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2: MgO+2HCl=MgCl2+H2O MgO+H2O=Mg(OH)2 Разложение при нагревании до 350 °C: Mg(OH)2=MgO+H2O Взаимодействие с кислотами с образованием(реакция нейтрализации) соли и воды : Mg(OH)2+2HCl=MgCl2+H2O Mg(OH)2+H2SO4=MgSO4+H2O Взаимодействие с кислотными оксидами с образованием соли и воды: Mg(OH)2+SO3=MgSO4+H2O Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов: M(OH)2+NaOH=Na2[Mg(OH)4] Mg(OH)2+Sr(OH)2=Sr[Mg(OH)4] Большинство солей Магния хорошо растворимо в воде, например сульфат магния 2MgSO4 + 2H2O = (MgOH)2SO4 + H2SO4 мало растворимы MgF2, MgCО3, Mg3(PO4)2 и некоторые двойные соли. MgSO4+H2O=MgO+H2SO4 Комплексные соединения магния малоустойчивы и образуются обычно только в щелочной среде Реакции с металлами MgCl2+Cu=CuCl2+Mg Реакции с другими солями CuSO4 + MgCl2 = CuCl2 + MgSO4 С кислотами MgSiO3 + HNO3 = Mg(NO3)2 + H2SiO3 MgSO4 + H2SO4 = Mg(HSO4)2 С кислотными оксидами MgSO4 + SiO2 = MgSiO3 + SO3 Магний - постоянная часть растительных и животных организмов (в тысячных - сотых долях процента) Магний входит в состав зеленого пигмента растений – хлорофилла Магний активирует многие ферменты, вместе с кальцием и марганцем обеспечивает стабильность структуры хромосом и коллоидных систем в растениях, участвует в поддержании тургорного давления в клетках Магний стимулирует поступление фосфора из почвы и его усвоение растениями Соли магния обладают сосудорасширяющим эффектом Содержание кальциевых и магниевых солей в природной воде обозначает ее жесткость Магний (Mg): - микроэлемент - не является органогеном - биогенный элемент - магний – «металл жизни» (все энергетические процессы в организме идут при его участии, магний защищает нервную систему от стрессов) Оксид магния широко используется как жаростойкий материал Mg(OH)2 используют для получения оксида магния, рафинирования сахара, очистки воды в котельных установках, в качестве компонента зубных паст Рыхлый порошок карбоната магния засыпают между двойными стенками хранилищ для жидкого кислорода (теплоизоляция) Сульфат магния применяют в текстильной и бумажной промышленности Нитрат магния входит в состав сложных удобрений Фторид магния входит в состав стекол, керамики, эмалей, катализаторов, смесей для получения искусственной слюды и асбеста