Что такое ОВР и что такое РИО?
реклама
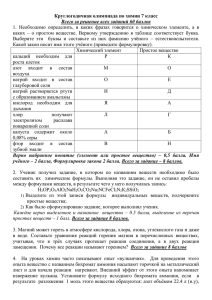
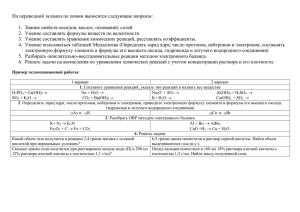
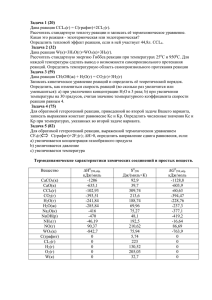
Выполнила: ученица 11 М класса лицея №6 Багрова Юлия. Учитель: Дробот Светлана Сергеевна Цель работы: Дать определения окислительновосстановительных реакций и реакций ионного обмена и найти различия между ними. Что такое ОВР? История открытия окислительно-востановительных реакций Что такое РИО? Алгоритм составления ионных уравнений Типы ионообменных реакций Роль окислительно-восстановительных реакций Вывод Список используемой литературы Окислитель, как отъявленный злодей, Как пират, бандит, агрессор, Бармалей, Отнимает электроны - и OK! Потерпев урон, восстановитель Восклицает: "Вот я! Помогите! Электроны мне мои верните!" Но никто ему не помогает И тем более ущерб не возмещает. Окислительно-восстановительные реакции - (реакции окисления-восстановления), химические реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Первоначально окислением назывались только реакции веществ с O2, а восстановлением — реакции, в результате которых вещество теряло атом кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций распространилось и на реакции без участия кислорода. Окислением называется процесс отдачи атомом, молекулой или ионом электронов. Степень окисления при этом повышается. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается. В давние времена, когда люди не знали химии, они не могли написать уравнение реакции растворения жемчужины в виноградном уксусе: CaCO3 + 2CH3COOH = Ca(CH3COO)2 + H2O + CO2 или даже более простой реакции сгорания алмаза на воздухе под действием солнечных лучей: C + O2 = CO2 И тем более никто не смог бы разъяснить, что вторая реакция намного сложнее первой: ведь при ней происходит перемещение электронов от одного атома к другому, а значит, она относится к окислительно-восстановительным реакциям. В XVII в. Считали, что окисление – потеря флогистона (особого невидимого горючего вещества), а восстановление – его приобретение. Но после создания А. Лавуазье кислородной теории горения к началу XIX века химики всего мира согласились считать окислением соединения веществ с кислородом, а восстановлением их превращения под действием водорода. Но вот простейшая реакция железа с соляной кислотой: Fe + 2HCI = FeCI2 + H2 Здесь нет кислорода, и тем не менее железо окисляется. В этой реакции окислитель - ион водорода – протон Н+, а железо выступает в роли восстановителя. Разобраться в этом удалось лишь с введением в химию электронных представлений. Теперь мы точно знаем, что окислитель – вещество, которое получает электроны, а восстановитель – вещество, которое их отдает. (реакции ионного обмена) Реакции между растворами электролитов протекают полностью и до конца, если в ходе реакции происходит удаление ионов из раствора. Это возможно если при реакции образуется малорастворимое вещество, газообразное вещество или малодиссоциирующее вещество (молекула слабого электролита). В ходе реакции вещества «обмениваются» между собой ионами, поэтому эти реакции называют еще реакциями ионного обмена, а уравнения этих реакций – ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер. При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак , стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак обозначает, что это вещество удаляется из сферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные, записываются в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. С участием ионов могут протекать как обменные, так и окислительновосставновительные реакции. Рассмотрим обменные реакции электролитов в растворе, например, взаимодействие между двумя солями: NaCl + AgNO3 = AgCl + NaNO3 Хлорид натрия и нитрат серебра как сильные электролиты диссоциируют на ионы: NaCl Na+ + ClAgNO3 Ag+ + NO3Поэтому левую часть равенства можно записать так: Na+ + Cl- + Ag+ + NO3- = . . . Рассмотрим полученные в результате реакции вещества: AgCl – вещество нерастворимое, потому его диссоциацию на ионы не показывают, а вещество NaNO3 – соль растворимая, прекрасно диссоциирует на ионы по схеме: NaNO3 = Na+ + NO3NaNO3 - сильный электролит, поэтому правая часть равенства пишется так: . . . = Na+ + NO3- + AgCl Уравнение в целом виде будет иметь такой вид: Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl Такое уравнение называется полным ионным уравнением. Приведя в этом уравнении подобные члены, исключаем ионы, не участвующие в реакции, и получаем сокращенное ионное уравнение: Ag+ + Cl- = AgCl Напишите уравнение реакции между раствором сульфата алюминия и хлоридом бария в молекулярном, полном ионном и сокращенном ионном виде. 1.Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO 4 2.2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 2Al3+ + 6Cl- + 3BaSO 4 3. 2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 2Al3+ + 6Cl- + 3BaSO 4 4.3SO42- + 3Ba2+ = 3BaSO 4 5. Вывод. В реакции участвовали сульфат-анионы и катионы бария, в результате чего образовался нерастворимый сульфат бария. 1 Напишите уравнение реакции в молекулярной форме. (В уравнениях необратимых реакций стрелками укажите выпадение осадков, выделение газов). 2 Запишите ионы диссоциирующих веществ, указав их число и заряды. 3 Подчеркните одинаковые ионы (они не приняли участия в реакции) в левой и правой частях уравнения реакции. 4 5 Запишите сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции). Сформулируйте вывод на основе сокращенного ионного уравнения. Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными. Многочисленные ионообменные реакции в растворах электролитов, которые протекают необратимо (слева направо), можно разбить на четыре типа: 1.Реакции с образованием осадков, например: FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3+ 3Na+ + 3Cl Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3+ 3Na+ + 3Cl – Fe3+ + 3OH- = Fe(OH)3 2.Реакции с образованием газообразных малорастворимых веществ, например: Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O 2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + CO2+ H2O 2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + CO2+ H2O CO32- + 2H+ = CO2+ H2O 3.Реакции с образованием малодиссоциирующих веществ (слабых электролитов), например: HCl + KOH = KCl + H2O H+ + Cl- + K+ + OH- = K+ + Cl- + H2O H+ + Cl- + K+ + OH- = K+ + Cl- + H2O H+ + OH- = H2O 4.Реакции с образованием комплексных соединений (ионов). Такова реакция сульфата меди(II) с аммиаком: CuSO4· 5H2O + 4NH3 = [Cu(NH3)4]SO4 + 5H2O [Cu(H2O)4]2+ + SO42- + H2O + 4NH3 = [Cu(NH3)4]2+ + SO42- + 5H2O [Cu(H2O)4]2+ + SO42- + H2O + 4NH3 = [Cu(NH3)4]2+ + SO42- + 5H2O [Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + H2O Окислительно-восстановительные реакции чрезвычайно распространены. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов. С ними связаны, например, процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. С их помощью получают щелочи, кислоты и многие другие ценные продукты. Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Вывод: Значительная часть химических реакций, с которыми до сих пор нам приходилось встречаться, была так называемого обменного типа, т. е. сложные вещества в процессе реакции обменивались своими составными частями. Например: AgNO3 + NaCI = AgCI + NaNO3 или в ионной форме: Ag+ + CI- = AgCI В таких реакциях степень окисления элементов не меняется. Это и является главным отличием окислительно-восстановительных реакций от реакций ионного обмена. 1. М. А. Прокофьева. Энциклопедический словарь юного химика М.:«Педагогика», 1987. 2. Р.А. Лидин Справочник школьника.М.:«АСТ-ПРЕСС», 2001. 3. Г.М. Крючкова. Неорганическая химия.М.:«Медицина», 1972. 4. Большая энциклопедия Кирилла и Мефодия www.KM.ru