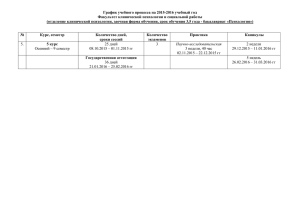
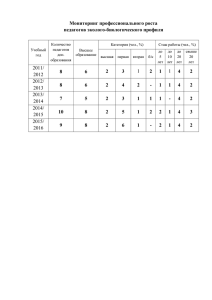
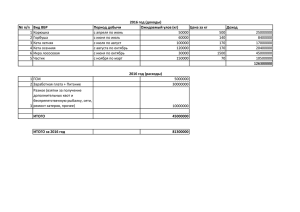
«ФИЗИЧЕСКАЯ ХИМИЯ" Коробов Михаил Валерьевич
реклама

«ФИЗИЧЕСКАЯ ХИМИЯ" Коробов Михаил Валерьевич mkorobov49@gmail.com Математика Квантовая механика Классическая физика Физическая химия: Химическая термодинамика (I) Статистическая термодинамика (I) Химическая кинетика (II) Электрохимия (II) Неорганическа я химия Аналитика Энзимология 06.05.2016 Любая область химии Органическая химия 2 Что могут химические термодинамика и кинетика? N2, H2 NH3, Количество, Т, p побочные продукты • Какие продукты образуются? Сколько? Сколько теплоты при этом выделится? • Как быстро пойдет реакция? (Термодинамика) (Кинетика) • Оптимальные температуры и давления! 06.05.2016 3 Три закона (начала) термодинамики 06.05.2016 4 Система Термодинамическая система (или просто система) – часть пространства, которая составляет предмет исследований химической термодинамики. Система должна иметь реальную (или виртуальную) границу и содержать большое число молекул. То, что находится вне системы, называется окружающей средой. 06.05.2016 5 Мир = Система + окружающая среда Среда Среда Система Среда Среда 06.05.2016 6 Что здесь не система ?? 1. Бак с плотно закрытой крышкой. Внутри – жидкая вода. 2. Человек. 3. Бак с плотно закрытой крышкой. Внутри - десять атомов гелия. 4. Бак с плотно закрытой крышкой. Внутри - воздух и 56 граммов железа. 06.05.2016 7 Какие бывают системы ? Система называется закрытой, если между ней и окружающей средой возможны все типы взаимодействий, кроме обмена веществом. Примером закрытой системы является баллон с газом и т.д. Открытой называют систему, которая может обмениваться с окружающей средой и веществом, и энергией. Примером открытой системы является человеческий организм. 06.05.2016 8 Системы бывают… Изолированными (не могут обмениваться веществом и энергией со средой). Закрытыми, с постоянными T и V Закрытыми, с постоянными T и p ……………………….. 06.05.2016 9 Параметры системы Состояние системы определяется набором макроскопических физических параметров . 06.05.2016 10 Что здесь не параметр? • • • • Температура T, объем V, давление p Размер атомов Масса системы M, n = M/m Энергия системы, U Всего параметров: к +2 К – число веществ, входящих в систему 06.05.2016 11 Параметры связаны друг с другом ! У системы есть «уравнение состояния» • Идеальные (разреженные) газы: nRT дж V ; R 8,314 p моль градус • Твердые и жидкие вещества V не завист от p; V nT Всего параметров: к +2 06.05.2016 12 Мы познакомились с понятиями: • Среда • Система • Параметры системы 06.05.2016 13 Законы термодинамики – это… • Аксиомы, основанные на опытных данных. • Их можно опровергнуть одним контрпримером, но таких пока нет. Пример обычного физического закона: V = nRT/p 06.05.2016 14 Первый закон термодинамики. У каждой системы есть функция состояния, называемая внутренней энергией, U. dU = (Q) + (А) + (Z) (1). Он может быть сформулирован так: в любом процессе в системе изменение внутренней энергии (±dU) происходит за счет теплоты, сообщенной системе (±Q), работы (±А), совершенной системой и добавки вещества (±Z). Изменение U в уравнением (2). закрытой системе dU = (Q) + (А) 06.05.2016 определяется (2). 15 Работа Работа А – форма передачи энергии. Форма взаимодействием системы с окружающей средой. Работа = сила • перемещение 06.05.2016 16 Механическая работа, δА S dx, (dV=Sdx) F, (p =F/S) F А Fdx Sdx pdV S 06.05.2016 17 Как считать работу? Рвнут V Рвнеш A pвнешdV A pdV 06.05.2016 18 Как считать работу? A pвнешdV V2 A pвнеш dV V1 A pвнеш V2 V1 A p V2 V1 06.05.2016 19 Теплота Теплота Q – другая форма передачи энергии. Форма взаимодействия системы с окружающей средой. Теплообмен! Теплота = теплоемкость • изменение температуры 06.05.2016 20 Доска Как считать (измерять) теплоту? Q сx dT T2 Q сх dT T1 06.05.2016 Qp сх T2 T1 21 Энергия Внутренняя энергия, U – общий запас энергии системы. Он включает все виды энергии движения и взаимодействия частиц, составляющих систему: атомов, ядер, молекул, электронов. Но в нее не входит кинетическая энергия системы в целом и потенциальная энергия в поле внешних сил. 06.05.2016 22 Функция состояния, U Её особенность: изменение внутренней энергии U, зависит только от параметров конечного и начального состояния и не зависит от пути проведения процесса. Поэтому внутреннюю энергию U называют функцией состояния. U(2)-U(1) = Q+A 06.05.2016 23 Внутренняя энергия – функция состояния U(n,T1p1,) U (2), Q(2), А(2) U (1), Q(1), А(1) U(n,T2p2) Q(1) Q(2), А(1) А(2) U (T2 p2 ) U (T1, p1 ) U (1) U (2) = Q+A 06.05.2016 24 Как считать внутреннюю энергию ? • Только по первому закону !! • Только изменение внутренней энергии, а не её абсолютное значение !! 06.05.2016 dU = (Q) + (А) + (Z) (1). dU = (Q) + (А) (2). 25 Как cчитать изменение внутренней энергии? dU = (Q) + (А) + (Z) (открытая система) dU = (Q) + (А) dU = 0 06.05.2016 (закрытая система) (изолированная система) 26 Как cчитать изменение внутренней энергии? dU = (Q) – pвнеш dV dU = (Q) – pdV (закрытая) (закрытая, pвнеш = р) dU = (cрdT) – pdV (закрытая, pвнеш = р, с = cр) 06.05.2016 27 Как cчитать изменение внутренней энергии? 2 2 1 1 U U (2) U (1) Q A Q A 2 2 1 1 U U (2) U (1) сх dT pвнеш dV U U (2) U (1) с p (T2 T1 ) p(V2 V1 ) 06.05.2016 28 Закон сохранения энергии ? δQ =0 CH4 + O2 900 kJ δА =0 ΔU=? 06.05.2016 dU = (Q) + (А) 29 Закон эквивалентности теплоты и работы ? A mgL cT Q ΔT Q, 1 кал L A, 427 г*м 06.05.2016 30 В чем разница между теплотой и работой ? 8 А 5 U=13 3 6 3 2 2 Q 6 1 3 U=8 U=13 2 1 06.05.2016 31 Первый закон термодинамики: • Вводит понятие внутренняя энергия, U, и позволяет рассчитать (измерить ?) изменение U в различных процессах. • Это - закон сохранения энергии. • Это – закон эквивалентности теплоты и работы 06.05.2016 32 Что можно рассчитать с помощью Первого закона ? Изменения внутренней энергии при • химической реакции • плавлении • испарении • растворении • …………любом процессе! U U (2) U (1) Q A 06.05.2016 33 Что можно рассчитать с помощью Первого закона ? Теплоты процессов: • нагревания • химической реакции • плавления • испарения • растворения • …………любого процесса! Теплоты зависят от пути процессов ??? 06.05.2016 34 Как посчитать теплоту нагревания ? Т2 ΔU = ΔU Т1 06.05.2016 Q = Q ?? 35 Внутренняя энергия – функция состояния U(T1p1) U (1), Q(1), А(1) U(T2p2) U (2), Q(2), А(2) Q(1) Q(2), А(1) А(2) U (T2 p2 ) U (T1, p1 ) U (1) U (2) 06.05.2016 36 Система переходит из состояния «1» в состояние «2»… Теплота всех процессов при постоянном объеме одинакова U QV ; V const Теплота всех процессов при постоянном давлении одинакова H Q p ; p const 06.05.2016 Закон Гесса 37 В двух случаях теплота точно определена… Объем системы в ходе процесса постоянен dU Q pвнеш dV Q V const U U (2) U (1) QV Давление в системе в ходе процесса постоянно dU Q pвнеш dV ; pвнеш p const U p(V (2) V (1)) Q p H H U pV ; H U pV 06.05.2016 38 Доска Как считать (измерять) теплоту? Теплота нагревания сухого воздуха 10 г, 30 до 100 С, объем постоянен QV сV T2 T1 1* 70 *10 700дж дж сv 1 г * град 100 QV 06.05.2016 с dT V 30 39 Первый и Второй законы. dU = (Q) + (А) (1). У каждой системы есть функция состояния, называемая внутренней энергией, U. Изменение U в закрытой системе определяется уравнением (1). dS = (Q)/ T + dSi (2). У каждой системы есть функция состояния, называемая ЭНТРОПИЕЙ, S. Изменение S в закрытой системе определяется уравнением (2). 06.05.2016 40 Второй закон: равновесные и самопроизвольные процессы В равновесном процессе dS = (Q)/ T В самопроизвольном процессе dS = (Q)/ T + dSi dSi >0, производство энтропии! 06.05.2016 41 Равновесное и самопроизвольное расширение газа pвнут = pвнеш = p T = const pвнут > pвнеш = p2 06.05.2016 42 Самопроизвольный процесс: перенос тепла от более нагретой к менее нагретой части системы δQ = 0 T1> T2 Q Si 06.05.2016 Q Q T2 Q T1 0 δQ = 0 dS Q T 43 Примеры самопроизвольных процессов • • • • • Выравнивание температуры Выравнивание плотности Выравнивание концентраций Протекание химической реакции Растворение, плавление, испарение dSi > 0 06.05.2016 44 Примеры равновесных процессов • Медленное расширение газа (pвнут= pвнут) • Медленное нагревание (Т1= Т2) Квазистатические процессы. dSi = 0 06.05.2016 45 Как измерить изменение энтропии ? dS Q T (dS ) p c p dT T 2 S S (2) S (1) 1 06.05.2016 Q T 46 Что такое энтропия ? U,V = const, ΔSi >0 6 4 6 2 3 2 3 2 1 1 1 3 1 2 3 4 S = k lnW = 0 06.05.2016 S = k lnW = k ln 24 ! 47 Из математики: Если дифференциал функции (dS) >0, то такая функция S возрастет. • • Если дифференциал функции (dS) < 0, то такая функция S убывает. • Если дифференциал функции (dS) = 0, то такая функция S достигла максимума или минимума или она константа. 06.05.2016 48 Второй закон в системах с постоянными U и V S U,V - const dS U ,V Q T 0 dSi 0 Равновесие dS U ,V 0 dSi Q dU pвнешdV 0 Энтропия вселенной возрастает! 06.05.2016 49 Второй закон в системах с S,V – const. U S,V - const Q dS 0 dSi ; T dSi 0; dU S ,V Q 0 dU S ,V 0 Равновесие Q 0 dU=Q-pdV=Q<0 06.05.2016 50 Второй закон термодинамики: • Вводит понятие энтропии, S, и позволяет рассчитать её изменение в различных равновесных процессах • Делит все процессы на равновесные и самопроизвольные • Позволяет находить состояние равновесия систем. 06.05.2016 51 Третий закон термодинамики Энтропия системы при абсолютном нуле температуры (энтропия идеального кристалла) равна нулю. Третий закон (вместе со Вторым законом) позволяет рассчитывать абсолютную энтропию системы! 06.05.2016 52 Расчет абсолютной энтропии T2 S (T2 ) S (T1 ) T1 Q T T2 S (T2 ) S (T1 0) S (T2 ) 0 06.05.2016 Q T 53 Сегодня мы обсуждали: • Первый, Второй, Третий законы термодинамики • Понятия система, параметры системы, работа, теплота, внутренняя энергия, функция состояния, энтропия; производство энтропии, самопроизвольный и равновесный процессы 06.05.2016 54 Что можно почитать? http://korobov.professorjournal.ru Конспект лекций (Весенний семестр). Лекции 1,2 и 4. П. Эткинс, Дж. Де Паула «Физическая химия». 1, 2007. гл. 2, 3, 4. 06.05.2016 55 Задача 1 Первый закон термодинамики для закрытой системы, где объем не изменяется, имеет вид 1. dU Q pdV 2. dU Q pвнеш dV 3. dU Q 4. dU 0 06.05.2016 56 Задача 2 1. 2. 3. 4. Система, которая может обмениваться веществом с окружающей средой, называется открытой закрытой равновесной изолированной 06.05.2016 57 Задача 3 1. 2. 3. 4. В системе происходит самопроизвольный процесс. Энтропия системы при этом должна расти может расти, а может падать не меняется должна падать 06.05.2016 58 Задача 4 Система расширяется при постоянном внешнем давлении от объема V(1) до V(2). Работа расширения равна 1. 2. 3. 4. нулю p (V(2)-V(1)) -p (V(2)-V(1)) -pвнеш (V(2)-V(1)) 06.05.2016 59 Задача 5 Любой самопроизвольный процесс сопровождается 1. ростом энтропии системы 2. ростом внутренней энергии системы 3. падением внутренней энергии системы 4. производством энтропии 06.05.2016 60 Задача 6 1. 2. 3. 4. Систему нагрели от температуры Т(1) до температуры T(2). Теплота, полученная системой, равна ΔН ΔU Ср (Т(2)-T(1) нельзя посчитать, нужно знать еще и совершенную системой работу 06.05.2016 61 Задача 7 Говорят, что увеличение энтропии есть увеличение хаоса. Какой из процессов ведет к увеличению энтропии? 1. замерзание воды 2. плавление железа 3. сжатие газа 4. конденсация пара 06.05.2016 62 Задача 8 В изолированной системе может 1. 2. 3. 4. расти внутренняя энергия расти энтропия падать энтропия падать внутренняя энергия 06.05.2016 63 Задача 9 1. 2. 3. 4. Внутренняя энергия системы увеличилась на 100 кДж. Чему равна сумма полученной теплоты и совершенной работы ? 100 кДж -100 кДж 0 Неизвестно! 06.05.2016 64 Задача 10. Моль идеального газа нагрели на 10 градусов при постоянном давлении. При этом он расширился и совершил работу. Теплоемкость газа равна 5/2 R. R=8.314 Дж/моль/град. На сколько изменилась внутренняя энергия газа? 1. 100 Дж/моль 3. -524 Дж/моль 2. 1340 Дж/моль 4. 124,7 Дж,моль 06.05.2016 65