Морфогенез кремнистой створки у пеннатной диатомовой
реклама
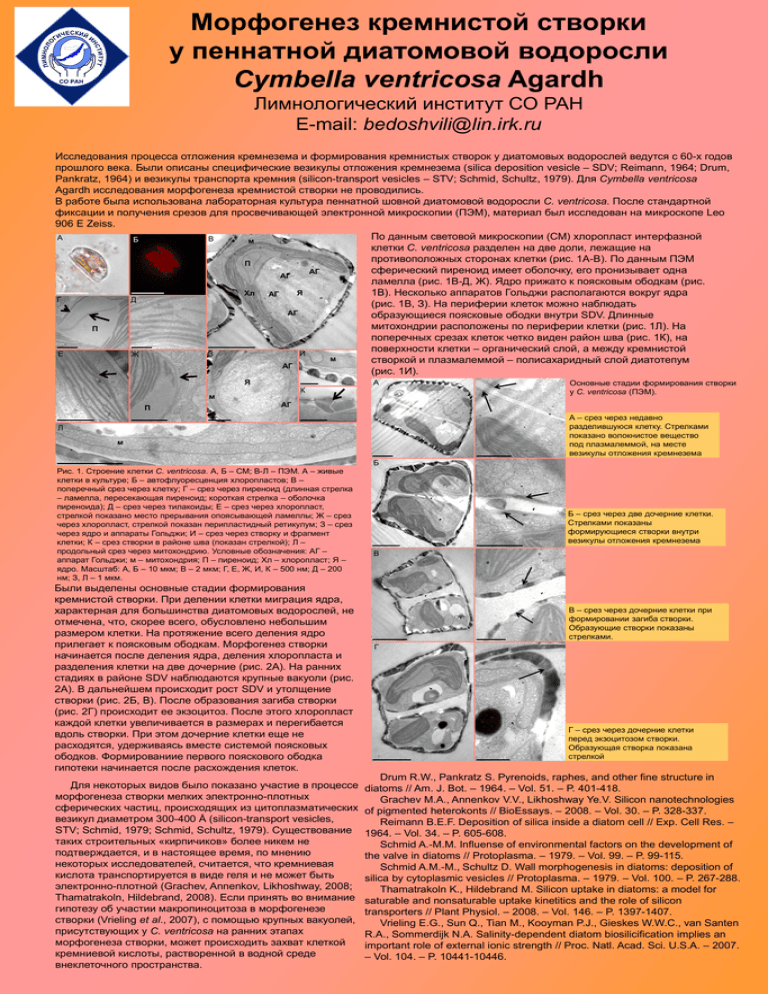
Морфогенез кремнистой створки у пеннатной диатомовой водоросли Cymbella ventricosa Agardh Лимнологический институт СО РАН E-mail: bedoshvili@lin.irk.ru Исследования процесса отложения кремнезема и формирования кремнистых створок у диатомовых водорослей ведутся с 60-х годов прошлого века. Были описаны специфические везикулы отложения кремнезема (silica deposition vesicle – SDV; Reimann, 1964; Drum, Pankratz, 1964) и везикулы транспорта кремния (silicon-transport vesicles – STV; Schmid, Schultz, 1979). Для Cymbella ventricosa Agardh исследования морфогенеза кремнистой створки не проводились. В работе была использована лабораторная культура пеннатной шовной диатомовой водоросли C. ventricosa. После стандартной фиксации и получения срезов для просвечивающей электронной микроскопии (ПЭМ), материал был исследован на микроскопе Leo 906 E Zeiss. По данным световой микроскопии (СМ) хлоропласт интерфазной А В Б м клетки C. ventricosa разделен на две доли, лежащие на противоположных сторонах клетки (рис. 1А-В). По данным ПЭМ П сферический пиреноид имеет оболочку, его пронизывает одна АГ АГ ламелла (рис. 1В-Д, Ж). Ядро прижато к поясковым ободкам (рис. Я Хл 1В). Несколько аппаратов Гольджи располагаются вокруг ядра АГ Г Д (рис. 1В, З). На периферии клеток можно наблюдать АГ образующиеся поясковые ободки внутри SDV. Длинные митохондрии расположены по периферии клетки (рис. 1Л). На П поперечных срезах клеток четко виден район шва (рис. 1К), на поверхности клетки – органический слой, а между кремнистой И Е З Ж м створкой и плазмалеммой – полисахаридный слой диатотепум АГ (рис. 1И). Я А К м П Основные стадии формирования створки у C. ventricosa (ПЭМ). АГ А – срез через недавно разделившуюся клетку. Стрелками показано волокнистое вещество под плазмалеммой, на месте везикулы отложения кремнезема Л м Б Рис. 1. Строение клетки C. ventricosa. А, Б – СМ; В-Л – ПЭМ. А – живые клетки в культуре; Б – автофлуоресценция хлоропластов; В – поперечный срез через клетку; Г – срез через пиреноид (длинная стрелка – ламелла, пересекающая пиреноид; короткая стрелка – оболочка пиреноида); Д – срез через тилакоиды; Е – срез через хлоропласт, стрелкой показано место прерывания опоясывающей ламеллы; Ж – срез через хлоропласт, стрелкой показан перипластидный ретикулум; З – срез через ядро и аппараты Гольджи; И – срез через створку и фрагмент клетки; К – срез створки в районе шва (показан стрелкой); Л – продольный срез через митохондрию. Условные обозначения: АГ – аппарат Гольджи; м – митохондрия; П – пиреноид; Хл – хлоропласт; Я – ядро. Масштаб: А, Б – 10 мкм; В – 2 мкм; Г, Е, Ж, И, К – 500 нм; Д – 200 нм; З, Л – 1 мкм. Были выделены основные стадии формирования кремнистой створки. При делении клетки миграция ядра, характерная для большинства диатомовых водорослей, не отмечена, что, скорее всего, обусловлено небольшим размером клетки. На протяжение всего деления ядро прилегает к поясковым ободкам. Морфогенез створки начинается после деления ядра, деления хлоропласта и разделения клетки на две дочерние (рис. 2А). На ранних стадиях в районе SDV наблюдаются крупные вакуоли (рис. 2А). В дальнейшем происходит рост SDV и утолщение створки (рис. 2Б, В). После образования загиба створки (рис. 2Г) происходит ее экзоцитоз. После этого хлоропласт каждой клетки увеличивается в размерах и перегибается вдоль створки. При этом дочерние клетки еще не расходятся, удерживаясь вместе системой поясковых ободков. Формированиие первого пояскового ободка гипотеки начинается после расхождения клеток. Для некоторых видов было показано участие в процессе морфогенеза створки мелких электронно-плотных сферических частиц, происходящих из цитоплазматических везикул диаметром 300-400 Å (silicon-transport vesicles, STV; Schmid, 1979; Schmid, Schultz, 1979). Существование таких строительных «кирпичиков» более никем не подтверждается, и в настоящее время, по мнению некоторых исследователей, считается, что кремниевая кислота транспортируется в виде геля и не может быть электронно-плотной (Grachev, Annenkov, Likhoshway, 2008; Thamatrakoln, Hildebrand, 2008). Если принять во внимание гипотезу об участии макропиноцитоза в морфогенезе створки (Vrieling et al., 2007), с помощью крупных вакуолей, присутствующих у C. ventricosa на ранних этапах морфогенеза створки, может происходить захват клеткой кремниевой кислоты, растворенной в водной среде внеклеточного пространства. Б – срез через две дочерние клетки. Стрелками показаны формирующиеся створки внутри везикулы отложения кремнезема В В – срез через дочерние клетки при формировании загиба створки. Образующие створки показаны стрелками. Г Г – срез через дочерние клетки перед экзоцитозом створки. Образующая створка показана стрелкой Drum R.W., Pankratz S. Pyrenoids, raphes, and other fine structure in diatoms // Am. J. Bot. – 1964. – Vol. 51. – P. 401-418. Grachev M.A., Annenkov V.V., Likhoshway Ye.V. Silicon nanotechnologies of pigmented heterokonts // BioEssays. – 2008. – Vol. 30. – P. 328-337. Reimann B.E.F. Deposition of silica inside a diatom cell // Exp. Cell Res. – 1964. – Vol. 34. – P. 605-608. Schmid A.-M.M. Influense of environmental factors on the development of the valve in diatoms // Protoplasma. – 1979. – Vol. 99. – P. 99-115. Schmid A.M.-M., Schultz D. Wall morphogenesis in diatoms: deposition of silica by cytoplasmic vesicles // Protoplasma. – 1979. – Vol. 100. – P. 267-288. Thamatrakoln K., Hildebrand M. Silicon uptake in diatoms: a model for saturable and nonsaturable uptake kinetitics and the role of silicon transporters // Plant Physiol. – 2008. – Vol. 146. – P. 1397-1407. Vrieling E.G., Sun Q., Tian M., Kooyman P.J., Gieskes W.W.C., van Santen R.A., Sommerdijk N.A. Salinity-dependent diatom biosilicification implies an important role of external ionic strength // Proc. Natl. Acad. Sci. U.S.A. – 2007. – Vol. 104. – P. 10441-10446.