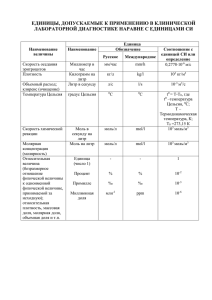
Химические реакции в организованных системах
реклама

Химические реакции в
организованных системах.
Многоэлектронные
процессы.
Многоэлектронное восстановление азота
требует участия полиядерного активного
центра
E
Kcal
mol
60
N2H
N2H2
40
N2H4
20
0
N2+nH2
2NH3
-20
N2 = 2N - 225 kcal/mol
Полиядерный Mo8Mg2 кластер
катализирует восстановление
азота в протонных средах
с той же эффективностью, что и
нитрогеназа
Связывание азота в природе
осуществляет фермент
нитрогеназа
Структура активного ферментного комплекса
Fe белок - Mo-Fe белок
ЭЛЕКТРОНЫЙ ТРАНСПОРТ В
НИТРОГЕНАЗНОМ КОМПЛЕКСЕ
Изменение структуры
Fe-белка(А) в комплексе(В)
ПУТИ ПЕРЕНОСА ЭЛЕКТРОНОВ
МЕЖДУ КЛАСТЕРАМИ
Ближайшее окружение Fe-Mo-кофактора
- активного центра нитрогеназы
N2 + 8e + 8 H+
2NH3 + H2
Замена аминокислот ближайшего
окружения методами генной инженерии
влияет на азотфиксацию
Организация транспорта субстрата и
протонов к активному центру
Каталитические свойства Fe-Mo
кофактора вне белка
60
50
40
EXTRACTION
DMF
C2H4
30
20
10
0
“M” - centre
FeMoco in DMF
C2H6
0
1
2
3
- lg ([PhSH], M)
4
•Температурные зависимости скоростей
накопления
этилена и этана в присутствии тиофенола
-2,4
ЕактС2Н4 = 9,4 ± 0,6 ккал/моль;
С2Н4
-2,6
-2,8
ЕактС2Н6 = 5,4 ± 0,6 ккал/моль
lnW
-3,0
-3,2
С2Н6
-3,4
-3,6
Zn/Hg, Е = 1.3 В;
-3,8
-4,0
3,25
3,30
3,35
T
-1
3,40
3
* 10 , K
3,45
[Mo8Mg2] = 1.3210-5 М;
[PhSH] = 1.210-2 М;
CH3OH; рС2Н2 = 100 mm Hg
-1
-1,0
ЕактС2Н4 = 18,3 ± 1,5 ккал/моль;
С2Н4
-1,5
-2,0
ЕактС2Н6 =12,8 ± 2 ккал/моль
-2,5
lnW
-3,0
-3,5
-4,0
С2Н6
Zn/Hg, Е = 1.7 В;
0,00340
[FeMoco] = 1.2*10–5 M;
[PhSH] = 1.210-2 М;
ДМФА; рС2Н2 = 100 mm Hg
-4,5
-5,0
-5,5
0,00330
0,00335
T
-1
3
0,00345
-1
* 10 , K
Координация N2 и CO на
выделенном Fe-Mo кофакторе
N 2 inhibition of C 2H 2 reduction
for different protein and non-protein systems
with FeMoco as a catalyst
60
1,1
50
1,0
Relative rate (v(N 2) / v(Ar))
Initial reaction rate
70
40
30
C2H4
20
C2H6
10
isolated FeMoco (this work)
N2-ase A. vin. wild type
(Rivera-Ortiz & Burris, 1975)
mutant DJ540,
wild-type MoFe protein
(Kim et al, 1995)
0,9
0,8
0,7
0,6
0
0.00
0.01
0.02
0.03
0.04
0,5
0,0
CO, atm
0,2
0,4
0,6
N2 (atm)
0,8
1,0
For all cases
P(C2H2)=10 mm
Структура комплекса
{[MgMo4III(4-O)(3-OCH3)2(2-OCH3)7]2(-OCH3)7(-OHCH3)}-
Фиксация N2 в S. thermoautotrophicus
St2
St3
CO дегидрогеназа Супероксид
MoCuS-MCD, FeS оксидоредуктаза,
действующая как редуктаза
динитрогеназы
Mn
St1
Динитрогеназа
MoCuS-MCD, FeS
Супероксид образуется в CO дегидрогеназе при окислении CO и
переносе электронов на O2.
Далее
супероксид
реокисляется
супероксид
оксидоредуктазой,
поставляющей электроны динитрогнезе.
Динитрогеназа способна восстанавливать N2 и H+, но не ацетилен
Числа обзначают МВ субъединиц в kDa. MCD – молибдоптерин цитозин
динуклеотид
Meyer O et al. J.Biol.Chem. 272, 26627 (1997)
Окислительно-восстановительный
маршрут фиксации азота
E
Kcal
mol
N2H
H
20
60
N2H2
40
O
N
[O] = H2O2
0
[O] = HO2
H2N N
O
[O] = O2
20
-40
0
-60
2NH3
-20
N2 = 2N - 225 kcal/mol
H2N NH(OH)
N2O
-20
N2H4
N2+nH2
N
NH3+NH2OH
N2 + [O] + nH2
2NH3+H2O
-80
N2O = N + NO - 114 kcal/mol
Ослабление NN связи в N2O позволяет
избежать участия многоэлектронных
восстановителей
но требует особой организации процесса
глубокого восстановления чтобы
избежать образования N2 и H2O
Ближайшее окружение Mo-кофактора в
CO дегидрогеназе
Dobbek, H.; Gremer, L.; Kiefersauer L., Huber, R.; Meyer, O.
Proc. Nat. Acad. Sci. USA, 99, 15971 (2002).
ЭНЕРГЕТИЧЕСКИЙ ПРОФИЛЬ
КАТАЛИТИЧЕСКОГО ЦИКЛА СО-ДЕГИДРОГЕНАЗЫ
CO + H2O OCO + 2 H+ + 2e
СТРУКТУРА ПЕРЕХОДНОГО
СОСТОЯНИЯ ПЕРЕНОСА АТОМА О
НА МОЛЕКУЛЫ СО и N2
СТРУКТУРА ПРОМЕЖУТОЧНЫХ
ТИОКАРБОНАТНЫХ КОМПЛЕКСОВ