Клинические исследования и регистрация лекарственных препаратов в России Завидова Светлана,
реклама

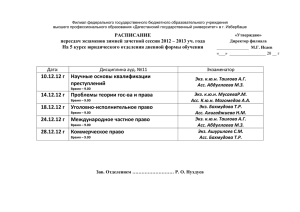
Клинические исследования и регистрация лекарственных препаратов в России Завидова Светлана, Ассоциация организаций по клиническим исследованиям (АОКИ) 04 июня 2013, Москва Закон «Об обращении лекарственных средств» Вступил в силу 01 сентября 2010 г. До Схема регистрации в целом соответствовала международному подходу После Создана уникальная система регистрации, не имеющая аналогов в мире Система регистрации в России Особенность: Клинические исследования включены в процесс регистрации, назначаются и проводятся после подачи заявки на регистрацию и формирования регистрационного досье Система регистрации в России Доклинические исследования Формирование рег. досье, подача заявки на регистрацию Проведение клинических исследований Продолжение процесса регистрации Возможность проведения различных типов клинических исследований в России Регистрационные - назначаются и проводятся в рамках процесса регистрации; Международные многоцентровые клинические исследования (ММКИ) и пострегистрационные КИ проводятся независимо по самостоятельной процедуре Последствия Производители лишены возможности проведения предрегистрационных исследований вне процесса регистрации, за исключением ММКИ Каким образом ведется разработка инновационных отечественных лекарственных препаратов? Система регистрации в России – требование о проведении локальных исследований Результаты ММКИ не признаются (за исключением случаев, когда в них участвовали российские центры); Производители вынуждены проводить повторные исследования в участием представителей «российской популяции»; Норма относится не только к оригинальным препаратам, но и к дженерикам Локальные исследования: аргументы для введения • «необходимость учета популяционных особенностей» • недоверие к результатам КИ, проведенным за рубежом Асс оциация организаций по к линическим исследованиям (AOKИ) Требование о проведении локальных «регистрационных» КИ, последствия • Задержка регистрации новых препаратов, в ММКИ которых Россия не участвовала; • Практическая невозможность регистрации орфанных препаратов; • Увеличение количества ненужных «локальных» КИ Асс оциация организаций по к линическим исследованиям (AOKИ) Динамика выданных разрешений на клинические исследования, 2004-2012 гг. Общее кол-во разрешений на КИ, выданных в 2012 г., выросло на 60% по сравнению с 2011 г. 915 1000 900 800 700 600 563 523 615 577 482 507 567 447 500 400 300 200 100 0 2004 2005 2006 2007 2008 2009 2010 2011 2012 Асс оциация организаций по к линическим исследованиям (AOKИ) Динамика выданных разрешений на клинические исследования, 2004-2012 гг. 1000 900 165 800 700 212 600 101 500 144 88 65 400 85 68 67 300 200 63 369 279 324 2005 2006 133 68 77 45 32 364 80 112 348 252 123 63 107 62 Локальные КИ (российские спонсоры) Биоэквивалентность (российские спонсоры) Биоэквивалентность (иностранные спонсоры) 77 Локальные КИ (иностранные спонсоры) 30 ММКИ 35 246 370 369 2010 2011 2012 100 0 2004 2007 2008 2009 Асс оциация организаций по к линическим исследованиям (AOKИ) Структура рынка КИ по видам, 2004-2011 ММКИ 13,3% Локальные КИ (иностранные спонсоры) Биоэквивалентность (иностранные спонсоры) Локальные КИ (российские спонсоры) 19,8% 1,8% 5,6% 59,6% Биоэквивалентность (российские спонсоры) Источник: www.grls.rosminzdrav.ru, www.roszdravnadzor.ru Асс оциация организаций по к линическим исследованиям (AOKИ) Структура рынка КИ по видам, 2012 г. ММКИ 23% 40% Локальные КИ (иностранные спонсоры) Биоэквивалентность (иностранные спонсоры) 18% 12% 7% Локальные КИ (российские спонсоры) Биоэквивалентность (российские спонсоры) Источник: www.grls.rosminzdrav.ru Асс оциация организаций по к линическим исследованиям (AOKИ) Структура сектора локальных КИ иностранных спонсоров, 2012 г. дженерики биоаналоги 6,5% 14,5% 2 3,2% 9 3,2% 4 оригинальные* 2 иные** 45 пострегистрационные * включая биологические, а также новые формы, показания и комбинации уже 72,6% зарегистрированных препаратов; ** препараты растительного происхождения, комбинации хорошо изученных веществ и пр. Асс оциация организаций по к линическим исследованиям (AOKИ) Структура сектора локальных КИ российских спонсоров, 2012 г. дженерики биоаналоги оригинальные* 7,3% 13,3% 22 49 иные** 12 67 15 29,7% 9,1% 40,6% пострегистрационные * включая биологические, а также новые формы, показания и комбинации уже зарегистрированных препаратов; ** препараты растительного происхождения, гомеопатия, комбинации хорошо изученных веществ и пр. Асс оциация организаций по к линическим исследованиям (AOKИ) Закон «Об обращении лекарственных средств», часть 3 статьи 5 «В Российской Федерации в соответствии с международными договорами Российской Федерации и (или) на основе принципа взаимности признаются результаты клинических исследований лекарственных препаратов для медицинского применения, проведенных за пределами территории Российской Федерации.» Асс оциация организаций по к линическим исследованиям (AOKИ) Откуда это появилось? Норма введена перед вторым чтением в Госдуме в качестве уступки общественной критике Асс оциация организаций по к линическим исследованиям (AOKИ) Аргументация в защиту локальных «регистрационных» КИ 1) «необходимость учета популяционных особенностей» 2) недоверие к результатам КИ, проведенным за рубежом Каким образом наличие договора о взаимном признании решает эти две проблемы? Асс оциация организаций по к линическим исследованиям (AOKИ) Наше понимание • Аналогов нормы в законодательствах других стран нет; • КИ не могут быть предметом международного договора, т.к. не являются результатами деятельности госорганов; • В международной практике признаются результаты КИ, проведенных в соответствии с ICH GCP Асс оциация организаций по к линическим исследованиям (AOKИ) Асс оциация организаций по к линическим исследованиям (AOKИ) Попытки реализации Асс оциация организаций по к линическим исследованиям (AOKИ) Сентябрь 2010 г., Москва Татьяна Голикова: «Этот пункт [о взаимном признании] вызвал одобрение г-на Далли» John Dalli: «I have also discussed with the Minister concerns related with the Russian law on pharmaceuticals, in particular as regards the level of protection of data submitted by a pharmaceutical company when requesting a market authorisation, and requirements on clinical trials» Асс оциация организаций по к линическим исследованиям (AOKИ) Февраль 2011 г., Брюссель Татьяна Голикова: «Стороны вплотную приблизились к тому, чтобы решить вопросы…в части взаимного признания результатов клинических исследований». «Россия и Евросоюз готовы быстро отработать все вопросы, связанные с подготовкой договора, который установит правила взаимного признания клинических исследований» Асс оциация организаций по к линическим исследованиям (AOKИ) Поручения Президента РФ от 02.06.2011 д) организовать проведение переговоров со странами Европейского союза и США в целях заключения Российской Федерацией международных договоров по взаимному признанию результатов клинических исследований лекарственных препаратов для медицинского применения; е) подготовить предложения по внесению изменений в нормативные правовые акты РФ, предусматривающие возможность признания в РФ результатов проведенных в странах ЕС и США клинических исследований лекарственных препаратов, в том числе предназначенных для применения в педиатрической практике. Срок – 1 сентября 2011 г. Асс оциация организаций по к линическим исследованиям (AOKИ) Октябрь 2011 г., Москва Татьяна Голикова: «Также на встрече речь шла о подготовке в перспективе соглашения, которое бы урегулировало вопрос взаимного признания клинических исследований» Асс оциация организаций по к линическим исследованиям (AOKИ) Проект Минздрава и Еврокомиссии: о чем на самом деле договариваются стороны? Асс оциация организаций по к линическим исследованиям (AOKИ) Асс оциация организаций по к линическим исследованиям (AOKИ) D1 Law no. 61FZ;[1, Articles 14, 21(2), 39] Except of so-called international multicentre clinical trials (IMCTs) and postregistration studies, applications for conducting a clinical trial in RF can only be submitted in the course of a registration process Recommendation: The link between registration process and authorisation to conduct of a clinical trial might be removed D4 Law no. 61-FZ; [1; Article 3] Article 3 (5) of [1] states that the results of clinical trials conducted outside of RF shall be acknowledged based on “International treaties” and/or the principle of reciprocity. Recommendation: This might be replaced by a phrase like “The results of clinical trials will be accepted in the marketing authorisation process, if it can be demonstrated that the trial was conducted in compliance with GCP rules” D14 Law no. 61-FZ; [1, Articles 14, 21(2), 27] The requirement to repeat safety and efficacy clinical trials (so-called local registration studies) whose results have already been assessed in the "original" registration process, puts study participants on unnecessary risk(s), generates additional costs for the applicant, and postpones access of the population to modern drugs. Recommendation: The requirement to conduct "Local registration studies” should be restricted to defined, (country specific ) cases, like special national medical care system/population (ethnic groups)/diet Асс оциация организаций по к линическим исследованиям (AOKИ) Каковы условия признания КИ? Асс оциация организаций по к линическим исследованиям (AOKИ) Выход? Асс оциация организаций по к линическим исследованиям (AOKИ) Наше понимание Единственный правильный выход из ситуации – изменение закона «Об обращении лекарственных средств»: - исключение клинических исследований из процесса регистрации; - отказ от локальных «регистрационных» клинических исследований Асс оциация организаций по к линическим исследованиям (AOKИ) Спасибо за внимание! Асс оциация организаций по к линическим исследованиям (AOKИ)