Низкодозная брахитерапия I
реклама
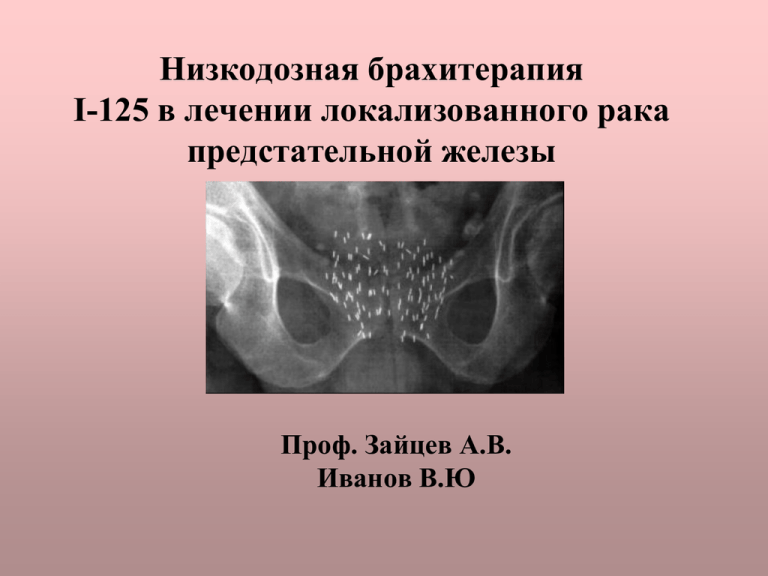
Низкодозная брахитерапия I-125 в лечении локализованного рака предстательной железы Проф. Зайцев А.В. Иванов В.Ю Брахитерапия (интерстициальная лучевая терапия) рака предстательной железы основана на введении источника ионизирующего излучения в ткань предстательной железы. История брахитерапии рака предстательной железы. • • • • • • • • 1914 г. Pasteau – осуществил введение радиевой иглы в простатический отдел уретры С 1915 по 1927 гг. Hugh Hampton Young (один из разработчиков радикальной простатэктомии) выполнил 500 брахитерапий путём введения источника в простатический отдел уретры и 25 радикальных простатэктомий. В 1950, Flocks первый осуществил инъекции радиоактивного золота в ткань предстательной железы В начале 1970-х, Willet Whitmore and Basil Hilaris из Memorial Sloan-Kettering Cancer Center, New York, первые произвели имплантацию I-125 в предстательную железы позадилонным доступом. В 1983, Hans Holm, University of Copenhagen, Denmark, первые осуществил «закрытую», неоперативную имплантацию радионуклеидных источников под контролем трансректальной ультрасонографии. В 1985, Haakon Ragde, John Blasko, and Peter Grimm, усовершенствовали метод Holm’s в Seattle, Washington. В 1987 Tim Mate and James Gottesman начали использовать дозиметрическое програмное обеспечение в Swedish Medical Center, Seattle В 1990-х значительное увеличение количества выполненных брахитерапий предстательной железы в США Методики брахитерапии • Высокодозная брахитерапия (HDR High Dose Radiation) • Низкодозная брахитерапия (LDR Low Dose Radiation – Под ультразвуковым наведением – Под контролем спиральной томографии Высокодозная брахитерапия • Источник – Ir-192 • Высокая мощность радиационного воздействия • Отсутствие радиационного воздействия вне операции • Возможности применения при Т3 • Возможности применения при высокой IPSS и умеренных обструктивных симптомах • Проведение возможно только в специализированных клиниках, оборудованных радиационным каньоном Низкодозная брахитерапия • Источники I-125, Pd-103 • Низкая мощность источников • Радиационное воздействие продолжается после операции На основании МУ 2.6.1.1017-01 При работе с закрытыми радионуклеидными источниками I-125 специальные требования к отделке помещений для проведения брахитерапии предстательной железы не предъявляются Источник ионизирующего излучения I-125 Закрытый источник I-125 IsoCord представляет собой капсулы с титановой оболочкой, фиксированные на рассасывающейся нити, через каждые 5 мм., содержащие Йод-125, осажденный на серебренном стержне. Поставляется в стерильном защитном контейнере из нержавеющей стали, внутри которого нить намотана на катушку. Характеристика источника I-125 • • • • Период полураспада 60.1 сутки Активность одной капсулы 0.2-0.8 мКи Фотонная энергия 27-35 кэВ Слой половинного ослабления излучения – Вода 2.0 см. – Свинец 0.002 см. • Мощность поглощённой дозы от одного источника в воздухе на расстоянии 1 м. 0.1- 8 мкГр/ч Материально-техническое обеспечение Показания к брахитерапии: • Гистологически подтверждённая аденокарцинома предстательной железы • Клиническая стадия Т1с-Т2bN0 M0, отсутствие клинических признаков поражения семенных пузырьков и регионарных лимфоузлов Рекомендации ESTRO/EAU/EORCT по отбору пациентов на низкодозную брахитерапию Предопределяющие факторы Наиболее перспективные пациенты Средняя перспективность лечения Наименее перспективные пациенты ПСА <10 10-20 >20 Балл по шкале Глисона 5-6 7 8-10 Стадия процесса T1c-T2a T2b-T2c T3 IPSS 0-8 9-19 >20 Объем простаты <40 40-60 >60 Q max >15 15-10 <10 ТУРП + Объем остаточной мочи >200 Противопоказания к брахитерапии • Абсолютные – Предполагаемая продолжительность жизни менее 5 лет – Продолженный рост и/или наличие отдалённых метастазов • Относительные – – – – Объём железы > 50 Высокий бал IPSS T2с стадия или Глисон >7 ТУР предстательной железы в анамнезе меньше 6 мес. назад. – «плохая анатомия»: Выраженная средняя доля, большой ТУР-дефект, большой размер железы. – Выраженная инфравезикальная обструкция – Нарушение свёртываемости крови Брахитерапия в сочетании с дистанционной лучевой терапии 45 Гр. • ПСА = 10 – 20 нг/мл • Бал по шкале Глисона > 7 • Поражение обеих долей и многофокусное поражение по результатам биопсии предстательной железы • Периневральная инвазия • Пенетрация капсулы по данным МРТ Обязательные методы обследования • Опрос жалоб, анамнез – – – – • • • • • • • • • • Анамнез заболевания, диагностические мероприятия Предшествующее лечение ДГПЖ и/или РПЖ Терапевтический анамнез и статус Лекарственная непереносимость IPSS Пальцевое ректальное исследование ПСА Клинический, биохимический анализы крови, общий анализ мочи, коагулограмма ЭКГ Рентгенография органов грудной клетки УЗИ почек, предстательной железы (ТРУЗИ), определение остаточной мочи Урофлоуметрия Остеосцинтиография (по показаниям) МРТ малого таза (по показаниям) Этапы брахитерапии • Исследование объема предстательной железы, предварительное дозиметрическое планирование • Заказ, получение, регистрация и хранение радиоактивного материала • Инраоперационное получение изображений предстательной железы, интраоперационное планирование • Зарядка игл • Имплантация источников • Радиологический контроль пациента и помещения после проведения имплантации • Утилизация и хранение неиспользованных источников • Постимлантационная дозиметрия Получение изображения предстательной железы Дозиметрическое планирование • Установка предписываемой дозы облучения, мощности источников • Загрузка изображений • Калибровка координатной сетки • Определение контуров предстательной железы, уретры, прямой кишки • Программный расчет точек имплантации • Распечатка полученного плана Минимальная предписываемая доза (mpD) Минимальная доза излучения, которую должен получить орган мишень за время полного распада изотопа • • Для монотерапии 140-145 Гр В сочетании с дистанционной лучевой терапией 110-115 Гр Программа дозиметрического планирования PSID 4.0 Вычисление энергии источников Расстановка источников на срезах 3D реконструкция Критерии дозиметрической оценки при планировании, рекомендации ESTRO Простата • V100 ≥ 95% • D90 ≥ 100% mPD • V150 ≤ 50 % Критические органы: • Уретра – UD10 ≤ 150 % mPD – UD30 ≤ 130 % mPD • Прямая кишка – D2cc ≤ 100% mPD – Dmax ≤ 200 Gy V100, V150 объем органа получающего100% , 150% дозы соответственно D90, D10, D30 доза полученная 90%, 10%,30% объема органа соответственно План имплантации источников и отчет о загрузке игл Имплантация источников Постиплантационная дозиметрия. Зачем она нужна? • Оценка качества • Рекомендовано ESTRO, ABS • Обеспечение обратной связи для повышения квалификации медицинского персонала • Юридический документ • Пациент желает знать… Осложнения Со стороны мочевой системы Со стороны желудочнокишечного тракта Другие Дизурия 48% (интенсивнось уменьшается через 2 мес. после имлантации) Лучевой проктит 2 % Тазовая боль Острая задержка мочеиспускания (7-8%) Язва прямой кишки Миграция источника Гематурия 16% Запор Вторичная малигнизация Стиктура уретры Мочеполовой кишечный свищ Эректильная дисфункция (1421%) Некроз уретры менее 1% Недержание мочи (0-1%) Профилактика и коррекция осложнений • Соблюдение доз облучения на органы риска при планировании • Соблюдение техники имплантации • Превентивное назначение альфа блокаторов за 3 дня и антибиотиков за сутки до имплантации; • Катетеризация мочевого пузыря в течении 1-2 суток после процедуры; • Назначение гемостатиков и нестероидных противовоспалительных препаратов; • Задержка мочи – троакарная цистостомия или интермитирующая катетеризация, ТУР предстательной железы через 6 мес. после имплантации; • Лучевой проктит – озонотерапия, репаранты Вопросы радиационной безопасности На основании МУ 2.6.1.1017-01 в соответствии НРБ-99 мощность дозы на расстоянии 1 м. От пациента при выписке не должна превышать 3 мкЗв/ч. Указанная мощность дозы гарантирует с большим запасом непревышение дозы 1 мЗв, которую могут получить родственники и другие лица за полный распад нуклеида в теле пациента. Результаты измерений поглощенных доз персоналом, при проведении имплантации микроисточников Йод-125 могут говорить об относительном отсутствии радиационной опасности для персонала, при соблюдении правил работы с радиоактивными источниками Йод-125 В.Ф. Степаненко, О.Б. Корякин, П.В. Свиридов,Т.В. Колыженков ГУ Медицинский радиологический центр РАМН, Обниск (Материалы 2-го конгесса российского общества онкоурологов стр54-55) Эффективность брахитерапии Наш опыт: • Выполнено 9 операций – Задержка мочеиспускания – нет – Время пребывания в стационаре после имплантации – 3-5 суток – Удаление уретрального катетера через 1 сутки – Произведён контроль уровня РСА через 3 мес. у 6 пациентов – 0,35-1,37 нг./мл. – Уровень ПСА до лечения – 5.8 –18 нг./мл. – Незначительные явления постлучевого проктита (зуд в прямой кишке, стул до 3-х раз в сутки) - 2 СПАСИБО ЗА ВНИМАНИЕ