Результаты адьювантной аутоиммунотерапии
реклама

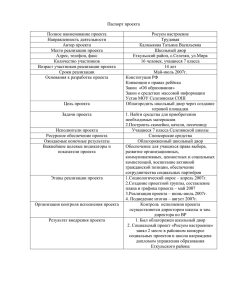
Результаты адьювантной аутоиммунотерапии препаратом Онкофаг® (HSPPC-96) у больных почечно- клеточным раком (III фаза) Горелов А.И. Санкт-Петербургский Государственный Университет Медицинский факультет Москва - 4 октября 2007 1 Введение Предпосылки для создания Онкофага® (HSPPC-96) Метод выбора при лечении локализованных форм почечноклеточного рака - нефрэктомия У 20-30% больных после нефрэктомии развивается рецидив заболевания Среднее время до развития рецидива – 15-18 месяцев Через 5 лет рецидив болезни регистрируют у 40% больных Современные методы лечения рецидивов почечно-клеточного рака практически неэффективны Москва, 4 октября 2007г. 2 Онкофаг® (HSPPC-96) - новый препарат для адъювантной терапии почечно-клеточно рака Основой препарата является комплекс белков теплового шока и опухоль-специфических пептидов (HSPPC) Белки теплового шока (БТШ) - это наиболее часто встречающиеся протеины всех типов клеток, включая опухолевые Полученный из опухоли комплекс БТШ и пептидов вызывает усиление опухоль-специфического иммунного ответа при введении пациенту Москва, 4 октября 2007г. 3 Критерии включения Стадия TNM Grade Ia T1a, N0, M0 Любой Ib T1b, N0, M0 Высокий (3-4) II T2, N0, M0 Высокий (3-4) III T1, N1, M0 Любой T2, N1, M0 Любой T3a N0, M0 Любой T3a N1, M0 Любой T3b,c, N0, M0 Любой T3b,c, N1, M0 Любой T4, N0, M0 Любой T4, N1, M0 Любой Любая T, N2, M0 Любой Любая T, любая N, M1 Любой IV Стадирование по AJCC, 2002 * Критериям включения соответствуют все пациенты, кроме отмеченных красным * Критериям включения соответствуют все пациенты, кроме отмеченных красным Москва, 4 октября 2007г. 4 Критерии включения (продолжение) Возраст > 18 лет Статус по шкале Zubrod/ECOG/WHO <1 Для женщин детородного возраста – отрицательный тест на беременность Подписанное информированное согласие Москва, 4 октября 2007г. 5 Дизайн исследования Высокий риск рецидивирования Нефрэктомия с т р а т и ф ик а ц и я р а н д о м и з а ц и я Онкофаг Наблюдение Москва, 4 октября 2007г. р е ц и д и в и р о в а н и е Другая противоопухолевая терапия на фоне Онкофага Другая противоопухолевая терапия без Онкофага в ы ж и в а е м ос ть 6 Задачи исследования Оценка безрецидивной выживаемости Оценка общей выживаемости Получение данных о безопасности лечения Онкофагом Москва, 4 октября 2007г. 7 Анализ популяции больных Рандомизировано Выбыли из исследования Наблюдение 367 чел. 728 чел. Полная анализируемая выборка наблюдение304 чел. Наблюдение 63 чел. Онкофаг 300 чел. Онкофаг 361 чел. Онкофаг 61 чел. Москва, 4 октября 2007г. 8 Анализ популяции больных Онкофаг Наблюдение n = 300 n = 304 Средний возраст, годы 58.2 59.7 Пол, мужчины:женщины 189:111 183:121 Европеоидная раса 286 286 Латиноамериканцы 6 9 Афроамериканцы 0 3 Другие расы 8 6 n (%) n (%) 0 231 (77.0) 238 (78.3) 1 69 (23.0) 66 (21.7) Статус по ECOG Москва, 4 октября 2007г. 9 Распределение больных по стадиям заболевания Количество больных (%) Онкофаг n = 300 Наблюдение n = 304 I 8 (2.7) 5 (1.6) II III 117 (39.0) 163 (54.3) 110 (36.2) 181 (59.5) IV 12 (4.0) 8 (2.6) Состояние лимфатических узлов NX or N0 N+ 279 (93.0) 21 (7.0) 290 (95.4) 14 (4.6) Степень злокачественности (G) Низкая (1 или 2) Высокая (3 или 4) 92 (30.7) 208 (69.3) 94 (30.9) 210 (69.1) Стадии по AJCC Москва, 4 октября 2007г. 10 Распределение больных по группам прогрессирования Промежуточный риск (по ECOG) (5-летняя безрецидивная выживаемость 61,8 % ) 362 чел. (60% ) Высокий риск (по ECOG) (5-летняя безрецидивная выживаемость 41,9%) 242 чел. (40%) Всего 604 чел. Москва, 4 октября 2007г. 11 Введение Онкофага® Онкофаг количество инъекций, (%) Количество инъекций (доза 25 µг, 0.4 мл) Среднее (SD) 17.0 (17.31) Медиана 13.0 Минимальное- максимальное 0 - 109 Длительность терапии Онкофагом (дни) Средняя (SD) 214.7 (244.93) Медиана 148.0 Минимальная – максимальная 0 - 1504 Москва, 4 октября 2007г. 12 Безрецидивная выживаемость Antigenics Inc. Protocol C-100-12 выживаемость (на ноябрь 2005 г.) 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 Page 1 of 1 Figure 2.28.3.3 Recurrence-Free Survival Clinical Event Committee Assessment Modified ITT P value = .502 HR = 0.922 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 Time to Recurrence or Death During Evaluation (days) Время до появления рецидива илиTumor смерти пациента (дни) Рандомизированная группа : Randomized Group: HSPPC-96 (n =361) Наблюдение Observation (n =367) Censored (HSPPC-96) Censored (Observation) Москва, 4 октября 2007г. 13 Protocol C-100-12 выживаемость Figure New Pathological Assesment Безрецидивная выживаемость у больных Recurrence-Free Survival I и (на ноябрь 2005 г.) Clinical Event Committee Assessment FAS AJCC=1 or 2 included in the analysis 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 II стадией по AJCC P value = .056 HR = 0.576 95% CI (0.324, 1.023) 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 Время доTime появления рецидива или смерти пациента to Recurrence or Death During Tumor Evaluation (days)(дни) Randomized Group: Рандомизированная группа : HSPPC-96 (n =125) Наблюдение Censored (HSPPC-96) Censored (Observation) Москва, 4 октября 2007г. Observation (n =115) 14 выживаемость Figure 2.5.1 Survival Безрецидивная выживаемость уRecurrence-Free больных со стадией III и IV по AJCC (на ноябрь 2005 г.) Clinical Event Committee Assessment FAS AJCC=III/IV included in the analysis 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 P value = .686 HR = 1.083 95% CI (0.735, 1.595) 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 Время доTime появления рецидива или смерти пациента to Recurrence or Death During Tumor Evaluation (days)(дни) Randomized группа Group:: Рандомизированная HSPPC-96 (n =175) Наблюдение Censored (HSPPC-96) Censored (Observation) Москва, 4 октября 2007г. Observation (n =189) 15 Antigenics Inc. Protocol C-100-12 Безрецидивная Page 1 of 1 выживаемость у больных категории промежуточного риска рецидивирования (на ноябрьFigure 2005)New Pathological Assesment выживаемость Recurrence-Free Survival Clinical Event Committee Assessment FAS AJCC=1 or 2 and AJCC=3 (T1,T2,T3a with Grade 1 or 2 only) included in the analysis 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 P value = 0.026 HR = 0.589 95% CI = 0.367, 0.944 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 ВремяTime до to появления или смерти пациента Recurrence orрецидива Death During Tumor Evaluation (days) (дни) Рандомизированная Randomized группа Group:: HSPPC-96 (n =183) Censored (HSPPC-96) Observation Наблюдение (n =178) Censored (Observation) *P-value =0.009 (one sided Log-rank test stratified by histological grade, regional lymph nodal status, and performance status at baseline) Москва, 4 октября 2007г. 16 Antigenics Inc. Безрецидивная Protocol C-100-12 Final Page 1 of 1 выживаемость у больных категории промежуточного риска Figure 2.4.1 рецидивирования (на март 2007) выживаемость Recurrence-Free Survival Investigator Assesment FAS Intermediate Risk 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 P value = .004 HR = 0.521 95% CI = 0.333, 0.815 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 Time to Recurrence or Death During Tumor Evaluation (days) Время до появления рецидива или смерти пациента (дни) Randomized группа Group:: Рандомизированная HSPPC-96 (n =184) Observation Наблюдение (n =178) Censored (HSPPC-96) Censored (Observation) Москва, 4 октября 2007г. 17 выживаемость Figure 2.4.1 Survival Общая выживаемость у пациентов Overall промежуточного риска рецидивирования (на март 2007) FAS Intermediate Risk 1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 P value = .126 HR = 0.608 95% CI = 0.320, 1.156 0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 Время до смертиTime пациента to (Death)(дни) (days) Рандомизированная Randomized группа Group: : HSPPC-96 (n =184) Censored (HSPPC-96) Москва, 4 октября 2007г. Наблюдение Observation (n =178) Censored (Observation) 18 Количество рецидивов и летальных исходов Промежуточный риск Онкофаг Наблюдение HR (95% Cl) P-value N (184) N (178) на ноябрь 2005 г. 19 (10.4 %) 35 (19.7 %) 0.553 (0.316, 0.968) 0.036 на март 2007 г. 30 (16.3 %) 55 (30.9 %) 0.521 (0.333, 0.815) 0.004 на январь 2006 г. 14 (7.7 %) 12 (6.7 %) 1.171 (0.541, 2.536) 0.688 на март 2007 г. 15 (8.2 %) 25 (14.0 %) 0.608 (0.320, 1.156) 0.126 Рецидивирование Количество летальных исходов Москва, 4 октября 2007г. 19 Преимущества лечения ОНКОФАГОМ С ОНКОФАГОМ БЕЗ ОНКОФАГА Без рецидива С рецидивом Москва, 4 октября 2007г. 20 Наиболее часто встречающиеся побочные эффекты при лечении Онкофагом (≥5% больных) Побочный эффект Эритема в месте инъекции Отек в месте инъекции Головная боль Боль в спине Утомляемость Ринофарингит Артралгия Астения Гипертензия Инфекция мочевыводящих путей ОРЗ Реакции в области послеоперационного рубца Диарея Тошнота Лихорадка Запоры Головокружение Москва, 4 октября 2007г. Онкофаг n = 318 n (%) 158 (49.7) 153 (48.1) 38 (11.9) 37 (11.6) 33 (10.4) 28 (8.8) 27 (8.5) 18 (5.7) 20 (6.3) 22 (6.9) 17 (5.3) 23 (7.2) 18 (5.7) 20 (6.3) 16 (5.0) 16 (5.0) 16 (5.0) Наблюдение n = 359 n (%) 0 0 9 (2.5) 16 (4.5) 12 (3.3) 5 (1.4) 17 (4.7) 6 (1.7) 7 (1.9) 16 (4.5) 17 (4.7) 10 (2.8) 5 (1.4) 6 (1.7) 3 (0.8) 5 (1.4) 6 (1.7) 21 Выводы Безрецидивная выживаемость : - достоверно выше у пациентов в стадии I и II (AJCC), получавших Онкофаг, по сравнению с группой наблюдения - достоверно выше у пациентов с промежуточным риском рецидивирования (ECOG), получавших Онкофаг, по сравнению с контрольной группой Общая выживаемость: - отмечена тенденция к увеличению продолжительности жизни у больных, получавщих Онкофаг, однако требуется дальнейшее наблюдение Препарат Онкофаг безопасен в применении Москва, 4 октября 2007г. 22 Заключение Онкофаг открывает перспективу адъювантной терапии у больных почечно- клеточным раком с промежуточным риском прогрессирования Москва, 4 октября 2007г. 23