Lecture 7
реклама
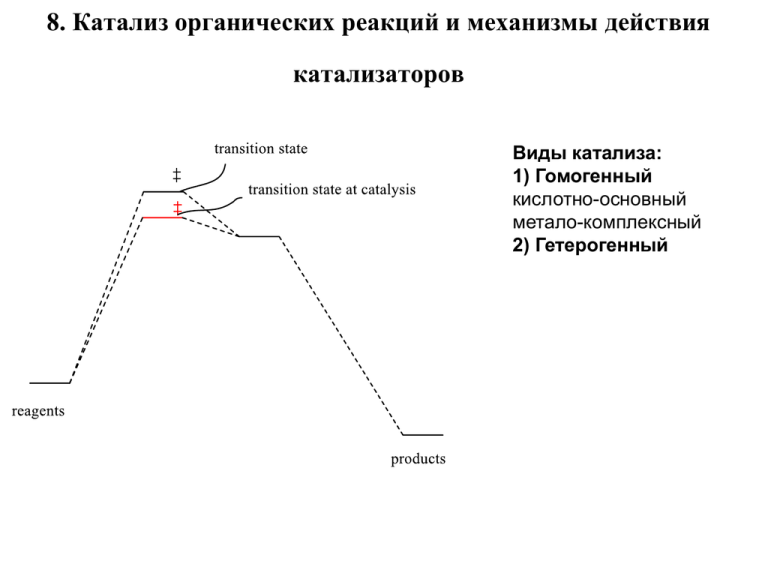
8. Катализ органических реакций и механизмы действия катализаторов Виды катализа: 1) Гомогенный кислотно-основный метало-комплексный 2) Гетерогенный 8.1. Гомогенный катализ Два механизма кислотно основного катализа: Специфический и общий специфический кислотный и общий кислотный специфический основный и общий основный Специфический кислотный катализ Скорость = k [SolH+][Реагент] Общий кислотный катализ Скорость=k1[SolH+][Реагент]+k2[A1H][Реагент]+k3[A2H][Реагент] где [SolH+] – концентрация протонированных молекул растворителя, а А1Н и А2Н – другие доноры протона. Специфический кислотный катализ V= k [H3O+] [RCH(OEt)2] Атака протона в быстрой стадии ! Общий кислотный катализ HA – AcOH или другой донор протона V= k1 [H3 O+] При рН ~ 7, [H3O+] ~10-7 гидролиз [RCH(OEt)3] + k2 [HA] [RCH(OEt)3] Проходит и в нейтральных средах lg k2 = a lgKa + b Перенос протона – в медленной стадии ! Ka – константа диссоциации донора протона HA Каталитический закон (уравнение) Бренстеда Кинетический изотопный эффект растворителя (КИЭ) – позволяет различить общий и специфический кислотный катализ D3O+ более сильная кислота, чем H3O+. Поэтому в случае специфического кислотного катализа kH/kD < 1. Для общего кислотного катализа kH/kD > 1. Специфический и общий основный катализ V = k [OH-] [Reagent] V = k1 [OH-] [Me2CO] + k2 [MeCOO-] [Me2CO] B = OH-, MeCOO- и другие основания 8.2. Металлокомплексный катализ Металлорганические соединения с π-связями Бис(π-аллил)никеля Циклобутадиен-железотрикарбонила ферроцен Обычно общее число электронов отданных лигандами вместе с валентными электронами атома (или иона) металла равно 18. Pd- катализ и его механизмы Пример изображения каталитического цикла Каталитический цикл реакций метатезиса олефинов 8.3. Гетерогенный катализ Наиболее распространенные реакции: восстановление (гидрирование), разные виды крекинга, изомеризация углеводородов, дегидратация, гидратация, алкилирование, окисление. Катализаторы: металлы (Pt, Pd, Ru, Rh, Ag, Ni, Cu-Cr) и оксиды (Al2O3, Fe2O3, TiO2, ZnO, V2O5). Чаще используют в виде композитов – наносят металлы на поверхности инертных материалов (уголь, песок, CaCO3 и др.). Используют «промоторы» для активации и ингибиторы для дезактивации. Например, катализатор Линдлара (Pd на CaCO3, частично «отравленный» Pb(OAc)2) Реакции в гетерофазных системах газ- или жидкость-твердый катализатор Постулируют пять стадий: 1. Диффузия реагентов к поверхности катализатора 2. Адсорбция реагентов 3. Химическая реакция адсорбированных реагентов на поверхности 4. Десорбция продуктов реакции с поверхности 5. Диффузия продуктов pi- комплексы олефинов. «Сигма» связь H-M ? Связи С=С и Н-Н удлиняются «Сигма» связи C-M и H-M ? Присоединение H к С=С связям проходит в две стадии (ступенчато). Наблюдается обмен D на Н в CD=CD. Цис-алкены реагируют быстрее, трансизомеров. Присоединение идет по син-типу Примеры и условия реакций гидрирования Реакция Катализатор Условия C=C HC-CH Pd, Pt, Ni, Ru, Rh 20oC, 1 атм Алкин цис-алкен Pd 20oC, 1 атм Арен циклоалкан Rh, Pt 50-100oC, 5-10 атм Ni, Pd 100-200oC, 100-200 атм Pt, Ru 20oC, 1-4 атм, доб. к-т Cu-Cr, Ni 50-100oC, 100-200 атм ArCOR or ArCH(OH)R ArCH2R Pd 20oC, 1-5 атм, доб. к-т ArCH(NH2)R ArCH2R Pd, Ni 50-100oC, 1-50 атм RCOCl RCH=O Pd 20oC, 1 атм, доб. ингибиторов (хинолин) RCOOH RCH2OH Pd, Ru, Ni 100-200oC, 100-200 атм RCOOR RCH2OH Cu-Cr, Ni 100-200oC, 100-200 атм RCN RCH2NH2 Ni, Rh 50-100oC, 100-200 атм, доб. NH3 RNO2 RNH2 Pd, Pt, Ni 20oC, 1-4 атм R-Hal R-H Pd 200-200oC, 1-200 атм, порядок активности: I > Br > Cl > F Кетоны спирты Возможные механизмы дегидратации спиртов Al2O3 8.4. Межфазовый катализ (МФК) Ускорение органических реакций в межфазовых системах за счет переноса реагента (чаще нуклеофила) в фазу, в которой он наиболее активен Катализаторы МФК: Alk4N+ X-, Alk4P+ X- (Alk = Bu, PhCH2 и т.п. липофильные), полиэтиленгликоли (PEG), краун-эфиры, криптанды. Растворимы в воде и органических растворителях ! KF + Не растворим в орг. ра-теле C8H17Cl C8H17F + KCl не ра-рим в воде KF + R4P+ Br- KBr + R4P+ FВодная фаза R4P+ FВодная фаза R4P+ FОрганическая фаза R4P+ F- + C8H17Cl C8H17F + R4P+ FОрганическая фаза Анион F- в орг. фазе мало сольватирован и («голый») потому очень активен поверхность раздела фаз водная фаза орг. фаза Иногда действует и «солевой эффект» МФК R4N+XPhCH=O орг. фаза PhCH=O + RCN водная фаза PhCH=O водная фаза PhCO-CH(OH)Ph Краун-эфиры и криптанды дибензо-12-краун-4 18-краун-6 криптанды H2O KMnO4 Краун-эфир H2O Краун-эфир K+ + Краун-эфир + K+ Бензол MnO4Бензол