Образовательный курс
реклама
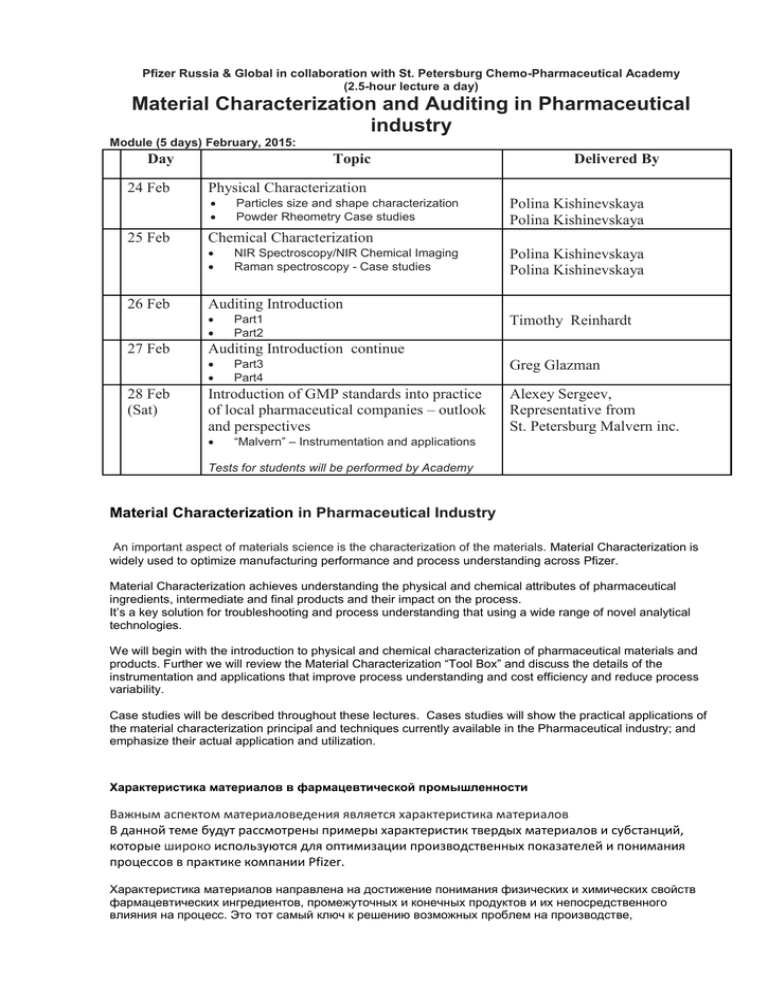
Pfizer Russia & Global in collaboration with St. Petersburg Chemo-Pharmaceutical Academy (2.5-hour lecture a day) Material Characterization and Auditing in Pharmaceutical industry Module (5 days) February, 2015: Day Topic 24 Feb Physical Characterization 25 Feb Polina Kishinevskaya Polina Kishinevskaya Part1 Part2 Timothy Reinhardt Auditing Introduction continue 28 Feb (Sat) NIR Spectroscopy/NIR Chemical Imaging Raman spectroscopy - Case studies Auditing Introduction 27 Feb Polina Kishinevskaya Polina Kishinevskaya Chemical Characterization 26 Feb Particles size and shape characterization Powder Rheometry Case studies Delivered By Part3 Part4 Introduction of GMP standards into practice of local pharmaceutical companies – outlook and perspectives Greg Glazman Alexey Sergeev, Representative from St. Petersburg Malvern inc. “Malvern” – Instrumentation and applications Tests for students will be performed by Academy Material Characterization in Pharmaceutical Industry An important aspect of materials science is the characterization of the materials. Material Characterization is widely used to optimize manufacturing performance and process understanding across Pfizer. Material Characterization achieves understanding the physical and chemical attributes of pharmaceutical ingredients, intermediate and final products and their impact on the process. It’s a key solution for troubleshooting and process understanding that using a wide range of novel analytical technologies. We will begin with the introduction to physical and chemical characterization of pharmaceutical materials and products. Further we will review the Material Characterization “Tool Box” and discuss the details of the instrumentation and applications that improve process understanding and cost efficiency and reduce process variability. Case studies will be described throughout these lectures. Cases studies will show the practical applications of the material characterization principal and techniques currently available in the Pharmaceutical industry; and emphasize their actual application and utilization. Характеристика материалов в фармацевтической промышленности Важным аспектом материаловедения является характеристика материалов В данной теме будут рассмотрены примеры характеристик твердых материалов и субстанций, которые широко используются для оптимизации производственных показателей и понимания процессов в практике компании Pfizer. Характеристика материалов направлена на достижение понимания физических и химических свойств фармацевтических ингредиентов, промежуточных и конечных продуктов и их непосредственного влияния на процесс. Это тот самый ключ к решению возможных проблем на производстве, используемый для диагностики и понимания процесса с помощью широкого спектра новейших аналитических технологий. Мы начнем с определения физических и химических характеристик фармацевтических материалов и изделий. В дальнейшем, мы будем рассматривать "Tool Box" –приборы и программы, используемые для определения искомых характеристик и обсудим их конкретные детали, которые улучшают понимание процесса и эффективность необходимых затрат и уменьшают возможную изменчивость процесса. Исследования по данной теме будут описаны во всех этих лекциях. Конкретные примеры покажут, практическое применение характеристики свойств материалов и методы анализа, доступные в настоящее время в фармацевтической промышленности; подчеркнут их фактическое применение и использование. Quality Auditing in Pharmaceutical Industry Auditing is a critical function within a pharmaceutical company. It provides with very important information about how effectively the company controls the quality of their processes and products. Auditing is a process for conducting periodic GMP / Quality System audits of suppliers, contractors, etc. It helps present the basic abilities and skills required to effectively perform the auditor's responsibilities and contribute to the improvement of auditor performance within a pharmaceutical industry. We will begin our lectures with the introduction to auditing. Further we will cover in details the quality audit process including preparation (Pre-Audit) and conducting of the audit. The important part is to identify critical components for an audit report. We will discuss how to write issue and follow up the audit report. The outcomes of our lectures will help the participants to learn and apply audit principles for internal and external quality audits. It will enhance knowledge of the GMP concepts and regulatory requirements related to auditing. Аудит качества в фармацевтической промышленности Аудит является важнейшей функцией в фармацевтической компании. Он предоставляет важнейшую информацию о том, как эффективно компания контролирует качество своих процессов и продуктов. Непосредственно аудит - это процесс проведения периодической проверки соответствия нормам GMP, а так же система оценки качества работы поставщиков, подрядчиков и т.д. Он помогает представить основные умения и навыки, необходимые для эффективного выполнения обязанностей аудитора, а также способствовать улучшению аудиторской производительности в фармацевтической промышленности. Мы начинаем наш лекционный модуль с введения в аудит. Далее мы расскажем в деталях процесс аудита качества, включая процесс подготовки (Пре-аудит) и проведение аудита. Важной частью является выявление решающих составляющих для аудиторского заключения. Мы обсудим, как сформулировать проблему и сделать законченный отчет. Результаты наших лекций помогут участникам изучить и применить принципы аудита для внутреннего и внешнего аудитов качества. Это повысит понимание системы норм GMP и других регулирующих требований, касающихся аудита в целом. ================================================== February Module 2015 – Bios Greg Glazman – Manager, Pfizer Global Quality Organization, Manufacturing & Supplier Quality Auditing group. Peapack, New Jersey, USA Greg joined Pfizer Global Manufacturing (PGS) at the Morris Plains, NJ site as a Project Manager in the Infrastructure and Architecture group in 2001. In 2011 he joined Global Quality Organization - Manufacturing & Supplier Quality Assessment (MSQA) group. Greg is a certified Pfizer MSQA site Quality Auditor and completed International Pharmaceutical Excipients Auditing program in Arlington, VA. He is responsible for management of various computerized systems and business applications. Greg provides technical guidance and training to the MSQA Auditors and other Pfizer colleagues. He is currently involved in managing implementation of the Global Audit Management System (gAMS) within MSQA. As a certified Auditor, Greg conducts number of Supplier Audits globally. Greg holds Master degree in Electrical Engineering from Belarussian National Technical University of Minsk, Belarus. Polina Kishinevskaya –Manager, Advanced Manufacturing Technology Group, PGS (Pfizer Global Supply) Peapack, NJ USA. Polina Kishinevskaya is working as a Manager in the Advanced Manufacturing Technology group at Pfizer Global Supply in NJ USA. Her responsibilities have included providing wide range of Analytical, Process Analytical Technology (PAT), materials characterization expertise and multivariate analysis for pharmaceutical products and processes understanding. Polina Kishinevskaya joined the Pfizer in 1999 where she has held a variety of positions within Pfizer Global Manufacturing Services, PGS organization. In addition to 12 years at Pfizer, Polina has worked with Johnson & Johnson and Medeva Pharmaceuticals Companies. Polina holds Master of Science Degree in Chemistry from the State University of Moldova and a Bachelor of Science from Rochester Institute of Technology, Rochester, NY USA. Timothy Reinhardt - Director Quality Assurance, Manufacturing & Supplier Quality Assessments (MSQA), PGS (Pfizer Global Supply) Tim started in the Pfizer network in 1999 at the La Jolla (Agouron) site and transferred to Morris Plains, NJ to work in Contract Operations Quality Assurance. Tim’s pharmaceutical experience includes the applications and regulations covering most dosage forms (sterile liquid, lyophilized and dry powder products, oral liquids, creams, tablets, transdermals), in addition to Active Pharmaceutical Ingredients (API) and medical devices. Tim has traveled throughout the world as a quality auditor. He also provides global auditing training sessions. Tim has been the Director of MSQA, (Pfizer global audit group) since 2010. Алексей Сергеев - Директор по регистрации. Алексей окончил 3-ий Московский Медицинский Университет с присвоением квалификации врача общей практики; впоследствии он получил специальность эндокринолога и работал в Центральной Клинической Больнице Администрации Президента. Затем Алексей завершил клиническую практику и работал в качестве эксперта Российского Комитета по фармакологии Министерства Здравоохранения. В последние 18 лет, Алексей работал в различных крупных фармацевтических компаний, таких, как Elli Lilly, Glenmark, ICN Фарма, SC Johnson, Верофарм с постоянным увеличением ответственности и развитием корпоративных отношений в медицинском сообществе. Алексей получил степень MBA в Международном Университете Монако.








