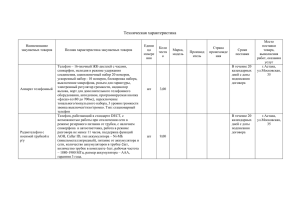
Вопрос 20. Химические источники тока, их классификация
реклама

Вопрос 20. Химические источники тока, их классификация, принцип действия и применение. Получение электрической энергии за счет химических реакций осуществляется в химических источниках постоянного тока (ХИТах), называемых гальваническими элементами (ГЭ). Они используются в транспортных двигателях, радиотехнических устройствах, приборах управления. Для создания такого элемента используют два металлических электрода. Электрод, на котором протекает процесс окисления, называется анодом. Им является более активный металл. Электрод, на котором протекает восстановление, носит название катода. При этом более активный металл с меньшим электродным потенциалом растворяется и переходит в раствор в виде ионов, а другой - из состояния ионов осаждается на электроде. Гальванические элементы – устройства одноразового действия. Их применяют в виде сухих батарей (соединенных последовательно нескольких гальванических элементов), герметизированных или наливных (в которые для работы заливают воду или электролит) со сроком действия 1- 2 года. Действие наиболее распространенного марганцово - цинкового элемента, выпускаемого в виде стаканчиков, галет и пуговиц, основано на химической реакции: 2Мn4+ + Zn о = 2Мn 3+ + Zn 2+. Цинковый стаканчик (анод) растворяется, а электролит (паста из хлорида аммония с добавлением муки или крахмала) взаимодействует с ионами цинка: 2Zn 2+ + 4NН4Сl = Zn [(N Н3)4]Сl2 +ZnСl 2 + 4Н+. Катод изготовлен из диоксида марганца МnО2, токоотводом является графитовый стержень. Батареи таких элементов выпускаются массой от 100 г до 200 кг, напряжением от 3 до 100 вольт. Аккумуляторами называются гальванические элементы многоразового действия, которые можно регенерировать, пропуская через них электрический ток (заряжать). Пластины свинцового аккумулятора (рис.2) представляют собой отливки из твердого свинца ячеистой структуры. В ячейки запрессовывают смесь оксида свинца с глицерином, которая со временем затвердевает. Пластины собирают в батареи и опускают в раствор серной кислоты плотностью 1,24 - 1,30 г/мл и массовой долей 3239%, а затем заряжают, пропуская электрический ток. Схема свинцового аккумулятора: Рb │ Н2SО4 │ РbО2 32-39% Рис.2. Схема свинцового аккумулятора. Химические реакции, представлены ниже: протекающие при работе свинцового аккумулятора, Анод: Рb о + SО4 2- - 2е = РbSО4 Катод: РbО2 + SО4 2- + 4Н+ + 2е = РbSО4 + 2Н2О ______________________________________________ разряд Рb о + РbО2 + Н2SО4 → 2РbSО4 + 2Н2О ← заряд Если аккумулятор не сразу используется, для хранения из него выливают электролит и промывают водой. При хранении с раствором серной кислоты незаряженных аккумуляторов происходит их «сульфатирование», т.е. образование на пластинах сульфата свинца, что ведет к разрядке аккумулятора. При разрядке концентрация кислоты уменьшается, а плотность растворов падает. По плотности раствора серной кислоты судят о степени разряженности аккумулятора. Разность потенциалов заряженного аккумулятора составляет 2,1 В. Преимуществами свинцового (кислотного) аккумулятора являются большое число циклов «разрядка - зарядка»(300 – 1000) и высокий КПД (80%). К недостаткам относятся большая масса, малый срок службы (2-5 лет), выделение водорода при зарядке (электролиз воды) и токсичность соединений свинца. Железно-никелевые и кадмиево-никелевые аккумуляторы называются щелочными, так как электролитом в них является 20 - 23% - ный раствор гидроксида калия (КОН). Их работа основана на следующих реакциях разряда ( → ) и заряда ( ← ): 2Ni (OH)3 + Cd 2Ni (OH)3 + Fe ↔ 2Ni(OH)2 + Cd(OH)2 ↔ 2Ni(OH)2 + Fe(OH)2 Достоинствами щелочных аккумуляторов является большой срок службы (10 лет) и высокая механическая прочность (число циклов составляет 500-2500). Однако, они имеют низкий КПД (65%) и невысокое напряжение. Такие аккумуляторы используются для питания магнитофонов и радиоприемников. В последние годы активно разрабатываются аккумуляторы с литиевым отрицательным электродом, неводным раствором электролита и положительным электродом, изготовленным на базе оксидов ванадия, никеля, кобальта и марганца. Выпускаются также литий-ионные аккумуляторы, в которых на катоде и аноде происходит интеркаляция (внедрение) ионов лития в слоистые кристаллические решетки вышеуказанных оксидов или графита. Параметры такого аккумулятора, схема которого представлена ниже LixC │ LiAsF6, │LixCoO2 органический растворитель составляют: среднее напряжение - 2,5-3 вольта; циклов наработки - 500; КПД - 60-70%. Если окислитель и восстановитель хранятся вне элемента и в процессе работы подаются к электродам, которые не расходуются, то элемент называется топливным (ТЭ). В таких элементах используются жидкие или газообразные восстановители (Н 2, СН4, СН3ОН), окислителем же является обычно кислород воздуха. В высокотемпературных топливных элементах при 500оС окисляются природные виды топлива (нефть, уголь, природный газ), а вместо водных растворов используются расплавы солей (Li2CO3, Na2CO3) или твердые электролиты (ZrO2 ,Y2O3). Анодом является никель, а катодом – оксид никеля. Топливные элементы не могут работать без вспомогательных устройств для подвода реагентов, отвода продуктов реакции и теплоты. Установка, состоящая из батарей ТЭ, систем хранения, обработки и подвода топлива и окислителя, поддержания и регулирования температуры, преобразования тока и напряжения, называется электрохимической установкой. Такие установки меньше загрязняют окружающую среду по сравнению с гальваническими элементами. Разработке их уделяется большое внимание в связи с использованием электромобилей, работающих на водороде или метаноле.