Календарно-тематическое планирование по химии (9 класс)
реклама
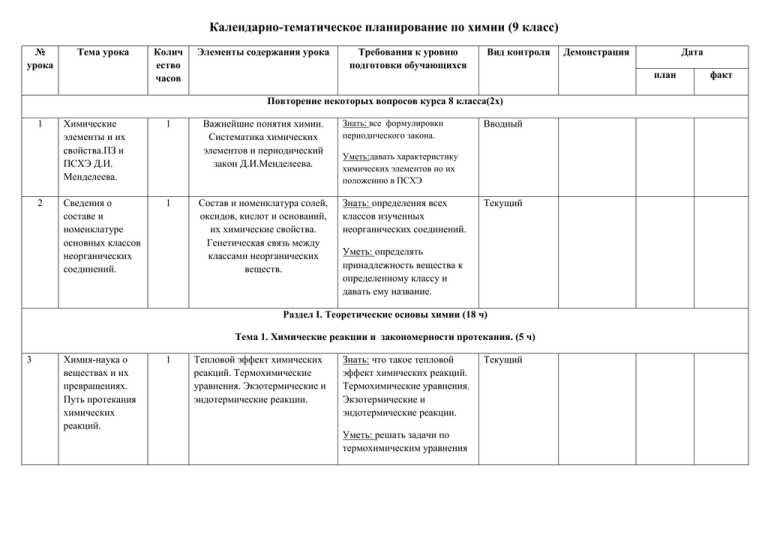
Календарно-тематическое планирование по химии (9 класс) № урока Тема урока Колич ество часов Элементы содержания урока Требования к уровню подготовки обучающихся Вид контроля 2 Химические элементы и их свойства.ПЗ и ПСХЭ Д.И. Менделеева. 1 Сведения о составе и номенклатуре основных классов неорганических соединений. 1 Важнейшие понятия химии. Систематика химических элементов и периодический закон Д.И.Менделеева. Состав и номенклатура солей, оксидов, кислот и оснований, их химические свойства. Генетическая связь между классами неорганических веществ. Знать: все формулировки периодического закона. Вводный Уметь:давать характеристику химических элементов по их положению в ПСХЭ Знать: определения всех классов изученных неорганических соединений. Текущий Уметь: определять принадлежность вещества к определенному классу и давать ему название. Раздел I. Теоретические основы химии (18 ч) Тема 1. Химические реакции и закономерности протекания. (5 ч) 3 Химия-наука о веществах и их превращениях. Путь протекания химических реакций. 1 Тепловой эффект химических реакций. Термохимические уравнения. Экзотермические и эндотермические реакции. Знать: что такое тепловой эффект химических реакций. Термохимические уравнения. Экзотермические и эндотермические реакции. Уметь: решать задачи по термохимическим уравнения Дата план Повторение некоторых вопросов курса 8 класса(2x) 1 Демонстрация Текущий факт 4 Скорость химических реакций. 1 Скорость в физике и химии. Определение скорости химических реакций. Факторы, влияющие на скорость реакций. Знать: Определение скорости химических реакций. Факторы, влияющие на скорость реакций Текущий Уметь: решать задачи на вычисление скорости химических реакций. 5 Решение задач 1 Задачи на избыток и недостаток 6 Химическое равновесие. 1 Реакции обратимые и необратимые. Химическое равновесие и его смещение. Текущий Знать: определения обратимых и необратимых реакций, химического равновесия; факторы, влияющие на смещение химического равновесия. Текущий Уметь: определять направление смещения химического равновесия. 7 Обобщение знаний по теме 1. Зависимость скорости реакции от концентрации, температуры, природы реагирующих веществ Влияние концентрации реагирующих веществ на химическое равновесие (взаимодействи е хлорида железа с роданидом калия) Проверочная работа. 1 Тема 2.Растворы. Теория электролитической диссоциации.(13ч) 8 Понятия о растворах. Теории растворов. 1 9 Вещества электролиты и неэлектролиты. 1 Вещества электролиты и неэлектролиты. Понятие об электролитической диссоциации. Причины диссоциации электролитов в Знать: определение электролитов и неэлектролитов. Уметь: составлять уравнения реакций диссоциации Текущий Сравнение электрической проводимости разных растворов 10 Диссоциация кислот, оснований и солей. 1 растворах и расплавах. электролитов. Механизм диссоциации веществ с различными типами связи. Роль молекул воды в диссоциации. Знать: механизм электролитической диссоциации веществ с ковалентной связью. Текущий Уметь: составлять уравнения реакций диссоциации электролитов. 11 Сильные и слабые электролиты. 1 Степень диссоциации. Сильные и слабые электролиты. Знать: определение степени диссоциации. Текущий Уметь: определять силу электролитов и рассчитывать степень диссоциации. 12 13 14 Реакции ионного обмена. Свойства ионов. 1 Химические свойства кислот как электролитов. 1 Химические свойства оснований как электролитов 1 Реакции ионного обмена и условия их необратимости. Составление молекулярных и ионных уравнений реакций между растворами электролитов. Знать: определение реакции ионного обмена и условия их необратимости. Текущий Реакции обмена между растворами эликтролитов Кислоты как электролиты. Химические свойства кислот в свете ТЭД. Знать: определение кислот как электролитов. Текущий Реакции обмена между растворами эликтролитов Основания как электролиты. Химические свойства оснований в свете ТЭД. Знать: определение оснований Текущий как электролитов. Реакции обмена между растворами эликтролитов Уметь: составлять молекулярных и ионных уравнений реакций между растворами электролитов. Уметь: характеризовать химические свойства кислот в свете ТЭД. Уметь: характеризовать химические свойства оснований в свете ТЭД. Химические свойства солей как электролитов 1 16 Гидролиз солей 1 17 Решение задач. 1 15 Соли как электролиты. Химические свойства солей в свете ТЭД. Знать: определение солей как электролитов. Текущий Уметь: характеризовать химические свойства солей в свете ТЭД. Гидротация и дегидротация ионов (на примере безводных солей и кристалогидрат ов) Решение задач по химическим уравнениям, если одно из реагирующих веществ в избытке. Знать: алгоритм решения задач по химическим уравнениям, Текущий если одно из реагирующих веществ в избытке. Уметь: решать задачи по химическим уравнениям, если одно из реагирующих веществ в избытке. 18 Обобщение знаний по теме. 1 19 Практическая работа № 1 «Решение экспериментальн 1 Реакции обмена между растворами эликтролитов Реакции ионного обмена и Знать: правила по ТБ, приемы условия их протекания до конца обращения с реактивами и оборудованием. Уметь: составлять уравнения Текущий ых задач» 20 Контрольная работа № 1 реакций ионного обмена. 1 Раздел II. Элементы-неметаллы и их важнейшие соединения (31 ч) Тема 3.Общая характеристика неметаллов (2ч) 21 Элементынеметаллы в ПСХЭ Д,И, Менделеева 1 22 Кристаллическое строение и физикохимические свойства неметаллов. 1 Образцы простых веществ неметаллов Подгруппа кислорода и её типичные представители (6 ч) 23 Общая характеристика неметаллов подгруппы кислорода. 1 24 Кислород. Озон. 1 Образцы простых веществ неметаллов Кислород. Озон. Знать: особенности строения кислорода и озона. Уметь: составлять уравнения химических реакций, характеризующих химические свойства кислорода и озона. Текущий Сера – представитель VIА группы. Аллотропия серы. Свойства и применение. 1 26 Сероводород. Сульфиды 1 27 Оксиды серы. Серная кислота и её соли. 25 28 Сера- история открытия, химический элемент и простое вещество, химические свойства и применение серы. Знать: историю открытия, характеристику химического элемента и простого вещества - серы, химические свойства и применение серы. Текущий Образцы простых веществ неметаллов Сульфаты. Качественная реакция на сульфат-ион. Знать: Сульфаты. Текущий Качественная реакция на сульфат-ион. Уметь: составлять уравнения химических реакций, характеризующих химические свойства сульфатов. Образцы соединений неметаллов 1 Оксиды серы (IV) и (VI). Физические и химические свойства, применение Знать: основные понятии по Текущий теме. Применение оксидов серы Уметь: составлять уравнения химических реакций, характеризующих химические свойства оксидов Взаимодействи е сахарозы и концентрирова нной серной кислоты. 1 Серная кислота и ее значение. Свойства разбавленной серной кислоты. Концентрированная серная кислота и ее свойства. Применение серной кислоты и ее солей. Знать: основные понятии по теме: «Серная кислота и ее значение. Свойства разбавленной серной кислоты», основные понятии по теме: «Концентрированная серная кислота и ее свойства. Сульфаты. Применение Образцы соединений неметаллов Уметь: составлять уравнения химических реакций, характеризующих химические свойства серы, решать по ним задачи изученных типов. Текущий Качественные реакции на анионы. серной кислоты и ее солей». Уметь: составлять уравнения химических реакций, характеризующих химические свойства разбавленной серной кислоты, решать по ним задачи изученных типов, составлять уравнения химических реакций, характеризующих химические свойства концентрированной серной кислоты, решать по ним задачи изученных типов. Подгруппа азота и её типичные представители(5ч) 29 30 Общая характеристика элементов подгруппы азота. Азотпредставитель VА группы. 1 Аммиак. Соли аммония. 1 Подгруппа азота, ее состав, особенности строения атомов элементов подгруппы. Простые вещества, образуемые элементами подгруппы и их свойства. Кислородсодержащие соединения и летучие водородные соединения, образованные элементами подгруппы. История открытия азота и его свойства. Роль азота в природе. Способы получения азота. Применение азота. Знать: характеристику подгруппы азота, свойства азота и других, простых и сложных веществ, образованных элементами подгруппы. История открытия аммиака и его свойства. Роль аммиака в природе. Способы получения аммиака. Применение аммиака. Соли аммония. Знать: строение молекулы, свойства, получение и применение аммиака. Текущий Образцы простых веществ неметаллов Текущий Образцы соединений Уметь: составлять уравнения химических реакций, характеризующих элементы подгруппы азота и их важнейшие соединения и решать задачи с их использованием. Уметь: составлять уравнения химических реакций, характеризующих аммиак и решать задачи с их использованием. 31 Оксиды азота. Азотная кислота. 1 Оксиды азота. Азотная кислота Знать: Оксиды азота. Азотная кислота и ее свойства. Фронтальный Уметь: составлять уравнения химических реакций, характеризующих свойства оксидов азота и раствора азотной кислоты. 32 Фосфор и его важнейшие соединения. 1 История открытия фосфора и его свойства. Аллотропные модификации фосфора. Роль фосфора в природе. Способы получения фосфора. Применение фосфора. Знать: строение атома и кристаллических решеток аллотропических модификаций фосфора, его физические и химические свойства, его получение и применение. Качественные реакции на анионы. Текущий Практическая работа № 2. «Получение аммиака и опыты с ним» 1 Свойства неметаллов и их соединений. Знать: ТБ. Свойства неметаллов и их соединений. Уметь: проводить химический эксперимент и оформлять его результаты. Образцы простых веществ неметаллов Получение белого фосфора и его возгорание на воздухе Уметь: составлять уравнения химических реакций, характеризующих фосфор и решать задачи с их использованием. 33 Образцы соединений Фронтальный Подгруппа углерода и её типичные представители (7 ч) 34 35 Общая характеристика подгруппы углерода. Углеродпредставитель IVА группы. Оксиды углерода. 1 1 Подгруппа углерода, ее состав, особенности строения атомов элементов подгруппы. Простые вещества, образуемые элементами подгруппы и их свойства. Кислородсодержащие соединения и летучие водородные соединения, образованные элементами подгруппы. История открытия углерода и его свойства. Аллотропные модификации углерода. Адсорбция. Роль углерода в природе. Способы получения углерода. Применение углерода. Знать: характеристику подгруппы углерода, свойства углерода и других, простых и сложных веществ, образованных элементами подгруппы. Знать: строение атома и кристаллических решеток аллотропических модификаций углерода, его физические и химические свойства, его получение и применение. Состав, строение, получение, свойства и применение оксидов углерода. Знать: состав, строение, получение, свойства и применение оксидов углерода. Текущий Образцы простых веществ неметаллов Восстановител ьные свойства углерода Уметь: составлять уравнения химических реакций, характеризующих элементы подгруппы углерода и их важнейшие соединения и решать задачи с их использованием. Уметь: составлять уравнения химических реакций, Текущий Образцы соединений Получение углекислого газа характеризующих оксиды углерода и решать задачи с их использованием. 36 Угольная кислота и её соли. 37 Обобщение знаний по темам 5,6 38 Решение задач. 39 Практическая работа № 3. Получение углекислого газа и изучение его свойств. 1 1 Угольная кислота: история открытия, получение, строение молекулы и свойства. Карбонаты. Применение угольной и крем ниевой кислоты и их солей. Знать: строение молекул, свойства, способы получения и области применения угольной кислоты и её солей. Получение углекислого газа и опыты с ним. Распознавание карбонатов. Знать: ТБ проведения химического эксперимента; способы получения и методы изучения углекислого газа; качественные реакции на карбонаты. Уметь: составлять уравнения химических реакций, характеризующих угольную кислоту и карбонаты и решать задачи с их использованием. Уметь: проводить химический эксперимент согласно Текущий Образцы соединений Качественные реакции на анионы. инструкции и грамотно оформлять его результаты. 40 Контрольная работа № 2 1 Общие сведения об органических соединениях (8ч) Органическая химия-отрасль химической науки. Особенности состава и многообразия органических соединений. 1 42 Практическая работа № 4 Определение качественного состава органического вещества 1 43 Теория химического строения органических соединений А.М. Бутлерова. 1 44 Понятие о предельных углеводородах. 1 41 Особенности строения органических веществ, причины их многообразия и особенности свойств. Знать: Особенности строения органических веществ, причины их многообразия и особенности свойств. Текущий Уметь: объяснять особенности строения органических веществ, причины их многообразия и особенности свойств. Понятие о предельных углеводородах. Гомологических рядах. Изомерия и номенклатура. Знать: понятие гомологического ряда.Строение метана, этилена и ацетилена. Текущий Модели молекул органических соединений Алканы. Свойства. нахождение в природе. Применение. Изомерия и номенклатура, свойства, нахождение в природе. Применение. Уметь: составлять изомеры молекул алканов, их названия; составлять уравнения реакций, характеризующих свойства алканов и решать задачи с их применением. 45 Физикохимические свойства и применение алканов. 1 46 Непредельные углеводороды . алканы. Алкины. Циклические углеводороды. 1 47 Кислородсодержа щие органические соединения. Спирты. Гомологические ряды спиртов и карбоновых кислот. 1 Взаимодействи е этилена с бромной водой и раствором перманганата Понятие о предельных одноатомных спиртах. Свойства и применение спиртов. Карбоновые кислоты. Знать: понятие гомологического ряда предельных одноатомных спиртов. Строение спиртов. Изомерия и номенклатура спиртов. Свойства спиртов. Применение спиртов. Уметь: составлять изомеры молекул спиртов, их названия; составлять уравнения реакций, характеризующих свойства Текущий Воспламенение спиртов Опыты подтверждающ ие свойства карбоновых кислот, реакция этерификации спиртов и решать задачи с их применением. 48 Биологически важные соединения – жиры. Углеводы. белки. 1 Понятие о жирах, их составе, классификации и применении. Понятие об углеводах, их составе, классификации и применении. Понятие о белках, их составе, структурах, свойствах, классификации и применении. Знать: строение и состав жиров, углеводов, белков, их классификацию, свойства, получение и применение. Текущий Модель молекулы белка. Денатурация белка. Текущий Образцы металлов и их соединений Текущий Модели кристаллическ их решеток Уметь: определять принадлежность жира к маслам или жирам, давать классификацию углеводов, : объяснять процессы, происходящие при денатурации белков. Раздел III. Металлы (14 ч) Тема 8. Общие свойства металлов (5ч) 49 Элементыметаллы в природе и в ПСХЭ д.И. Менделеева. 1 Положение металлов в ПСХЭ Д.И. Менделеева. Распространение в природе и получение металлов. Кислородные соединения металлов и их свойства. Знать: Положение металлов в ПСХЭ Д.И. Менделеева. Распространение в природе и получение металлов. Кислородные соединения металлов и их свойства. Уметь: давать характеристику металлов по их положениею в ПСХЭ, составлять уравнения химических реакций, характеризующих металлы и решать задачи с их использованием. 50 Кристаллическое строение и физико- 1 Металлическая химическая связь и металлическая кристаллическая решетка. Знать: характеристики и свойства металлической связи и металлической химические свойства металлов.. Физические. Понятие о сплавах, их классификации, получении, свойствах и применении кристаллической решетки; физические свойства металлов, определение и классификацию сплавов, способы их получения и области применения. металлов Уметь: объяснять физические и химические свойства металлов спецификой металлической связи и металлической кристаллической решетки; составлять уравнения химических реакций, характеризующих металлы и решать задачи с их использованием, распознавать сплавы. 51 Электролиз растворов и расплавов солей. 1 52 Сплавы. 1 53 Понятие о коррозии металлов. 1 Образцы сплавов Химические свойства металлов Понятие о коррозии металлов, ее видах и вредных последствиях. Методы борьбы с коррозией. Знать: химические свойства металлов, определение коррозии металлов, ее виды и способы защиты от нее. Уметь: составлять уравнения, описывающие процессы, происходящие при химической и электрохимической коррозии Текущий Опыты демонстрирую щие коррозию металлов, способы защиты от коррозии металлов. Тема 9. Металлы главных и побочных подгрупп (9ч) 54 Сравнительная характеристика металлов главных подгрупп. 1 55 Щелочные металлы и их соединения. 1 Особенности строения атомов элементов первой группы главной подгруппы и свойства, определяемые этим строением. Щелочные металлы, их распространенность и роль в природе. Простые вещества – щелочные металлы, их свойства и применение. Знать: Особенности строения атомов элементов первой группы главной подгруппы и свойства, определяемые этим строением, Щелочные металлы, их распространенность и роль в природе. Простые вещества – щелочные металлы, их свойства и применение. Образцы соединений Уметь: составлять уравнения химических реакций, характеризующих свойства простых веществ, образуемых s -элементами IА – группы. 56 Щелочноземельн ые металлы. Жесткость воды. 1 57 Алюминий. 1 Образцы соединений кальция История открытия алюминия и его свойства. Распространенность алюминия в природе. Способы получения алюминия. Соединения алюминия. Применение алюминия. История открытия железа и его свойства. Знать: строение атома алюминия и особенности свойств, определяемых этим строением, способы получения алюминия и области его применения, строение атома железа и особенности свойств, Текущий Свойства оксидов и гидроксидов алюминия 58,59 Железопредставитель металлов побочных подгрупп. 1 Распространенность железа в природе. Сплавы железа. Способы получения железа и его сплавов.. Применение железа и его сплавов. определяемых этим строением, способы получения железа и области его применения. Общие свойства металлов. Металлы главных и побочных подгрупп. Знать: особенности строения, химические свойства, способы получения и области применения металлов главных и побочных подгрупп и их соединений. Уметь: составлять уравнения химических реакций, характеризующих алюминий и решать задачи с их использованием, составлять уравнения химических реакций, характеризующих железа и решать задачи с их использованием. Уметь: составлять уравнения химических реакций, характеризующих металлы и их соединения и решать задачи с их использованием. 60 Обобщение знаний по темам 8,9 1 61 Решение задач 1 Свойства оксидов и гидроксидов железа. Качественная реакция на ионы железа 62 Практическая работа № 5 Решение экспериментальн ых задач по теме «Металлы» 1 63 Контрольная работа № 3 1 Итоговый Раздел V. Химия и жизнь (5 ч) Тема 10. Человек в мире веществ. (2ч) 64 Вещества вредные для здоровья человека и окружающей среды. Полимеры. 1 Фронтальный Ознакомление с образцами полимеров 65 Минеральные удобрения на вашем участке. 1 Фронтальный Распознание минеральных удобрений Тема 11. Производство неорганических веществ и их применение (3ч) 66 Понятие о химической технологии. Производство и применение серной кислоты. 1 67 Понятие о металлургии. Производство и применение 1 Модели производства серной кислоты Фронтальный Коллекция минералов и горных пород. чугуна и стали. 68 Производство неорганических веществ и окружающая среда. Образцы чугуна и стали 1