View Record in Scopus
реклама

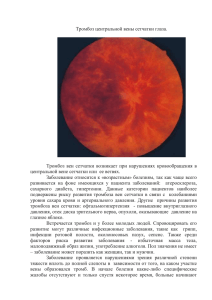
Optical coherence tomography: From physical principles to clinical applications Tomographie par cohérence optique : des principes physiques aux applications cliniques Righab Hamdan, , Ricardo Garcia Gonzalez, Said Ghostine, Christophe Caussin Show more doi:10.1016/j.acvd.2012.02.012 Get rights and content Under an Elsevier user license Open Archive Summary Optical coherence tomography is a new endocoronary imaging modality employing near infrared light, with very high axial resolution. We will review the physical principles, including the old time domain and newer Fourier domain generations, clinical applications, controversies and perspectives of optical coherence tomography. Résumé La tomographie par cohérence optique est une modalité d’imagerie récente endocoronaire utilisant la lumière infrarouge, caractérisée par une haute résolution. Dans cet article, on discute les principes physiques en discutant l’ancienne et la nouvelle génération de tomographie par cohérence optique, time domain et Fourier domain respectivement. Keywords Acute coronary syndrome; Atherosclerosis; Optical coherence tomography; Percutaneous angioplasty Mots clés Angioplastie percutanée; Athérosclérose; Tomographie par cohérence optique; Syndrome coronaire aigu Abbreviations FD-OCT, Fourier domain optical coherence tomography; IVUS, intravascular ultrasound; OCT, optical coherence tomography; TD-OCT, time domain optical coherence tomography Introduction Optical coherence tomography (OCT) is a new imaging modality, used for the first time by Huang et al. in 1991 in vitro on the human peripapillary region of the retina and coronary arteries [1]. OCT is based on near infrared light; an optical beam is directed at the tissues, most of the light scatters and only the small portion of this light that reflects from subsurface features is collected and forms the image by yielding spatial information about tissue microstructure. The critical advantage of OCT over ultrasonography and magnetic resonance imaging is due to its micrometer resolution (about 10–15 μm of tissue axial resolution) [2]. Physical principles and acquisition systems OCT uses low coherent near infrared light. The wavelength used is around 1300 nm to minimize energy absorption in the light beam caused by protein, water, haemoglobin and lipids [3]. The physics principle that allows the filtering of scattered light is optical coherence [4]. A light source emits a low-coherence, laser light wave. The light wave reaches a beam splitter or a partial mirror, which splits the light wave in half. One part of the light wave travels to a reference mirror, where it reflects directly back towards the beam splitter. The second part travels to the sample tissue. Depending on the optical properties of the tissue, some amount of light may be absorbed, refracted or reflected [5], [6], [7] and [8]. Reflection occurs when there is a region of sharp refractive index mismatch; therefore the velocity of light is not considered constant when it passes through different media. Light travels faster in a medium of low refractive index compared to a medium of high refractive index. The amount of reflection depends on the level of mismatch, the angle and the polarization of the incident angle. The reflected portion of the light travels back towards the beam splitter, where it meets with the reference light wave. The interaction between these two light waves is the basis on which OCT produces images [7]. When two light waves of the same wavelength and constant phase difference meet, they are combined through superposition; this phenomenon is called interference. If the light waves are in phase, they add together in constructive interference; if they are out of phase, they cancel each other out in destructive interference [7]. When the sample and reference light waves meet, they either intensify or diminish depending on how the sample light interacts with the tissue[8]. A detector uses the light or dark pattern produced to create a pixel for that specific region [6]. OCT crosssectional imaging is achieved by performing successive axial measurements of back-reflected light at different transverse positions. After scanning a whole area, a full image of the tissue may be produced. The major limitation of intracoronary OCT is blood attenuation due to the backscattering properties of red blood cells, thus we need to displace blood from the field of view. There are two OCT systems: the first-generation system or time domain OCT and the new-generation system or Fourier domain OCT. Time domain OCT Time domain OCT (TD-OCT) uses an occlusive technique that requires stopping of the coronary blood flow by soft balloon inflation [3], [9] and [10]. The pullback speed of TD-OCT ranges between 1 and 5 mm/s [11],[12], [13], [14] and [15]. TD-OCT uses a broadband light source containing a moving mirror that allows scanning of each depth position in the image, pixel by pixel. This mechanical scanning process limits the rate at which images can be acquired [3]. TD-OCT is limited by the risk of balloon injury, a balloon-vessel size mismatch, a long diseased lesion exceeding 30 mm, the inability to visualize ostial or very proximal lesions and the inability to study the left main coronary artery. Fourier domain OCT The development of the new-generation or Fourier domain OCT (FD-OCT) enables high-speed pullbacks (10–25 mm/second) during image acquisition, allowing the visualization of long coronary segments in a much reduced acquisition time and without the need for transient occlusion of the coronary artery. The nonocclusive technique requires simultaneous flushing with a viscous iso-osmolar solution through the guiding catheter [2]. The fluid infused requires a viscosity higher than that of blood; non-occlusive OCT image acquisition using iodixanol 320 is the standard flushing solution [2], [11], [12] and [15]. The amount of iodixanol 320 used for OCT pull-back is usually 3-fold greater than that required for standard coronary iodixanol 320. FD-OCT uses a wavelength-swept laser as the light source and the reference mirror is fixed. This change in technology results in a better signal-to-noise ratio and faster sweeps, allowing a dramatically faster image acquisition and pullback speed than TD-OCT [3], [16] and [17]. Presently, the maximum imaging speed that can be achieved with FD-OCT is limited by digital data transfer and storage [18]. OCT versus intravascular ultrasound Many trials have compared OCT with intravascular ultrasound (IVUS) for tissue characterization of human coronary plaques. OCT is mainly limited by its penetration depth. Within its penetration depth OCT has much higher sensitivity and specificity for characterizing calcification, fibrosis, lipid pool intimal hyperplasia[19] and [20], fibrous cap erosion and rupture, intracoronary thrombus and thin cap fibroatheroma [21] (Fig. 1), for the detection of stent endothelialization, strut coverage and stent apposition and expansion, and for lumen border visualization and measurement of correct lumen area [22]. As for IVUS, the critical lumen area for intermediate lesions is 4 mm 2[2]. Measurements of lumen diameter and lumen area obtained with OCT and IVUS were highly correlated, although OCT measurements were found to be 7% smaller [2]; these findings may be more relevant in small vessels. Compared with OCT, IVUS tends to underestimate stent tissue coverage [23]. Table 1 shows the physical properties of IVUS and OCT. Figure 1. Higher optical coherence tomography resolution and sensitivity for plaque definition. Figure options Table 1. Physical properties of optical coherence tomography and intravascular ultrasound. IVUS OCT Wavelength (μm) 35–80 1.3 Energy source Ultrasound Infrared Penetration (mm) 10 1–2.5 Axial resolution (μm) 100–200 15–20 Lateral resolution (μm) 200–300 20–40 IVUS: intravascular ultrasound; OCT: optical coherence tomography. Table options Clinical applications Coronary plaque classification OCT was validated in vitro for atherosclerotic plaque characterization on a large post-mortem specimen in 2002 [24] and later in vivo human studies confirmed the ability of OCT to characterize the plaque [20]: fibrous plaques are characterized by a homogeneous rich signal; fibrocalcific plaques reveal signal-poor regions with sharply delineated borders; lipid-rich plaques show diffusely bordered signal-poor regions (lipid is present in two quadrants in any of the images within a plaque); vulnerable plaques are characterized by a thin-capped fibroatheroma, defined as a fibrous cap thickness < 70 μm (Fig. 1), within a lipid-rich plaque; microchannels are defined as no-signal tubuloluminal structures without a connection to the vessel lumen, recognized on three consecutive cross-sectional OCT images [2] and [14], and are seen with increased neovascularization of atherosclerotic plaque (Fig. 2). Fig. 3 shows a typically stable and calcified coronary plaque with thick fibrous cap. Figure 2. Neo-channels (black arrow) could be visualized within the plaque in some of our acute coronary syndrome patients. Figure options Figure 3. A typically stable coronary plaque, calcified with a thick fibrous cap. Figure options Acute coronary syndromes In the setting of acute coronary syndromes, OCT is feasible and can yield, in addition to plaque description, the following information [21], [25] and [26]: plaque rupture, identified by the presence of fibrous cap discontinuity and a cavity formation within the plaque (Fig. 4); plaque erosion, characterized by loss of the endothelial lining with lacerations of the superficial intimal layers and without ‘trans-cap’ ruptures; intracoronary thrombus (a red thrombus is visualized as a hypersignal protruding in the lumen, with a signal- free posterior shadowing due to attenuation of the optical beam by red blood cells; a white thrombus does not contain red blood cells and can be thus fully visualized with OCT [Fig. 5]). Figure 4. A plaque rupture site (arrow) with cavity formation within the plaque. Figure options Figure 5. (A) A red thrombus with a signal-free posterior shadowing; (B) A white thrombus fully visualized. Figure options Percutaneous coronary intervention and stent implantation Another domain of interest for endocoronary OCT is percutaneous transluminal angioplasty and stent implantation. OCT was able to assess in-stent restenosis, in-stent thrombosis and strut coverage in bioresorbable everolimus stents at 6 months and 1 and 3 years [27], [28] and [29]. The vascular response (stent apposition and endothelialization) after drug-eluting stent and bare-metal stent implantation between stable and unstable angina pectoris patients was also successfully assessed by OCT [30], [31],[32] and [33]. OCT analysed the impact of stent strut thickness and the design of different drug-eluting stents on acute stent strut apposition [34]. Vessel injury (tissue prolapse, luminal protrusion and intrastent dissection) after stent implantation can be detected by OCT [35] and [36]. Fig. 6 shows an example of strut malapposition revealed with OCT. Figure 6. Localized malapposition of a drug-eluting stent. Figure options The reproducibility of quantitative OCT for stent analysis has been studied and showed excellent inter- and intraobserver variability for strut count, strut apposition and strut tissue coverage measurements [37]. Indications and clinical implications Before or after stent implantation? When OCT is performed in the setting of percutaneous angioplasty, it is to be done as for IVUS, before stent implantation, to accurately measure the vessel dimensions and cross-sectional areas, and after stent implantation, to detect good stent expansion and apposition short term and good stent endothelialization long term. For stable angina patients or during acute coronary syndrome? OCT is helpful in some stable angina patients for assessing the atherosclerotic plaque burden and detecting markers of plaque instability, which should indicate the need for aggressive medical therapy as well as percutaneous angioplasty and stent implantation. Most interesting is the use of OCT in the setting of acute coronary syndrome, especially to detect and measure the thrombus burden and analyse the underlying plaque. Implications OCT can potentially lead to a change in strategies, especially in the setting of acute myocardial infarction. Regarding the recently developed minimally invasive strategy for acute myocardial infarction, consisting of a conservative strategy after thrombus aspiration in Myocardial Infarction and TIMI grade III flow restoration, OCT can document and support this strategy by showing the thrombus component of the residual luminal narrowing and by studying the underlying plaque. This can avoid or delay systematic stent implantation in a prothrombotic context. Controversies Haemorrhagic components appear as signal-poor OCT regions, thus distinguishing haemorrhage from lipid necrotic pools is difficult [2]. Validation studies of angiogenesis identification are still lacking, although there is a general consensus that OCT should be able to identify microvessels [2] and [14]. OCT is a costly technique that is not available in all catheterization centres but it appears to be cost effective, although there are still no international guidelines regarding OCT, because the large OCT trials studied its diagnostic impact; recently, trials studying therapeutic decisions guided by OCT have been published and others are still ongoing. The lack of international guidelines is mainly due the fact that this is a recently developedimaging modality. Perspectives In vivo intracardiac OCT imaging on a swine model through percutaneous access was able to acquire highquality OCT images [38]. OCT assessed depolarization-related artefacts induced by the birefringence of myocardium and readily evaluated catheter-tissue contact. This is a critical step toward image-guided radiofrequency ablation in a clinical setting, indicating that OCT could be a promising technique for in vivo guidance of radiofrequency ablation. Transplant allograft vascular disease is characterized by diffuse concentric fibrointimal proliferation. Coronary angiography underestimates the extent of the disease. OCT has the potential to become an appropriate imaging tool for monitoring the effects of preventive treatments and disease progression [2]. Disclosure of interest The authors declare that they have no conflicts of interest concerning this article. References 1. o [1] o D. Huang, E.A. Swanson, C.P. Lin, et al. o Optical coherence tomography o Science, 254 (1991), pp. 1178–1181 o View Record in Scopus | Citing articles (6610) 2. o [2] o F. Prati, E. Regar, G.S. Mintz, et al. o Expert review document on methodology, terminology, and clinical applications of optical coherence tomography: physical principles, methodology of image acquisition, and clinical application for assessment of coronary arteries and atherosclerosis o Eur Heart J, 31 (2010), pp. 401–415 o View Record in Scopus | Full Text via CrossRef | Citing articles (223) 3. o [3] o N. Gonzalo, G.J. Tearney, P.W. Serruys, et al. o Second-generation optical coherence tomography in clinical practice. High-speed data acquisition is highly reproducible in patients undergoing percutaneous coronary intervention o Rev Esp Cardiol, 63 (2010), pp. 893–903 o Article | PDF (323 K) | View Record in Scopus | Citing articles (27) 4. o [4] o M. Born, E. Wolf o Principles of optics: Electromagnetic theory of propagation. Interference and diffraction of light o Cambridge University Press, Cambridge (2008) o 5. o [5] o V. Gupta, A. Gupta, M.R. Gogra o Optical coherence tomography of macular diseases o Taylor and Francis, New York (2004) o 6. o [6] o C.A. Puliafto, J.S. Schuman, H.M. R, et al. o Optical coherence tomography of optical diseases o Thorofare, NJ, SLACK (1996) o 7. o [7] o J.S. Schuman, C.A. Puliafto, J.G. Fujimoto o Everyday OCT: A handbook for clinicians and technicians o Thorofare, NJ, SLACK (2006) o 8. o [8] o R.A. Serway, J.W. Jewett Jr. o Physics for scientists and engineers with modern physics o Thomson Brooks/Cole, Belmont, CA (2004) o 9. o [9] o T. Okamura, N. Gonzalo, J.L. Gutierrez-Chico, et al. o Reproducibility of coronary Fourier domain optical coherence tomography: quantitative analysis of in vivo stented coronary arteries using three different software packages o EuroIntervention, 6 (2010), pp. 371–379 o View Record in Scopus | Full Text via CrossRef | Citing articles (29) 10. o [10] o S. Takarada, T. Imanishi, Y. Liu, et al. o Advantage of next-generation frequency-domain optical coherence tomography compared with conventional time domain system in the assessment of coronary lesion o Catheter Cardiovasc Interv, 75 (2010), pp. 202–206 o View Record in Scopus | Full Text via CrossRef | Citing articles (68) 11. o [11] o P. Barlis, E. Regar, P.W. Serruys, et al. o An optical coherence tomography study of a biodegradable vs. durable polymer-coated limus-eluting stent: a LEADERS trial sub-study o Eur Heart J, 31 (2010), pp. 165–176 o View Record in Scopus | Full Text via CrossRef | Citing articles (139) 12. o [12] o G. Ferrante, A.V. Kaplan, C. Di Mario o Assessment with optical coherence tomography of a new strategy for bifurcational lesion treatment: the Tryton Side-Branch Stent o Catheter Cardiovasc Interv, 73 (2009), pp. 69–72 o View Record in Scopus | Full Text via CrossRef | Citing articles (7) 13. o [13] o H. Kataiwa, A. Tanaka, H. Kitabata, et al. o Safety and usefulness of non-occlusion image acquisition technique for optical coherence tomography o Circ J, 72 (2008), pp. 1536–1537 o View Record in Scopus | Full Text via CrossRef | Citing articles (46) 14. o [14] o H. Kitabata, A. Tanaka, T. Kubo, et al. o Relation of microchannel structure identified by optical coherence tomography to plaque vulnerability in patients with coronary artery disease o Am J Cardiol, 105 (2010), pp. 1673–1677 o 15. o [15] o F. Prati, M. Cera, V. Ramazzotti, et al. o From bench to bedside: a novel technique of acquiring OCT images o Circ J, 72 (2008), pp. 839–843 o View Record in Scopus | Full Text via CrossRef | Citing articles (64) 16. o [16] o M. Choma, M. Sarunic, C. Yang, et al. o Sensitivity advantage of swept source and Fourier domain optical coherence tomography o Opt Express, 11 (2003), pp. 2183–2189 o View Record in Scopus | Full Text via CrossRef | Citing articles (959) 17. o [17] o B. Liu, M.E. Brezinski o Theoretical and practical considerations on detection performance of time domain Fourier domain, and swept source optical coherence tomography o J Biomed Opt, 12 (2007), p. 044007 o Full Text via CrossRef o [18] o B.E. Bouma, S.H. Yun, B.J. Vakoc, et al. o Fourier domain optical coherence tomography: recent advances toward clinical utility o Curr Opin Biotechnol, 20 (2009), pp. 111–118 o Article 18. | PDF (2470 K) | View Record in Scopus | Citing articles (36) 19. o [19] o M. Kawasaki, B.E. Bouma, J. Bressner, et al. o Diagnostic accuracy of optical coherence tomography and integrated backscatter intravascular ultrasound images for tissue characterization of human coronary plaques o J Am Coll Cardiol, 48 (2006), pp. 81–88 o Article | PDF (361 K) | View Record in Scopus | Citing articles (109) 20. o [20] o D. Stamper, N.J. Weissman, M. Brezinski o Plaque characterization with optical coherence tomography o J Am Coll Cardiol, 47 (2006), pp. C69–C79 o Article | PDF (2439 K) | View Record in Scopus | Citing articles (64) 1. o [21] o T. Kubo, T. Imanishi, S. Takarada, et al. o Assessment of culprit lesion morphology in acute myocardial infarction: ability of optical coherence tomography compared with intravascular ultrasound and coronary angioscopy o J Am Coll Cardiol, 50 (2007), pp. 933–939 o Article | PDF (471 K) | View Record in Scopus | Citing articles (320) 2. o [22] o T. Yamaguchi, M. Terashima, T. Akasaka, et al. o Safety and feasibility of an intravascular optical coherence tomography image wire system in the clinical setting o Am J Cardiol, 101 (2008), pp. 562–567 o Article | PDF (1318 K) | View Record in Scopus | Citing articles (82) 3. o [23] o D. Capodanno, F. Prati, T. Pawlowsky, et al. o Comparison of optical coherence tomography and intravascular ultrasound for the assessment of instent tissue coverage after stent implantation o EuroIntervention, 5 (2009), pp. 538–543 o View Record in Scopus | Full Text via CrossRef | Citing articles (30) 4. o [24] o H. Yabushita, B.E. Bouma, S.L. Houser, et al. o Characterization of human atherosclerosis by optical coherence tomography o Circulation, 106 (2002), pp. 1640–1645 o View Record in Scopus | Full Text via CrossRef | Citing articles (540) 5. o [25] o T. Kubo, T. Imanishi, M. Kashiwagi, et al. o Multiple coronary lesion instability in patients with acute myocardial infarction as determined by optical coherence tomography o Am J Cardiol, 105 (2010), pp. 318–322 o Article | PDF (951 K) | View Record in Scopus | Citing articles (41) 6. o [26] o A. Tanaka, T. Imanishi, H. Kitabata, et al. o Distribution and frequency of thin-capped fibroatheromas and ruptured plaques in the entire culprit coronary artery in patients with acute coronary syndrome as determined by optical coherence tomography o Am J Cardiol, 102 (2008), pp. 975–979 o Article | PDF (677 K) | View Record in Scopus | Citing articles (53) 7. o [27] o Y. Onuma, P.W. Serruys, J.A. Ormiston, et al. o Three-year results of clinical follow-up after a bioresorbable everolimus-eluting scaffold in patients with de novo coronary artery disease: the ABSORB trial o EuroIntervention, 6 (2010), pp. 447–453 o View Record in Scopus | Full Text via CrossRef | Citing articles (50) 8. o [28] o J.A. Ormiston, P.W. Serruys, E. Regar, et al. o A bioabsorbable everolimus-eluting coronary stent system for patients with single de novo coronary artery lesions (ABSORB): a prospective open-label trial o Lancet, 371 (2008), pp. 899–907 o Article | PDF (399 K) | View Record in Scopus | Citing articles (315) 9. o [29] o P.W. Serruys, J.A. Ormiston, Y. Onuma, et al. o A bioabsorbable everolimus-eluting coronary stent system (ABSORB): 2-year outcomes and results from multiple imaging methods o Lancet, 373 (2009), pp. 897–910 o Article | PDF (1627 K) | View Record in Scopus | Citing articles (382) 10. o [30] o G. Guagliumi, G. Musumeci, V. Sirbu, et al. o Optical coherence tomography assessment of in vivo vascular response after implantation of overlapping bare-metal and drug-eluting stents o J Am Coll Cardiol Cardiovasc Interv, 3 (2010), pp. 531–539 o Article | PDF (1869 K) | View Record in Scopus | Citing articles (97) 11. o [31] o T. Kubo, T. Imanishi, H. Kitabata, et al. o Comparison of vascular response after sirolimus-eluting stent implantation between patients with unstable and stable angina pectoris: a serial optical coherence tomography study o J Am Coll Cardiol Cardiovasc Imaging, 1 (2008), pp. 475–484 o Article | PDF (2819 K) | View Record in Scopus | Citing articles (86) 12. o [32] o H. Kyono, G. Guagliumi, V. Sirbu, et al. o Optical coherence tomography (OCT) strut-level analysis of drug-eluting stents (DES) in human coronary bifurcations o EuroIntervention, 6 (2010), pp. 69–77 o View Record in Scopus | Full Text via CrossRef | Citing articles (22) 13. o [33] o P. Motreff, G. Souteyrand, S. Levesque, et al. o Comparative analysis of neointimal coverage with paclitaxel and zotarolimus drug-eluting stents, using optical coherence tomography 6 months after implantation o Arch Cardiovasc Dis, 102 (2009), pp. 617–624 o Article | PDF (1060 K) | View Record in Scopus | Citing articles (17) 14. o [34] o J. Tanigawa, P. Barlis, K. Dimopoulos, et al. o The influence of strut thickness and cell design on immediate apposition of drug-eluting stents assessed by optical coherence tomography o Int J Cardiol, 134 (2009), pp. 180–188 o Article | PDF (1255 K) | View Record in Scopus | Citing articles (84) 15. o [35] o N. Gonzalo, P.W. Serruys, T. Okamura, et al. o Optical coherence tomography assessment of the acute effects of stent implantation on the vessel wall: a systematic quantitative approach o Heart, 95 (2009), pp. 1913–1919 o View Record in Scopus | Full Text via CrossRef | Citing articles (77) 16. o [36] o P. Moore, P. Barlis, J. Spiro, et al. o A randomized optical coherence tomography study of coronary stent strut coverage and luminal protrusion with rapamycin-eluting stents o JACC Cardiovasc Interv, 2 (2009), pp. 437–444 o Article | PDF (1100 K) | View Record in Scopus | Citing articles (47) 17. o [37] o N. Gonzalo, H.M. Garcia-Garcia, P.W. Serruys, et al. o Reproducibility of quantitative optical coherence tomography for stent analysis o EuroIntervention, 5 (2009), pp. 224–232 o View Record in Scopus | Full Text via CrossRef | Citing articles (64) 18. o [38] o H. Wang, W. Kang, T. Carrigan, et al. o In vivo intracardiac optical coherence tomography imaging through percutaneous access: toward image-guided radiofrequency ablation o J Biomed Opt, 16 (2011), p. 110505 o View Record in Scopus | Full Text via CrossRef | Citing articles (5) Оптическая когерентная томография ОКТ (оптическая когерентная томография, optical coherence tomography, OCT) - это метод офтальмологического исследования, позволяющий получать прижизненные изображения оптически прозрачных тканей глаза с высоким пространственным разрешением. Физический принцип работы ОКТ аналогичен ультразвуковому принципу, с той лишь разницей, что в когерентной томографии для зондирования биоткани применяются не акустические (звуковые) волны, а оптическое излучение ближнего инфракрасного диапазона (843 нм). Излучение зондирующего пучка концентрируется на ткани, а эхо-задержка зондирующего излучения измеряется интерферометрически и отражается от внутренней микроструктуры биоткани на разных глубинах. Совместно со сканированием в глубину производится сканирование поперек поверхности ткани специальным зондирующим пучком, что дает возможность получить поперечную развертку ОКТизображения. Полученные в результате исследования данные формируются в двухмерную карту обратного отражения или рассеяния от оптических микроскопических неоднородностей биоткани (клеточных структур ткани). Другими словами, оптические томограммы, по своей сути, содержат данные о морфологическом строении оптически прозрачных тканей. Метод оптической когерентной томографии обеспечивает возможность ранней и точной диагностики целого спектра социально значимых глазных болезней: макулярного разрыва, эпиретинальной мембраны, сенильной макулярной дистрофии, субретинальной неоваскулярной мембраны, макулярного отека, глаукомы (по толщине слоя нервных волокон сетчатки), расслоения сетчатки - ретиношизиса, центральной серозной хориоретинопатии, расслоения сетчатки - ретиношизиса, поражений зрительного нерва. Метод OCT биотканей предполагает использование высокочувствительных волоконных интерферометров, которые дают возможность распознать полезный сигнал, отражаемый оптической неоднородностью в глубине объекта и ослабляемый за счет сильного рассеивания в миллионы раз. Оптическую когерентную томографию отличает быстрота получения информации, неинвазивность, высокое пространственное разрешение. Оптические когерентные томографы условно разделяют на два вида: - оптические когерентные томографы, предназначенные для сканирования заднего отрезка глаза, оптические когерентные томографы для переднего отрезка глаза. В последних моделях томографов возможности сканирования переднего и заднего отрезка глаз часто объединяют в одном приборе. Исследование заднего отрезка дает возможность определить состояние зрительного нерва - глубину, относительную и абсолютную ширину углубления (экскавации) диска зрительного нерва, сетчатки и прилежащего стекловидного тела. Методика позволяет многократно повторять исследования и сохранять полученные результаты, тем самым давая возможность проследить динамику патологического процесса. Исследование переднего отрезка глаза стало возможным сравнительно недавно. Свое распространение метод получил в процессе оценки состояния иридоцилиарной зоны в послеоперационном и дооперационном периодах. Стандартные методики, такие как биомикроскопия или прямое офтальмоскопирование применяться на данном участке не могут. Процедура может быть затруднительной у пациентов с глубокой посадкой глаз. ОКТ может с максимальной точностью измерить толщину роговицы(пахиметрия) на всем ее протяжении, глубину передней камеры глаза на любом интересующем отрезке, измерить внутренний диаметр передней камеры, а также с высокой точностью определить профиль угла передней камеры и измерить его ширину. Также ОСT переднего отрезка чрезвычайно полезна для анатомической оценки результатов операций по поводу глаукомы. ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ СЕТЧАТКИ 21 апреля 2010 г. Сосновский В.В. к.м.н., врач-офтальмолог Центра диагностики и хирургии заднего отдела глаза В настоящее время современнуюофтальмологию уже сложно представить без такого метода исследования состояния сетчатки, какоптическая когерентная томография (ОКТ или OCT– аббревиатура от англ. optical coherence tomography). Приоритет в разработке физических принципов метода ОКТ, а также его внедрение в клиническую практику принадлежит американским ученым. Сегодня ОКТ активно используют в различных областях медицины (кардиология, стоматология, гастроэнтерология, урология, дерматология и др.), однако наиболее широко возможности метода реализованы в офтальмологии, что обусловлено прозрачностью оптических сред глаза и сетчатки. В основе действия ОКТ лежит измерение времени задержки светового луча, отраженного от исследуемой ткани. Источником излучения в современных приборах ОКТ (spectral domain OCT) является широкополосный суперлюминесцентный светодиод. В ходе исследования световой импульс делится надвое, при этом одна его часть отражается от исследуемого объекта, а другая (контрольная), от специального отражающего зеркала. Затем прибор суммирует отраженные сигналы, что вызывает эффект интерференции. Полученная информация обрабатывается с помощью сложного математического алгоритма и формируется так называемый скан исследуемой области, который, по аналогии с ультразвуковым исследованием, получил название А-скана. За счет использования принципиально нового принципа преобразования полученных данных и ряда технических нововведений, современные приборы ОКТ позволяют получить более 25 тысяч линейных сканов за 1 секунду. При этом разрешающая способность метода в аксиальном (переднезаднем) направлении достигает 3-8 мкм1, а в поперечном лежит в диапазоне от 10 до 15 мкм, что значительно превышает возможности современных ультразвуковых методов исследования. За счет высокой скорости сканирования и получения большого объема информации в ходе исследования, современные ОКТ сканеры способны формировать трехмерное изображение исследуемой области. Столь высокое пространственное разрешение ОКТ дает возможность фактически проводить прижизненную микроскопию исследуемой ткани. ОКТ позволяет диагностировать такие тонкие изменения структуры сетчатки, которые лежат вне пределов разрешения других методов исследования и просто невидимы при осмотре глазного дна (офтальмоскопии). В офтальмологической практике возможности современных ОКТ сканеров широко используются в диагностике и мониторинге прежде всего патологии макулярной области сетчатки и зрительного нерва, некоторые приборы позволяют проводить исследование переднего отрезка глаза. Рис. 1. Линейный скан макулярной области сетчатки в норме. Прибор представляет черно-белое изображение прозрачной сетчатки. Для удобства восприятия изображение приведено в псевдоцветной шкале, где структуры с большей оптической плотностью окрашены в красный цвет. Скан получен с помощью оптического когерентного томографа RTVue100 фирмы Optovue (США). Рис. 2. Трехмерная реконструкция макулярной области сетчатки глаза того же пациента (3 х 3 мм), полученная в результате обработки более тысячи единичных линейных сканов. Рис. 3. Трехмерная реконструкция области диска зрительного нерва (оптический срез проходит через зрительный нерв). Рис. 4. Используя нормативную базу данных, основанную на исследовании большого числа пациентов и несколько протоколов исследования, томограф RTVue-100 позволяет анализировать анатомические особенности зрительного нерва (глубина и конфигурация экскавации, толщина слоя нервных волокон сетчатки). ОКТ дает возможность получить данные о состоянии зрительного нерва, например, при глаукоме, оценить наличие прогрессирования глаукомного процесса и оценить эффективность проводимого лечения в динамике. Ниже приведены клинические примерыдиагностическойценности ОКТпри различной патологиисетчатки. Рис. 5. Сквозное сенильное (возрастное) макулярное отверстие. Линейный скан через область фовеа. Диаметр отверстия у вершины 513 мкм. Рис. 6. Трехмерная реконструкция макулярной области сетчатки того же пациента. Хорошо визуализируются псевдокистозные изменения в слоях сетчатки вокруг отверстия. Рис. 7. ОКТ того же пациента до и после хирургического лечения (витрэктомия). Отверстие закрылось. Анатомия макулярной областивосстановлена. Отек и кистозные изменения вокруг отверстия претерпели обратное развитие. Рис. 8. ОКТ пациента с влажной формой возрастной макулярной дегенерации до лечения и после одной инъекции антиангиогенного препарата. Рис. 9. ОКТ пациента с кистозным макулярным отеком после тромбоза верхневисочной ветви центральной вены сетчатки (до и после однократной инъекции кеналога в стекловидное тело). Рис. 10. Карта толщины сетчатки тоже пациента, которая позволяет оценить изменение толщины сетчатки в мкм по различным секторам. Этот протокол очень удобен для оценки эффективности проводимого лечения в динамике. Таким образом, методОКТ позволяет получать уникальную информацию об анатомии исследуемой структурысетчатки на микроскопическом уровне. Метод является бесконтактным, процедура безопасна и безболезненна. Возможности современных оптических когерентных томографов позволяют строить трехмерные модели исследуемой области сетчатки, карты толщин, проводить объективную оценку в динамике, что открывает принципиально новые возможности в диагностике и лечении сетчатки. Примечания 1. Мкм (микрометр): 1 мкм = 10-6 м (1 мкм соответствует одной тысячной мм). 2. Полноразмерные изображения, использованные в статье, можно СКАЧАТЬ ЗДЕСЬ. Клиническая оптическая когерентная томография сетчатки в норме 25 Октября в 9:53 1228 0 При офтальмоскопии нормального глазного дна определяется достаточно яркий фовеолярный рефлекс, свидетельствующий о сохранении контура центральной ямки. Сосуды сетчатки в ряде случаев имеют умеренные гипертонические и атеросклеротические изменения. В стекловидном теле встречается нитчатая деструкция, как вариант возрастной нормы возможно плавающее в проекции диска зрительного нерва кольцо Weiss, которое свидетельствует о полной задней отслойке стекловидного тела. В норме на ОСТ определяется правильный профиль макулы с углублением в центре (рис. 1). Слои сетчатки дифференцируются согласно своей светоотражающей способности, равномерные по толщине, без очаговых изменений. Можно выделить слой нервных волокон, внутренний сетчатый слой, наружный сетчатый слой, фоторецепторы и хориоидею. Наружный край сетчатки на ОСТ ограничен высоко фоторефлектирующим ярко-красным слоем толщиной около 70 мкм. Он представляет собой единый комплекс пигментного эпителия сетчатки и хориокапилляров. Более темная полоса, которая определяется на томограмме непосредственно перед комплексом «ПЭС/хориокапилляры», представлена фоторецепторами. Ярко-красная линия на внутренней поверхности сетчатки соответствует слою нервных волокон. Рис. 1. Макула в норме. А. Биомикроскопия макулы пациента в возрасте 42 лет. Соотношение толщины артерий к толщине вен равно 2:3. Фовеолярный рефлекс сохранен. Отсутствуют очаговые изменения. Б. ОСТ нормальной макулярной области. Слои сетчатки четко дифференцируются. Центральная ямка хорошо выражена. Толщина сетчатки в центральной ямке желтого пятна составляет 161 мкм, у края фовеа — 254 мкм. Стекловидное тело в норме оптически прозрачно и на томограмме имеет черный цвет. Резкий контраст между окрашиванием тканей позволил производить измерение толщины сетчатки. В области центральной ямки желтого пятна она составила в среднем около 162 мкм, у края фовеа — 235 мкм. Не выявлено достоверной зависимости толщины сетчатки от возраста как в центре фовеола, так и по краю фовеа. Тем не менее, отмечено, что у мужчин толщина макулярной сетчатки достоверно больше, чем у женщин. Подобно тому, как в условиях максимального расширения зрачка возможна офтальмоскопия не только центральных, но периферических отделов глазного дна, так и ОСТ позволяет исследовать не только макулу, но и парамакулярную сетчатку и даже зону экватора (рис. 2). Для этого наряду с достижением максимального мидриаза необходимо повернуть глазное яблоко таким образом, чтобы лазерный луч проецировался на исследуемую область. Соединение отдельных снимков воедино позволяет получить панорамное изображение сетчатки пациента. Рис. 2. Панорама нормальной сетчатки женщины 34 лет выполненная в меридиане 3-9 часов. А. Фотография глазного дна. Диск зрительного нерва розового цвета с четкими границами. Ход и калибр сосудов правильный. Очаговых изменений нет. Фовеолярный рефлекс сохранен. Б. ОСТ сетчатки в меридиане 3-9 часов. Слои сетчатки четко дифференцируются. Фовеолярное вдавление сохранено. Физиологическая экскавация ДЗН, нейроглия не нарушена. Толщина сетчатки по направлению к периферии уменьшается. Оптическая когерентная томография в офтальмологии под ред. А.Г. Щуко, В.В. Малышева