ответ 50 г - Schools.by
реклама

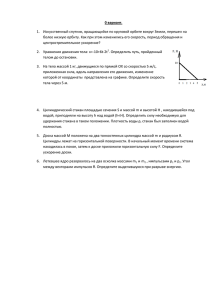
1.Какую массу гидроксида натрия нужно растворить в воде массой 200 г, чтобы получить раствор с массовой долей NaOH 20%?(ответ 50 г) 2. Какой объём раствора с массовой долей азотной кислоты 32% плотностью 1,2 г/см 3 нужно взять для приготовления 1 дм3 раствора с молярной концентрацией НNО3 1 моль/дм3? (ответ 164,06 см3) 3. Сколько грамм натрия нужно растворить в 16,4 г воды, чтобы получить раствор с массовой долей гидроксида натрия 10%?(ответ 1 г) 4. Рассчитать массовую долю гидроксида натрия в растворе с молярной концентрацией NaOH 1 моль/дм3, если плотность этого раствора 1,041кг/дм3. (ответ 3,84 %) 5. Сколько граммов кристаллогидрата Na2SO4∙10H2O нужно взять для приготовления раствора массой 15 г с массовой долей сульфата натрия 4,7%?(ответ 1,6 г) 6. Натриевую селитру массой 160 г растворили в 1 дм3 воды. Массовая доля соли в растворе: а) 0,138; б) 0,615; в) 0,160; г) 1,600. (ответ 0,138) 7. Аммиачную селитру массой 140 г растворили в 1 дм3 воды. Массовая доля соли в растворе: а) 0,123; б)0,140; в) 0,583; г)1,400. (ответ 0,123) 8. В растворе гидроксида калия массой 150 г, масса КОН в котором равна 8,4 г, растворили оксид калия химическим количеством 0,2 моль. Массовая доля (%) растворённого вещества в образовавшемся растворе равна: а) 18,2; б)17,3; в) 15,5; г) 9,2. (ответ 18,2) 9. Найдите массу (г) квасцов (К2SO4∙AI2(SO4)3∙24H2O), которые необходимо добавить к водному раствору сульфата калия массой 74 г с массовой долей соли, равной 5,5 %, чтобы массовая доля К2SO4 в растворе увеличилась на 4,2 %. (ответ 36) 10. Рассчитайте массу (г) квасцов (К2SO4∙AI2(SO4)3∙24H2O), которые необходимо добавить к водному раствору сульфата калия массой 76 г с массовой долей соли, равной 4,5 %, чтобы массовая доля К2SO4 в растворе увеличилась на 5 %.(ответ 43) 11. Известно, что массовая доля соли в кристаллогидрате сульфата железа (II) равна 0,547. Определите массу (г) воды в кристаллогидрате химическим количеством 0,2 моль. (ответ 25) 12. К образцу минерала доломита (СаСО3∙МgСО3) прибавили раствор азотной кислоты массой 120 г с массовой долей НNО3, равной 0,21, при этом минерал растворился полностью. В результате реакции выделился газ объёмом 3,136 дм3 (н.у.). Вычислите массовую долю (%) соли с наибольшей молярной массой в образовавшемся растворе. (ответ 9) 13. Образец минерала сильвинита (NaСI∙КСI) растворили в воде объёмом 23 см3, затем прибавили раствор нитрата серебра (I) массой 47 г с массовой долей соли 0,36. При этом выпал осадок массой 10 г. Вычислите массовую долю (%) соли с наибольшей молярной массой в образовавшемся растворе. (ответ 8) 1.Какую массу гидроксида натрия нужно растворить в воде массой 200 г, чтобы получить раствор с массовой долей NaOH 20%? 2. Какой объём раствора с массовой долей азотной кислоты 32% плотностью 1,2 г/см 3 нужно взять для приготовления 1 дм3 раствора с молярной концентрацией НNО3 1 моль/дм3? 3. Сколько грамм натрия нужно растворить в 16,4 г воды, чтобы получить раствор с массовой долей гидроксида натрия 10%? 4. Рассчитать массовую долю гидроксида натрия в растворе с молярной концентрацией NaOH 1 моль/дм3, если плотность этого раствора 1,041кг/дм3. 5. Сколько граммов кристаллогидрата Na2SO4∙10H2O нужно взять для приготовления раствора массой 15 г с массовой долей сульфата натрия 4,7%? 6. Натриевую селитру массой 160 г растворили в 1 дм3 воды. Массовая доля соли в растворе: а) 0,138; б) 0,615; в) 0,160; г) 1,600. 7. Аммиачную селитру массой 140 г растворили в 1 дм3 воды. Массовая доля соли в растворе: а) 0,123; б)0,140; в) 0,583; г)1,400. 8. В растворе гидроксида калия массой 150 г, масса КОН в котором равна 8,4 г, растворили оксид калия химическим количеством 0,2 моль. Массовая доля (%) растворённого вещества в образовавшемся растворе равна: а) 18,2; б)17,3; в) 15,5; г) 9,2. 9. Найдите массу (г) квасцов (К2SO4∙AI2(SO4)3∙24H2O), которые необходимо добавить к водному раствору сульфата калия массой 74 г с массовой долей соли, равной 5,5 %, чтобы массовая доля К2SO4 в растворе увеличилась на 4,2 %. 10. Рассчитайте массу (г) квасцов (К2SO4∙AI2(SO4)3∙24H2O), которые необходимо добавить к водному раствору сульфата калия массой 76 г с массовой долей соли, равной 4,5 %, чтобы массовая доля К2SO4 в растворе увеличилась на 5 %. 11. Известно, что массовая доля соли в кристаллогидрате сульфата железа (II) равна 0,547. Определите массу (г) воды в кристаллогидрате химическим количеством 0,2 моль. 12. К образцу минерала доломита (СаСО3∙МgСО3) прибавили раствор азотной кислоты массой 120 г с массовой долей НNО3, равной 0,21, при этом минерал растворился полностью. В результате реакции выделился газ объёмом 3,136 дм3 (н.у.). Вычислите массовую долю (%) соли с наибольшей молярной массой в образовавшемся растворе. 13. Образец минерала сильвинита (NaСI∙КСI) растворили в воде объёмом 23 см3, затем прибавили раствор нитрата серебра (I) массой 47 г с массовой долей соли 0,36. При этом выпал осадок массой 10 г. Вычислите массовую долю (%) соли с наибольшей молярной массой в образовавшемся растворе.