Тренировочные задания В6 нового типа в ЕГЭ
реклама
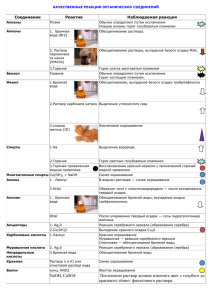
Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Тренировочные задания В6 нового типа в ЕГЭ-2014 по химии. Согласно проекту КИМ 2014 года в содержание и структуру ЕГЭ по химии будет включено новое задание в часть B (на позиции В6), которое ориентировано на проверку элементов содержания: «качественные реакции на неорганические вещества и ионы», «качественные реакции органических соединений». В данной работе содержатся тренировочные упражнения данного типа и две таблицы: «Качественные реакции на неорганические вещества» и «Качественные реакции на органические вещества». Источник заданий №1-№10 - сайт ЕГЭ и ГИА 2013-2014 на Яндексе, задания №11- №20 – авторские. Качественные реакции на неорганические вещества. Вещество Реактив Реакция Характерные признаки Н2 О2 (сжигание) 2Н2 + О2 = 2Н2О Запотевание холодного предмета О2 С + О2 = СО2 Вспышка О3 + 2КI + Н2О = О2 + 2КОН + I2 Посинение бумажки СО2 С (тлеющая лучинка) Бумажка, пропитанная крахмальным клейстером и раствором КI Крахмальный клейстер Известковая вода NН3 Хлороводород NН3 + НCl = NН4 Сl SO2 Окрашенные растворы окислителей (КМnO4 и Br2) SO2 + Br2 + 2Н2О = Н2SО4 + 2HBr О3 I2 Катион Реактив Н+ Лакмус Метиловый оранжевый Пламя спиртовки Na+ Синее окрашивание Са(ОН) 2 + СО2 = СаСО3 + Н2О СаСО3 + СО2 + Н2О = Са(НСО3)2 Выпадение белого осадка СаСО3 и его растворение при пропускании избытка СО2 Специфический запах NН3, образование белого дыма (NН4Сl) Обесцвечивание растворов 3SO2 + 2КМnO4 + 4Н2О= 3Н2SО4 + 2МnO2 + 2КОН Реакция Характерные признаки Красное окрашивание, розовое окрашивание Желтое окрашивание Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области К+ Пламя спиртовки Фиолетовое окрашивание Са2+ Пламя спиртовки Кирпично-красное окрашивание Ва2+ Растворимые сульфаты, серная кислота. Ва2++ SO4 2- = BaSO4 Пламя спиртовки Выпадение белого мелкодисперсного осадка, не растворимого в воде и азотной кислоте Желто-зеленое окрашивание Белый творожистый осадок, не растворимый в воде и азотной кислоте Специфический запах NН3, посинение лакмусовой бумажки, образование белого дыма (NН4 Сl). Аg+ Растворимые хлориды, соляная кислота Аg+ + Cl- = AgCl NН4+ NН4+ + ОН- = NН3+ Н2О NН3 + НCl = NН4 Сl Аl3+ Раствор щелочи, нагревание, влажная лакмусовая бумажка; Палочка, смоченная НСl(конц.) Раствор щелочи Zn2+ Раствор щелочи Zn2+ + 2ОН- = Zn(ОН)2 Zn(ОН)2 + 2ОН- = [Zn (ОН)4]- Мg2+ Раствор щелочи Мg2+ + 2ОН- = Мg(ОН)2 Cr 3+ Раствор щелочи Cr 3+ + 3ОН- = Cr(ОН)3 Cr(ОН)3 + ОН- = [Cr(ОН)4] - Fе 2+ Раствор красной кровяной соли К3[Fe(CN)6] Раствор щелочи 3Fе 2+ + 2[Fe(CN)6]3- = Fе3[Fe(CN)6]2 Раствор роданида аммония NH4CSN Раствор желтой кровяной соли К4[Fe(CN)6] Раствор щелочи Fе 3+ + 3CSN- = Fе(CSN)3 Fе 3+ + 3ОН- = Fе(ОН)3 Белый осадок Аl(ОН)3, растворимый в избытке щелочи Белый осадок Zn(ОН)2, растворимый в избытке щелочи Белый осадок Мg(ОН)2, не растворимый в избытке щелочи Серо-зеленый осадок Cr(ОН)3, растворимый в избытке щелочи Образование темносинего осадка (турнбулева синь) Бело-зеленый осадок, буреющий на воздухе Кроваво-красное окрашивание раствора Образование темносинего осадка (берлинской лазури) Бурый осадок Раствор щелочи Сu2++ 2ОН- = Сu(ОН)2 Ярко-голубой Fе 3+ Сu2+ Аl3+ + 3ОН- = Аl(ОН)3 Аl(ОН)3 + ОН- = [Аl(ОН)4] - Fе 2+ + 2ОН- = Fе(ОН)2 4Fе 3+ + 3[Fe(CN)6]4- = Fе4[Fe(CN)6]3 Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Рb 2+ Анион ОН- - F Cl- Растворимые сульфиды, иодиды Реактив Рb + S = PbS Рb2++ 2I- = РbI2 2+ 2- Реакция Лакмус Фенолфталеин Метилоранж Растворимые соли кальция Раствор нитрата серебра Са2+ + 2F- = СаF2 Аg+ + Cl- = AgCl Br- Раствор нитрата серебра Аg+ + Br - = AgBr I- Раствор нитрата серебра Аg+ + I - = AgI NО3- Н2SО4(конц) и медные стружки при нагревании Раствор соли бария 2NaNO3 + Сu + 2Н2SО4 = 2NO2+ CuSО4 +Na2SО4 +2Н2О SО32- Сильная кислота 2Н+ + SО32- = Н2SО3 (SO2+Н2О) S2- Раствор соли свинца или меди Сильная кислота Рb2++ S2- = PbS Cu2++ S2- = CuS 2Н+ + СО32- = СO2+ Н2О Н+ + НСО3- = СO2+ Н2О Раствор нитрата серебра в слабощелочной среде Раствор соли бария 3Аg+ + РО43- = Ag3РО4 SО42- СО32НСО3РО43- CrO4 2- Ва2++ SO4 2- = BaSO4 Ва2+ + CrO42- = BaCrO4 студенистый осадок Черный осадок PbS и желтый осадок РbI2 Характерные признаки Синее окрашивание Малиновое окрашивание Желтое окрашивание Белый осадок Белый творожистый осадок, не растворимый в воде и азотной кислоте Светло-желтый осадок, не растворимый в воде и азотной кислоте Желтый осадок, не растворимый в воде и азотной кислоте Бурый газ (NO2), голубая окраска раствора Выпадение белого мелкодисперсного осадка, не растворимого в воде и азотной кислоте Газ (SO2) с резким специфическим запахом, обесцвечивает окрашенные растворы окислителей (КМnO4, Br2) Черный осадок PbS и CuS Газ СO2 без цвета и запаха, не поддерживает горение Желтый осадок, растворимый в азотной кислоте Выпадение желтого осадка BaCrO4, не растворимого в уксусной кислоте, но растворимого в HCI Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Качественные реакции на органические вещества. Вещество, функциональная группа Непредельные углеводороды (алкены, алкины, диены), кратные связи Реактив Раствор КМпО4 Обесцвечивание раствора Бромная вода Обесцвечивание раствора Ацетилен, алкины с тройной связью у крайнего атома углерода Аммиачный раствор Ag2O Аммиачный раствор СuCl Образование осадка желтого цвета (взрывоопасен) Образование осадка красного цвета (взрывоопасен) Толуол, гомологи бензола Подкисленный раствор КМпО4, при нагревании Обесцвечивание раствора Бромная вода Обесцвечивание раствора, выпадение белого осадка трибромфенола Окрашивание раствора в фиолетовый цвет Фенол Раствор FeCl3 Характерные признаки Одноатомные спирты CuO (раскаленная медная проволока, покрытая черным налетом CuO) Восстановление красной окраски (медный блеск) у прокаленной медной проволоки, запах альдегида Многоатомные спирты, глюкоза, фруктоза Свежеосажденный Сu(OH)2 в сильно щелочной среде Ярко-синее окрашивание раствора с образованием глицерата, глюкозата и др. Гидроксогруппа (спирты, фенол, и др.) Металлический натрий Выделение пузырьков газа (H2) Аммиачный раствор Ag2O при нагревании Образование блестящего налета Ag («серебряного зеркала») на стенках сосуда Образование красного осадка Сu2O Альдегидная группа – СНО (альдегиды, глюкоза) Карбоновые кислоты Свежеосажденный Сu(OH)2 при нагревании Лакмус Спирт + Н2SО4(конц) Муравьиная кислота Аммиачный раствор Ag2O при нагревании Олеиновая кислота Н2SО4(конц) Раствор КМпО4 или Окрашивание раствора в розовый цвет Специфический запах образующегося сложного эфира Образование блестящего налета Ag («серебряного зеркала») на стенках сосуда Выделение угарного газа Обесцвечивание растворов Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Ацетаты (соли уксусной кислоты) Стеарат натрия (мыло) Амины бромная вода Раствор FeCl3 Н2О (гидролиз) + фенолфталеин Насыщенный раствор соли кальция Концентрированная неорганическая кислота Лакмус Бромная вода Раствор хлорной извести СаОСl2 (бесцветный) Обесцвечивание бромной воды, выпадение белого осадка триброманилина. Окрашивание раствора в фиолетовый цвет Раствор I2 Синее окрашивание HNO3 (конц.) Свежеосажденный Сu(OH)2 в щелочной среде Желтое окрашивание Окрашивание раствора в фиолетовый цвет Раствор Рb(CH3COO)2 Выпадение осадка черного цвета Анилин Крахмал Белок Окрашивание раствора в красно-бурый цвет Окрашивание раствора в малиновый цвет Образование серого осадка стеарата кальция Образование белого осадка стеариновой кислоты В водном растворе — синее окрашивание. Примеры заданий В6. А) Б) В) Г) А) Б) В) Г) Задание 1 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать. Вещества Реактивы Газы CO и CO2 1 Бромная вода Растворы NaI и NaCl 2 Фенолфталеин Растворы Na2CO3 и NaHCO3 3 Соляная кислота Порошкообразные BaSO4 и CaCO3 4 Раствор хлорида кальция 5 Раствор гидроксида кальция Задание 2 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать. Вещества Реактив Бензол и гексен 1 Бромная вода Бутин-1 и бутин-2 2 Фенолфталеин Глюкоза и сорбит 3 Соляная кислота Пропионовая кислота и пропанол 4 Раствор карбоната натрия 5 Аммиачный раствор оксида серебра (I) Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Задание 3 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать. Вещества Реактив А) Газы N2 и CO2 1 Раствор гидроксида кальция Б) Растворы NaCl и NH4Cl 2 Азотная концентрированная кислота В) Концентрированные растворы HCL и HNO3 3 Гидроксид натрия Г) Латунь и золото 4 Соляная кислота 5 Медь Задание 4 Установить соответствие между веществом и качественной реакцией на вещества этого класса. Вещества Качественные реакции А) Ацетальдегид 1 Фиолетовое окрашивание раствора хлорида железа (III) Б) Сорбит 2 Желтый осадок с аммиачным раствором оксида серебра В) Фенол 3 Образование фиолетового раствора с гидроксидом меди (II) Г) Ацетилен 4 Образование раствора с интенсивной синей окраской с гидроксидом меди (II) 5 Реакция «серебряного зеркала» Задание 5 Установить соответствие между признаками качественной химической реакции и веществами, которые дают эту реакцию. Признаки реакции Вещества А) Исчезновение окраски раствора и выпадение 1 Водный раствор перманганата белого осадка калия и этилен Б) Исчезновение окраски раствора и выпадение 2 Фенол и бромная вода бурого осадка В) Обесцвечивание раствора без выпадения 3 Раствор лакмуса и уксусной осадка кислоты Г) Образование раствора с интенсивной синей 4 Пропен и бромная вода окраской 5 Этиленгликоль и гидроксид меди (II) Задание 6 Установить соответствие между реактивом и веществами, которые можно различить с его помощью. Реактив Вещества А) Медь с H2SO4(конц.) 1 K2SO4 и KCl Б) Раствор NaOH при нагревании 2 NaNO3 и KNO3 В) Раствор ВaCl2 3 Na2S и NaCl Г) Раствор Pb(NO3)2 4 Na2SO4 и (NH4)2SO4 5 CH3COOH и NaNO3 Задание 7 Установить соответствие между веществами, которые необходимо расзличить, и реактивом, с помощью которого можно это сделать. Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области А) Б) В) Г) А) Б) В) Г) А) Б) В) Г) А) Б) В) Г) А) Б) В) Г) Вещества Растворы СuCl2 и Cu(NO3)2 Растворы I2 и FeCl3 Растворы BaCl2 и KCl Растворы Na2CO3 и NaNO3 1 2 3 4 5 Реактив Бромная вода Раствор сульфата натрия Соляная кислота Раствор нитрата серебра Раствор нитрата калия Задание 8 Установить соответствие между веществами, которые необходимо расзличить, и реактивом, с помощью которого можно это сделать. Вещества Реактив Растворы ZnCl2 и CaCl2 1 Фенолфталеин Растворы КОН и Сa(OH)2 2 Раствор иодида калия Растворы KNO3 и NH4NO3 3 Углекислый газ Растворы Pb(NO3)2 и Mg(NO3)2 4 Раствор гидроксида натрия 5 Раствор хлорида бария Задание 9 Установить соответствие между веществами, которые необходимо расзличить, и реактивом, с помощью которого можно это сделать. Вещества Реактив Бутен-1 и бутан 1 Бромная вода Раствор глицерина и пропанола 2 Фенолфталеин Растворы глюкозы и этаналя 3 Гидроксид меди (II) Уксусная и муравьиная кислоты 4 Раствор карбоната натрия 5 Аммиачный раствор оксида серебра (I) Задание 10 Установить соответствие между веществами, которые необходимо расзличить, и реактивом, с помощью которого можно это сделать. Вещества Реактив Бензол и толуол 1 Лакмус Ацетилен и этилен 2 Бромная вода Глюкоза и фруктоза 3 Соляная кислота Растворы фенола и пропанола 4 Аммиачный раствор оксида серебра (I) 5 Подкисленный раствор перманганата калия Задание 11 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Растворы Na2CO3 и Na2SiO3 1 Раствор хлороводорода Газы СО и CO2 2 Раствор хлорида калия Газы HCl и N2 3 Известковая вода Газы СO2 и SО2 4 Бромная вода 5 Аммиак Задание 12 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области А) Вещества Глюкоза и глицерин 1 Б) Этанол и этандиол 2 В) Г) Пропаналь и пропанон 3-метилбутин-1 и бутин-2 3 4 5 А) Б) В) Г) А) Б) В) Г) А) Б) В) Г) А) Б) В) Реактивы Аммиачный раствор Ag2O (без нагревания) Свежеосажденный Сu(ОН)2 (без нагревания) Хлороводород Гидроксид натрия Свежеосажденный Сu(ОН)2 (при нагревании) Задание 13 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Сульфат железа (II) и сульфат магния 1 Соляная кислоты (растворы) Сульфат натрия и хлорид натрия (растворы) 2 Раствор фосфата натрия Карбонат кальция и фосфат магния 3 Раствор красной кровяной соли (порошкообразные) К3[Fe(CN)6] Хлорид калия и хлорид лития (растворы) 4 Раствор желтой кровяной соли К4[Fe(CN)6] 5 Раствор нитрата бария Задание 14 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Нитрат натрия и нитрат бария 1 Раствор хлорида бария (порошкообразные) Иодид натрия и хлорид натрия (растворы) 2 Соляная кислота Сульфат калия и нитрат калия (растворы) 3 Раствор нитрата серебра Хлорид цинка и хлорид магния (растворы) 4 Пламя спиртовки 5 Раствор гидроксида калия Задание 15 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Серная кислота и соляная кислота 1 Серная концентрированная кислота и медные стружки Нитрат калия и хлорид калия (растворы) 2 Раствор хлорида бария Хлорид натрия и хлорид аммония 3 Хлороводород (растворы) Гидроксид алюминия и гидроксид магния 4 Азотная кислота 5 Раствор гидроксида калия Задание 16 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Карбонат калия и сульфат лития (растворы) 1 Раствор гидроксида калия Хлорид натрия и фосфат натрия (растворы) 2 Раствор нитрата серебра Хлорид меди (II) и нитрат меди (II) 3 Бромная вода (растворы) Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области Г) А) Б) В) Г) А) Цинк и железо 4 Соляная кислота 5 Гидроксид меди (II) Задание 17 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Бутадиен-1,3 и бутан 1 Аммиачный раствор оксида серебра Пропанол и пропанон 2 Натрий Этандиол и этанол 3 Бромная вода Анилин и фенол 4 Раствор сульфата меди (II) 5 Свежеосажденный гидроксид меди (II) Задание 18 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Б) В) Муравьиная кислота и пропионовая кислота (растворы) Толуол и ацетальдегид Фенол (раствор) и этанол Г) Пропанол-2 и ацетон А) Б) В) Г) А) Б) В) Г) 1 Раствор хлорида железа (III) 2 Медь 3 Аммиачный раствор оксида серебра 4 Раствор серной кислоты 5 Натрий Задание 19 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Бутан и бутен-1 1 Фенолфталеин Бензол и толуол 2 Аммиачный раствор хлорида меди (I) Бутадиен-1,3 и пропин 3 Карбонат натрия Муравьиная кислота и формальдегид 4 Подкисленный раствор перманганата калия 5 Соляная кислота Задание 20 Установить соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать Вещества Реактивы Фенол и анилин (растворы) 1 Бромная вода Акриловая кислота и пропионовая кислота 2 Раствор хлорида железа (III) (растворы) Этанол и этандиол 3 Раствор карбоната калия Ацетат натрия и пропионат натрия 4 Лакмус (растворы) 5 Свежеосажденный раствор гидроксида меди (II) № задания Ответ № задания Ответ Горбачева Виктория Владимировна, учитель химии МКОУ Кумылженской СОШ №2 Волгоградской области 1 2 3 4 5 6 7 8 9 10 5143 1554 1352 2145 5412 5413 4423 4342 1335 5442 11 12 13 14 15 16 17 18 19 20 1354 5251 3512 4315 2155 4221 3252 3315 4423 2152 Литература. 1. Метельский А.В. Химия в экзаменационных вопросах и ответах: Справочник для учителей, репетиторов и абитуриентов. – 2-е изд . Минск: Беларуская энцыклапедыя, 1999. 2. Новошинский И.И., Новошинская Н.С. Органическая химия: 11 класс. - Краснодар: Советская Кубань, 2004. 3. Новошинский И.И., Новошинская Н.С. Химия. 10 кл.: Учебник для общеобразовательных учреждений. - М.: Оникс, 2005. 4. http://ege.yandex.ru/chemistry/?ncrnd=1537