Изучение антивирусной активности БАВП на
реклама
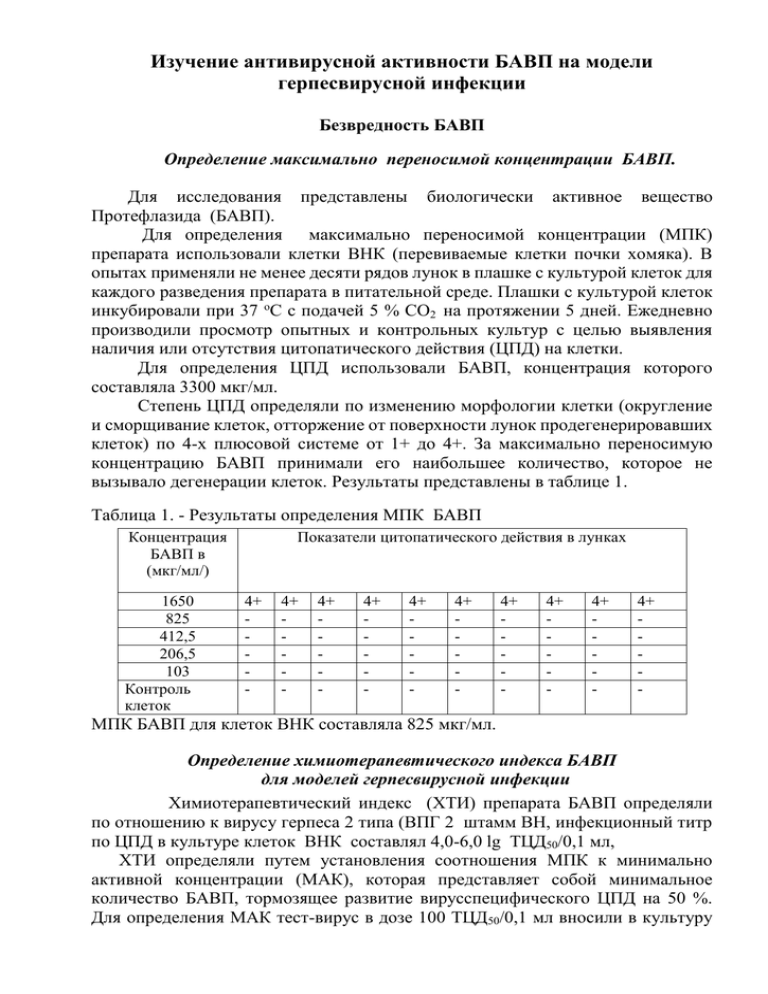
Изучение антивирусной активности БАВП на модели герпесвирусной инфекции Безвредность БАВП Определение максимально переносимой концентрации БАВП. Для исследования представлены биологически активное вещество Протефлазида (БАВП). Для определения максимально переносимой концентрации (МПК) препарата использовали клетки ВНК (перевиваемые клетки почки хомяка). В опытах применяли не менее десяти рядов лунок в плашке с культурой клеток для каждого разведения препарата в питательной среде. Плашки с культурой клеток инкубировали при 37 оС с подачей 5 % СО2 на протяжении 5 дней. Ежедневно производили просмотр опытных и контрольных культур с целью выявления наличия или отсутствия цитопатического действия (ЦПД) на клетки. Для определения ЦПД использовали БАВП, концентрация которого составляла 3300 мкг/мл. Степень ЦПД определяли по изменению морфологии клетки (округление и сморщивание клеток, отторжение от поверхности лунок продегенерировавших клеток) по 4-х плюсовой системе от 1+ до 4+. За максимально переносимую концентрацию БАВП принимали его наибольшее количество, которое не вызывало дегенерации клеток. Результаты представлены в таблице 1. Таблица 1. - Результаты определения МПК БАВП Концентрация БАВП в (мкг/мл/) 1650 825 412,5 206,5 103 Контроль клеток Показатели цитопатического действия в лунках 4+ - 4+ - 4+ - 4+ - 4+ - 4+ - 4+ - 4+ - 4+ - 4+ - МПК БАВП для клеток ВНК составляла 825 мкг/мл. Определение химиотерапевтического индекса БАВП для моделей герпесвирусной инфекции Химиотерапевтический индекс (ХТИ) препарата БАВП определяли по отношению к вирусу герпеса 2 типа (ВПГ 2 штамм ВН, инфекционный титр по ЦПД в культуре клеток ВНК составлял 4,0-6,0 lg ТЦД50/0,1 мл, ХТИ определяли путем установления соотношения МПК к минимально активной концентрации (МАК), которая представляет собой минимальное количество БАВП, тормозящее развитие вирусспецифического ЦПД на 50 %. Для определения МАК тест-вирус в дозе 100 ТЦД50/0,1 мл вносили в культуру клеток ВНК и инкубировали в течение 1 часа при 37о С. После адсорбции вируса на клетках его удаляли и клетки отмывали питательной средой RPMI-1640, после чего в поддерживающую среду (RPMI-1640 + 2% фетальной сыворотки) вносили исследуемые БАВП в разведениях от 1:20 до 1:1280, что соответствовало дозам 24 – 0,37 мкг/мл. Для исследования использовали БАВП и его модификации, концентрация которых составила 480 мкг/мл. Результаты представлены в таблице 2. Таблица 2. - МАК БАВП и его модификаций по отношению к ВПГ2 Доза БАВП в (мкг/мл) 24 12 6 3 1,5 0,75 0,37 КВ Модификации БАВП и титры вируса в lg TЦД50 t –ин.акт. рамназидаза исходный БАВП +БАВП БАВП 5,5 2,0 5,0 5,5 1,0 3,0 5,5 1,0 1,5 5,5 2,0 3,0 5,5 4,0 4,0 5,0 2,0 3,0 3,0 1,0 4,0 6,0 4,0 6,0 КВ - (контроль вируса) Анализируя полученные результаты исследований, следует отметить, что препарат БАВП ингибировал репродукцию вируса герпеса в диапазоне доз от разведений 1:40 до 1:1280 (концентрации от 12 мкг/мл до 0,37 мкг/мл). После термообработки БАВП сохранил антивирусное действие только в области концентраций около 0,37 мкг/мл. Ферментативная обработка рамназидазой усиливала антивирусную активность БАВП. В отличие от предыдущих исследований, где обработка рамназидазой приводила к потере антивирусной активности, в данном опыте, наличие или отсутствие углевидных «хвостов» у флавонола не существенно влияет на действие БАВП. Можно сделать вывод, что структурой ответственный за проявление антивирусной активности является молекула флавонола. Согласно результатам, представленным в таблице 2., БАВП является эффективным ингибитором репродукции вируса герпеса. Отсутствие ЦПД в опыте, при наличии его в контроле, позволило выявить МАК препаратов, а также ингибицию инфекционного титра вируса герпеса на 5,0-6,0 lg ID50. Согласно методическим рекомендациям [1], вещество или препарат считают проявляющим активность при снижении уровня репродукции вируса на 2,0 lg и более, следовательно МАК БАВ из протефлазида соответствует разведению 1:1280. Результаты определения МПК, МАК и ХТИ препаратов представлены в табл.3. Таблица 3. - Результаты определения МПК, МАК и ХТИ БАВП Препарат БАВП МПК, (концентрация) (мкг/мл) 825 МАК, разведение (концентрация) (мкг/мл) 1:1280 (0,37) ХТИ 2230 Как видно из представленной таблицы 3. показатели МПК, МАК и ХТИ позволяют отнести БАВП к активным антивирусным препаратам. Изучение антигерпетической активности БАВП in vitro и in vivo Изучение антигерпетической активности БАВП и БАВП-сиропа в опытах in vitrо Изучение антивирусной активности БАВП проводили на перевиваемой культуре клеток ВНК (клетки почки хомяка). Клетки выращивали в плашках на среде RPMI-1640 +10% фетальной сыворотки (Nunclon, Surface, Denmark) при температуре 37 оС в термостате с подачей СО2. Заражение культур клеток осуществляли вирусом герпеса простого, штамм ВН, Инфекционный титр по ЦПД в культуре клеток ВНК составлял 4,0-5,0 lg ТЦД50/0,1 мл, Для изучения антивирусной активности исследуемых препаратов использовали суточные культуры клеток со сплошным монослоем клеток. Среду роста сливали, на монослой клеток наносили препарат в разных концентрациях, либо вирус герпеса, в зависимости от модификации эксперимента: профилактическое или лечебное действие. Через 1 час контакта неадсорбировавшийся вирус герпеса удаляли и в лунки вносили поддерживающую среду (питательная среда без сыворотки). На следующий день в лунки плашек, которые инкубировались с разными разведениями БАВП, вносили вирус герпеса в дозе 100 ТЦД50, а в лунки, которые были инфицированы вирусом герпеса, вносили разные разведения препарата. Культуры инкубировали в термостате с подачей СО2 в течение 5 суток ежедневно микроскопируя и отмечая репродукцию вируса по цитопатическому действию ВПГ на клетки ВНК в сравнении с контрольными культурами, где монослой не подвергался никаким воздействиям. Цитопатическое действие ВПГ на клетки морфологически проявляется в образовании симпластов или округлых клеток в сочетании с пролиферацией и гигантскими многоядерными клетками. Через 5 суток культуральную среду из лунок плашек собирали и определяли инфекционный титр вируса герпеса в каждой пробе при профилактическом и лечебном действии БАВП. Результаты определения репродукции ВПГ при профилактическом и лечебном введении БАВП представлены в таблицах 4 и 5. Таблица 4. - Профилактическое действие БАВП на репродукцию ВПГ в культуре клеток ВНК Разведения БАВП Доза БАВП в (мкг/мл) Вирус герпеса 100 ТЦД50 Инфекционный титр в lg ТЦД50 Ингибирующий инфекционный титр в lg ТЦД50 1:20 1:40 1:80 1:160 1:320 1:640 1:1280 КВ 24 12 6 3 1,5 0,75 0,37 ̶ + + + + + + + ̶ 1,0 1,0 1,0 1,0 1,0 2,0 3,0 4,0 3,0 3,0 3,0 3,0 3,0 2,0 1,0 - КВ – (контроль вируса) Таблица 5. - Лечебное действие БАВП на репродукцию ВПГ в культуре клеток ВНК Разведения БАВП Доза БАВП в (мкг/мл) Инфекционны й титр в lg ТЦД50 1,0 2,0 2,0 3,0 2,0 Ингибирующий инфекционный титр в lg ТЦД50 24 12 6 3 1,5 Вирус герпеса 100 ТЦД50 + + + + + 1:20 1:40 1:80 1:160 1:320 1:640 1:1280 КВ 0,75 0,37 ̶ + + ̶ 2,5 3,0 5,0 2,5 2,0 - 4,0 3,0 3,0 2,0 3,0 КВ – (контроль вируса) Анализируя результаты, представленные в таблицах 4 и 5 следует отметить, что при in vitro профилактическом воздействии в разведениях от 1:20 до 1:640 и лечебном воздействии при разведениях от 1:20 до 1:1280 у БАВП отмечалась выраженная противогерпетическая активность. Изучение антигерпетической активности БАВП и БАВП-сиропа в экспериментах in vivo Герпесвирусный менингоэнцефалит Вирус простого герпеса 1 (ВПГ-1) – использовали лиофилизированный вирус герпеса простого (ВПГ) 1-го антигенного типа, штамм VC, получен из музея вирусов института вирусологии им.Д.И.Ивановского РАМН (г.Москва). Инфекционный титр по ЦПД в культуре клеток RK13 составлял 4,0-5,0 lg ТЦД50/0,1 мл, при внутримозговом заражении белых мышей – 4,0-4,5 lg LD50/0,03 мл. Антигерпетическую (ВПГ-1) активность БАВП изучали на модели герпесвирусного менингоэнцефалита у белых мышей [1]. Данная модель удобна для оценки выраженности симптоматики, отличается 100% воспроизводимостью и не требует применения дополнительных контролей. Развитие клинических симптомов заболевания в контроле начиналось на 5-е-6-е сутки с момента инфицирования, достигало максимума к 13-14 суткам и далее отмечалось уменьшение выраженности симптоматики с последующим клиническим выздоровлением выживших животных. Наличие острой герпетической инфекции подтверждалось с помощью иммунофлюоресценции. Так, наиболее интенсивное свечение наблюдалось в тканях головного мозга (особенно в стволовых отделах), которое появлялось через 6-7 суток с момента инфицирования, что соответствует моменту появления клинических признаков заболевания. Менее интенсивное свечение (+ или ++) отмечалось в селезенке и отсутствовало в печенке и легких. Летальность животных, инфицированных вирусом герпеса простого, составляла 80- 100 %. Для моделирования экспериментальной герпетической инфекции использовали вирус герпеса простого 1 типа. Вирус прошел в лаборатории 43 пассажа через мозг белых мышей. Вируссодержащий материал вводили мышам внутрь мозга в объеме 0,03 мл. Величина заражающей дозы в опытах равнялась 1-10 LD50 (мышиных летальных доз). БАВП вводили мышам внутрибрюшинно по 0,2 мл [2-3]. Инфекционную активность вируса герпеса изучали по летальности животных. В качестве референс-препарата использовали виролекс фирмы KRKA (Словения), которую наносили в виде аппликации на поверхность раны ежедневно в течение 5 дней. Антигерпетическую активность (ВПГ-1) БАВП изучали на модели герпесвирусного менингоэнцефалита у белых беспородных мышей (весом 18-20 г). Во всех группах эксперимента препарат вводили внутрибрюшинно по 0,2 мл: - до инфицирования за 24 часа - профилактическая схема введения - через 24 часа после заражения вирусом герпеса – лечебная схема. Оценку активности препаратов проводили путем сравнения летальности в опытной и контрольных группах. При этом учитывали: - процент летальности животных; - кратность защиты (КЗ) – кратность уменьшения количества погибших мышей в опытной группе по сравнению с контрольной; - индекс эффективности (ИЭ) препарата определяли по формуле: кратность защиты – 1 ИЭ = --------------------------------- х 100 кратность защиты При профилактической и лечебной схеме в опыт было взято четыре группы животных: 1 - мыши, которым вводили БАВП в дозе 0,48 мг/кг + вирус герпеса; 2 – мыши, которым вводили виролекс + вирус герпеса; 3 – мыши, которым вводили физиологический раствор + вирус герпеса Результаты приведены в таблицах 6 и 7. Таблица 6. – Защитное действие БАВП при профилактическом введении мышам, зараженным вирусом герпеса Воздействие Доза, мг/кг К-во мышей БАВП виролекс вирус герпеса 0,48 10 - 10 10 10 Из них погибло всего % 4 5 10 40,0 50,0 100 КЗ ИЭ 2,5 2,0 - 60,0 50,0 - Ингиб. инф. титр в ткани мозга мышей 2,5 2,5 ̶ На основании данных, приведенных в таблице 6 можно сделать вывод, что БАВП обладает выраженным профилактическим действием [8]. В следующей серии опытов БАВП-сироп и виролекс вводили мышам через 24 часа после заражения их вирусом герпеса - лечебная схема. Результаты приведены в таблице 7. Таблица 7. – Защитное действие БАВП-сиропа и виролекса при лечебной схеме введения мышам, зараженным вирусом герпеса Воздействие Доза К-во мг/кг мышей Из них погибло всего % КЗ ИЭ БАВП-сироп 0,096 12 2 16,6 6,0 83,3 Ингиб. инф. титр в ткани мозга мышей 3,0 виролекс вирус герпеса 100 - 12 10 7 10 58,3 100,0 1,7 - 41,1 - 2,5 - Из приведенных данных в таблице 7 можно сделать вывод, что in vivo БАВП-сироп проявляют выраженное лечебное действие в дозе 0,096 мг/кг, так как ИЭ 83,3 (лечебное действие) является эффективным показателем антигерпетической активности in vivo на модели герпетического менингоэнцефалита [7]. Генитальный герпес Вирус ВПГ-2 выделен д-ром мед.наук С.Л.Рыбалко от больного герпесом гениталий из смыва пораженной поверхности. Вирус поддерживали серийными пассажами в культуре клеток Vero. До начала экспериментальных исследований вирус сохраняли при минус 70 оС. В работе использовали самцов беспородных морских свинок массой 250-300 г, полученных из питомника «Глеваха», которых содержали в стандартных условиях вивария. Антигерпетическую активность (ВПГ-2) препарата изучали на модели генитальной герпетической инфекции морских свинок, которую воспроизводили путем заражения последних вируссодержащей жидкостью с инфекционным титром 5,0-5,5 lg ТЦД50/мл по методике предложенной С.С.Маренниковой с соавт. [4]. Вируссодержащую жидкость наносили на предварительно скарифицированную кожу penis. Скарификацию проводили при помощи хирургического ланцета, после того как животные анестезированы эфиром. Размер поверхности скарификации равнялся 4-7 мм2 . Вируссодержащую жидкость наносили при помощи пипетки сразу после скарификации (с последующим втиранием). Клинические симптомы экспериментального герпеса гениталий регистрировали ежедневно перед проведением лечения и наблюдали на протяжении всего периода болезни. Критериями оценки тяжести инфекционного процесса были поверхность и степень специфических поражений, наличие отека, гиперемии, орхит. Максимальная выраженность каждого признака составляла 4 балла (рис.). Наблюдения за животными проводили на протяжении 21 дня. Каждая исследуемая группа состояла из 5 животных. Эффективность препаратов оценивали на пике развития патологического процесса: по снижению выраженности клинических проявлений, сокращению сроков заболевания, индексу лечебного действия (ИЛД) в опытных группах по сравнению с контрольной. Сумма баллов в контроле – сумма баллов в группе животных, леченных препаратами ИЛД (в %) = ---------------------------------------------------------------------сумма баллов в контроле Раствор БАВП и его модификаций рамнозидазой наносили на скарифицированную зараженную поверхность 1 раз в сутки в течение 5 дней. В качестве референс-препарата использовали мазь виролекс фирмы KRKA (Словения), которую наносили в виде аппликации на поверхность раны ежедневно в течение 5 дней. Антивирусную активность препаратов исследовали на модели генитального герпеса у морских свинок исследовали по лечебной схеме, которая состояла в следующем: препараты наносили на раневую поверхность через 24 часа после моделирования полового герпеса. Всего в опыте было 4 группы животных: 1 – животные, которых заражали только вирусом герпеса 2 – животные, которых заражали вирусом герпеса и лечили виролексом при профилактической схеме опыта; 3 – животные, которых заражали вирусом герпеса и лечили БАВП в разведении 1:100 4 – животные, которых заражали вирусом герпеса и лечили БАВП, обработанным рамназидазой ( БАВП + рамнозидаза), в разведении 1:100. При исследовании эффективности исследуемых препаратов на модели генитального герпеса у морских свинок были получены следующие данные (таблица 8). Таблица 8. – Эффективность БАВП на модели полового герпеса Группы Препарат животных Длительность Р заболевания, сутки контроль заражения 15,0±3,2 виролекс 9,75±2,8 < 0,05 БАВП 2,0±0,3 < 0,001 БАВП+рамнозидаза 3,0±1,0 < 0,05 СИВЗ, баллы ИЛД, % 1 2 3 4 78,0 22,0 5,0 7,0 56,0 93,5 91,0 При лечебной схеме введения растворов БАВП и его модификации наблюдалось снижение симптоматики до уровня 5,0 -7,0 баллов соответственно, терапевтический эффект составил 93,5 и 91,0 соответственно. Продолжительность заболевания составила 2-3 дня соответственно, что статистически достоверно по всем параметрам и указывает на эффективность препарата в данной дозе. Таким образом в серии экспериментов показано, что БАВП, и его модификация (обработка рамнозидазой) проявляют антивирусное действие с более выраженным терапевтическим эффектом, чем мазь виролекс. Литература. 1. Доклинические исследования лекарственных средств. Методические рекомендации. Ред. - члена корреспондент АМН Украины О.В.Стефанов, 2001, с.371-396. 2. Лабораторные животные. Разведение, содержание, использование в эксперименте / И.П.Западнюк, В.И.Западнюк, Е.А.Захария, Б.В.Западнюк, - К.,1983,383с. 3. Батрак Г.Е., Кудрин А.Н. Дозирование лекарственных средств экспериментальным животным. – М., 1979. – 167с. 4. Маренникова С.С., Мацевич Г.Р., Чекунова Э.В. и др.. Разработка и практическое использование нових экспериментальных моделей разных форм герпетической инфекции. Вопр.вирусол.,1986, №1, 59-65. 5. Роскин Г.И., Левинсон Л.Б. Микроскопическая техника. М.,1957. 6. Блюмкин В.Н., Жданов В.М. Влияние вирусов на хромосомный аппарат и деление клеток. М., Медицина, 1973. 7. Проведение дополнительных доклинических испытаний новых форм препарата Протефлазид (Отчет о научно-исследовательской работе) / ГУ «Институт эпидемиологии и инфекционных болезней им. Л.В. Громашевского. – К., 2003. – 63 с. 8. Изучение механизмов действия биологически активных веществ лечебной субстанции Протефлазида (Отчет о научно-исследовательской работе) / ГУ «Институт эпидемиологии и инфекционных болезней им. Л.В. Громашевского. – К., 2010. – 86 с.




