Atomno-kristallicheskoe Stroenie Materialov
реклама

1. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
1.1. Три агрегатных состояния вещества.
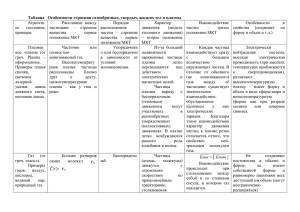
Как известно, любое вещество может находиться в твёрдом, жидком и
газообразном состоянии. Это зависит от температуры, давления, а также от
того, как сильно взаимодействуют частицы вещества. Выражаясь точнее,
реализация того или иного агрегатного состояния вещества определяется
соотношением средней энергии движения его атомов или молекул (Екин) и
средней энергии их взаимодействия (Епот). Если Екин Епот , вещество
находиться в газообразном состоянии. При этом частицы вещества
располагаются на относительно больших расстояниях друг от друга и
практически не взаимодействуют, за исключением случайных столкновений,
в которых они разлетаются подобно биллиардным шарам. Двигаясь почти
свободно, частицы газа занимают весь предоставленный им объём, и этим
объясняется самое общее свойство всех газов – их летучесть.
С понижением температуры уменьшается энергия движения частиц
вещества, и всё заметнее начинают проявляться силы межатомного или
межмолекулярного взаимодействия. Частицы при случайном столкновении
уже не отскакивают друг от друга подобно биллиардным шарам, а как бы
«прилипают» друг к другу. Это приводит к переходу вещества в более
плотное, конденсированное состояние – сначала в жидкое, а затем и в
твёрдое.
В жидком состоянии энергия движения частиц вещества сравнима с
энергией их взаимодействия (Екин Епот). В результате связи между
частицами оказываются неустойчивыми, легко нарушаемыми тепловым
движением. Частицы часто меняют своих ближайших соседей, совершая так
называемые перескоки с места на место, чем и объясняется текучесть
жидкостей.
1
В твёрдом состоянии средняя энергия движения частиц вещества не
превышает энергию межатомных или межмолекулярных связей (Екин < Епот).
Перескоки частиц совершаются крайне редко, и вещество длительное время
сохраняет свою форму, т.е. остаётся твёрдым.
С изменением температуры или давления изменяется соотношение между
средней энергией движения частиц вещества и средней энергией их
взаимодействия. Повышение температуры приводит к возрастанию Екин , а
повышение давления – к возрастанию Епот , и наоборот. Как следствие
наблюдается переход вещества из одного агрегатного состояния в другое.
Практика использования различных материалов свидетельствует о том,
что чаще находят применение материалы, находящиеся в твёрдом состоянии.
1.2. Аморфное и кристаллическое состояние твёрдых тел.
Вещества, находящиеся в твёрдом состоянии, могут быть либо
аморфными, либо кристаллическими. Аморфное состояние твёрдых тел
характеризуется тем, что атомы, молекулы или ионы вещества располагаются
в пространстве хаотически. Аналогичную внутреннюю структуру имеют
жидкости, но в них частицы вещества за счёт энергии теплового движения
совершают частые перескоки с места на место, что является причиной
текучести.
В
аморфных
материалах
более
сильное
взаимодействие
удерживает частицы вещества вместе и при той же температуре не позволяет
им совершать частые перескоки. В результате образец остаётся твёрдым и не
течёт, хотя и имеет структуру жидкости. Учитывая вышесказанное, аморфное
состояние обычно отождествляют с переохлаждённой жидкостью, у которой
бесконечно высокая вязкость. С повышением температуры вязкость этой
«твёрдой
жидкости»
плавно
понижается,
вещество
размягчается
и
постепенно переходит из твёрдого состояния в жидкое. Примером аморфного
материала является обычное оконное стекло, а также янтарь - окаменевшая
смола древних деревьев.
2
Кристаллические материалы переходят в жидкое состояние «скачком»,
т.е. при постоянной температуре, называемой температурой плавления.
Обратный переход осуществляется также при постоянной температуре,
называемой температурой кристаллизации.
В кристаллических твёрдых телах частицы вещества располагаются в
пространстве
упорядоченно,
т.е.
выстроены
правильными
рядами,
плоскостями, симметричными блоками, что придаёт отдельным кристаллам
(монокристаллам) характерную правильную огранку. Кристаллическое
состояние твёрдых тел встречается в природе чаще, чем аморфное, поскольку
обладает меньшей свободной энергией и, в силу этого, является более
стабильным. С течением времени многие аморфные тела стремятся перейти в
кристаллическое
состояние.
Примерами
кристаллических
материалов
являются различные горные минералы (кварц, гранит, рубин, алмаз и т.д.),
соль, речной песок, глина, состоящая в основном из мелких кристаллов Al2O3
, а также металлы и сплавы, которые в отличие от монокристаллов имеют
поликристаллическое строение, т.е. состоят из множества микроскопических
кристалликов
неправильной
формы
(зёрен),
случайным
образом
ориентированных в пространстве.
Необходимо отметить, что одно и то же вещество может быть получено
как в кристаллическом, так и в аморфном состоянии. Например, в металлах и
сплавах при их сверхбыстром охлаждении из жидкого или газообразного
состояний не успевает сформироваться упорядоченная кристаллическая
структура и образуется аморфное твёрдое тело (metal glass - металлическое
стекло). При этом свойства аморфного металла могут заметно отличаться от
свойств кристаллического образца, что свидетельствует о важности
внутренней атомной структуры материала в формировании его свойств.
Аморфное состояние металлов чаще всего оказывается крайне нестабильным
при комнатной температуре. С течением времени наблюдается переход из
такого состояния в более стабильное кристаллическое состояние и этот
процесс ускоряется с повышением температуры. В тоже время путём подбора
3
химического состава металлических материалов их аморфное состояние
иногда удаётся застабилизировать. Примером может служить металлическое
стекло
Fe80B20,
аморфное
состояние
которого
является
достаточно
стабильным при комнатной и более высоких температурах.
1.3. Понятие кристаллической решётки.
Для описания упорядоченного расположения частиц вещества в
кристаллах
используют
некую
геометрическую
модель,
называемую
кристаллической решёткой. Кристаллическая решётка представляет собой
воображаемую пространственную координатную сетку, узлы которой
отображают расположение в пространстве центров тяжести атомов, молекул
или ионов кристалла. Поскольку частицы в кристаллах располагаются
закономерно, нет необходимости изображать всю пространственную сетку,
достаточно ограничиться изображением системы координат и минимальной
группы повторяющихся в ней узлов. Такую минимальную группу узлов,
периодически повторяющихся в пространстве, называют элементарной
ячейкой. В общем случае элементарная ячейка имеет вид параллелепипеда,
частным случаем которого является куб (рис. 1).
узлы – центры тяжести
частиц вещества,
в частности, атомов
Z
c
β
a
атомы
α
b
Y
γ
X
Рис. 1. Простая кубическая элементарная ячейка.
4
Рёбра элементарного параллелепипеда (a, b, c) и его углы (α, β, γ)
называют параметрами элементарной ячейки. Соотношения между этими
параметрами определяют форму элементарной ячейки и соответствующую
систему симметрии. Всего существует 7 систем симметрии:
1) триклинная
a ≠ b ≠ c, α ≠ β ≠ γ ≠ 90°;
2) моноклинная
a ≠ b ≠ c, α = β = 90°, γ ≠ 90°;
3) ромбическая
a ≠ b ≠ c, α = β = γ = 90°;
4) ромбоэдрическая a = b = c, α = β = γ ≠ 90°;
Если
5) гексагональная
a = b ≠ c, α = β = 90°, γ = 120°;
6) тетрагональная
a = b ≠ c, α = β = γ = 90°;
7) кубическая
a = b = c, α = β = γ = 90°.
элементарную
ячейку
перемещать
(транслировать)
вдоль
координатных осей OX, OY и OZ с периодами, соответственно a, b и c, то
можно воспроизвести всю пространственную кристаллическую решётку.
Параметры элементарной ячейки a, b и c называют также периодами
кристаллической решётки. По своему физическому смыслу это расстояния
между центрами тяжести соседних частиц, в частности атомов, сближенных
в кристаллах до соприкосновения. По порядку величины a, b и c составляют
0,1 нанометра (1нм это 10-9м) или 1 Ангстрем (1Å = 10-10 м).
Элементарная ячейка, изображённая на рис. 1, относится к числу простых
(примитивных) ячеек. Но возможны и более сложные ячейки, содержащие
дополнительные
узлы,
расположенные
либо
в
центре
всех
граней
элементарного параллелепипеда (гранецентрированная ячейка), либо в
центре верхней и нижней грани (базоцентрированная ячейка), либо в центре
объёма (объёмоцентрированная ячейка). Всего насчитывается 14 типов
элементарных
ячеек
(трансляционных
решёток
Бравэ),
которые
неравномерно распределены по 7 системам симметрии. В частности,
триклинной системе симметрии принадлежит только одна примитивная
5
ячейка,
а
кубическая
система
симметрии
содержит
примитивную,
объёмоцентрированную и гранецентрированную ячей-ки.
1.4. Структура кристаллов.
Следует различать понятия кристаллическая решётка и структура
кристалла. Структура кристалла – это физическая реальность, конкретное
расположение в пространстве различных атомов. Кристаллическая решётка –
это геометрический образ структуры, отражающий лишь симметрию
кристаллического
пространства
(симметрию
расположения
частиц
кристалла). Для более полного описания структуры кристаллов используют
понятие базис. Базисом называют совокупность определённым образом
расположенных в пространстве различных атомов, приходящихся на одну
элементарную ячейку. Т.е. перечисляются все полностью принадлежащие
одной элементарной ячейке атомы, вместе с их координатами в этой ячейке.
Таким образом, если элементарная ячейка определяет размер и форму
«элементарных кирпичиков», из которых построен кристалл, то базис
определяет
«материал»
этих
кирпичиков.
Трансляцией
базиса
воспроизводится весь рассматриваемый кристалл.
Базис сложных органических кристаллов, состоящих из больших
молекул, может включать в себя несколько тысяч различных атомов. В
простейшем случае, когда в узлах кристаллической решётки расположены
однотипные атомы или ионы, базис состоит только из одной или нескольких
таких частиц. С подобной ситуацией сталкиваются, в частности, при
описании структуры металлов, когда за узлы кристаллической решётки
принимают центры тяжести их атомов (ионов). Если структуру металла
описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то
базис состоит только из одного атома данного металла. (Действительно,
здесь каждый атом, расположенный в узле кристаллической решетки
находится
на
пересечении
8
аналогичных
ячеек
и
принадлежит
рассматриваемой ячейке только на ⅛ часть, а поскольку таких узлов в ячейке
8,
то
полностью
принадлежит
ей
6
ровно
один
атом).
В
случае
объёмоцентрированной ячейки базис составляют 2 атома металла (атом в
центре
ячейки
полностью
принадлежит
данной
ячейке),
а
гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах
граней, принадлежит рассматриваемой ячейке только на ½ часть).
Система симметрии, величина периодов решётки и базис полностью
определяют кристаллическую структуру конкретного материала. Если
известны эти параметры, то известной считается и структура кристалла.
Однако для более полного отражения плотности упаковки атомов в
кристаллах иногда используют такие дополнительные параметры как
координационное число и коэффициент компактности. Координационным
числом называют число ближайших равноудалённых соседей любого атома.
Если в качестве примера рассматривать структуру, изображенную на рис. 1,
то для неё координационное число равно шести. Коэффициент компактности
(степень компактности) представляет собой отношение объёма, занятого
атомами, ко всему объёму элементарной ячейки. В случае чистых металлов
коэффициент компактности может достигать величины 0,74. Это означает,
что 74 % объёма металла занято атомами, остальную его часть составляют
пустоты (поры).
1.5. Кристаллографические направления и атомные плоскости.
В кристаллографии часто возникает потребность выделять то или иное
направление в кристалле, обозначать те или иные атомные плоскости,
отдельные атомы или узлы кристаллической решётки. Для этого необходимо,
прежде всего, выбрать систему координат. Как было показано выше, в
кристаллическом пространстве система координат органически связана с
элементарной ячейкой: начало отсчёта совмещено с одним из узлов
кристаллической решётки, а координатные оси направлены вдоль рёбер
элементарной ячейки. При таком выборе системы координат каждому узлу
(точке кристаллического пространства) может быть поставлен в соответствие
радиус-вектор r (рис. 2).
Z
7
№1
2
3
c
1
b
a
№2
r
№4
Y
№3
X
Рис. 2. Система координат в кристалле.
r na mb pc ,
(1)
где a, b, c – векторы элементарных трансляций, по модулю равные периодам
решётки, а
n, m, p – числа. Эти числа могут быть целыми, если
рассматриваемый
узел
находится
в
вершинах
элементарного
параллелепипеда, или дробными, если узел (точка) расположены на его
гранях или внутри объёма. Числа n, m, p называют координатами
(индексами) узла и помещают их в двойные квадратные скобки. Если индекс
получается отрицательным, то знак минус ставится над соответствующим
числом. Например, узел №1 на рис. 2 имеет координаты [[0 1 1]], узел №2 [[1 1 0]], узел №3 - [[1 2 0]], а точка №4, расположенная в середине ребра
элементарной ячейки, имеет координаты [[0 2 1/2]].
Любое направление, в том числе и в кристалле, может быть задано с
помощью вектора или совокупности двух точек, являющихся начальной и
конечной точками вектора. Если в качестве начальной точки вектора
использовать начало системы координат, то для описания конкретного
направления в кристалле будет достаточно одной точки, всегда задающей в
кристаллическом пространстве конкретный радиус-вектор r (рис.2).
Координаты этой точки (узла), помещённые в квадратные скобки, называют
индексами
кристаллографического
направления.
Если
координаты
получаются отрицательными, то знак минус ставится над соответствующим
8
индексом. Если радиус-вектор указывает на точку, имеющую дробные
координаты, то дроби приводят к общему знаменателю, который затем
отбрасывается. Например, направление 1 на рис. 2 имеет индексы [1 1 1], а
направление, определяемое точкой №4, будет иметь индексы [0 2 ½] → [0 4
1]. Координатная ось ОХ имеет индексы [1 0 0], ОY – [0 1 0], ОZ – [0 0 1].
Необходимо отметить, что параллельные векторы в кристаллическом
пространстве являются эквивалентными и задают фактически одно и тоже
направление. Точно также являются физически эквивалентными все узлы
кристаллической решётки. Поэтому, если вектор, задающий направление,
исходит не из начала системы координат, его можно параллельным
переносом мысленно переместить в начало системы координат, либо начало
отсчёта совместить с начальной точкой вектора. Это упрощает процедуру
нахождения индексов направления. Например, на рис. 2, векторы 2 и 3
исходят не из начала системы координат. После их параллельного переноса в
начало отсчёта не трудно установить, что направление 2 имеет индексы
[ 1 1 0], а направление 3 – [ 1 0 1].
Положение атомной плоскости в кристалле определяется по длине
отрезков ОА, ОВ и ОС, которые плоскость отсекает на координатных осях
ОХ, OY и OZ (рис. 3).
Z
С
В
О
Y
А
X
Рис. 3. Определение положения атомной плоскости.
9
Длину отрезков ОА, ОВ и ОС указывают в единицах, кратных периодам
кристаллической решётки: ОА = n·a, ОВ = m·b, ОС = p·c. Далее находят
числа обратные n, m, p. Полученные дроби приводят к общему знаменателю,
который затем отбрасывают. В результате получают три целых числа h, k, l,
которые называют индексами атомной плоскости или индексами Миллера и
помещают в круглые скобки. Так, если плоскость, изображенная на рис. 3,
отсекает на координатных осях отрезки ОА = 1·a, ОВ = 2·b и ОС = 3·c, то её
индексами будут числа (6 3 2), которые определяются по схеме: 1; 2; 3 →
1/1; 1/2; 1/3 → 6/6; 3/6; 2/6 → 6 3 2.
Поскольку все узлы кристаллической решётки эквивалентны и могут с
равным правом выступать в роли центра координат, перемещение центра
отсчёта или атомной плоскости на расстояние, кратное периодам решётки, не
приводит к изменению индексов плоскости. Другими словами, все
параллельные атомные плоскости в кристалле идентичны и имеют
одинаковые индексы. Это находит своё отражение в том, что при вычислении
индексов атомной плоскости общий множитель выносится за скобки и
отбрасывается. Например, плоскости типа ( 1 1 1 ), (2 2 2), (3 3 3) и т.д.,
являются по сути одной и той же плоскостью, имеющей индексы (1 1 1).
Чем ближе к началу координат находится точка пересечения атомной
плоскости
с
координатной
осью,
тем
больше
численное
значение
соответствующего индекса, и наоборот. Если атомная плоскость не
пересекает координатную ось, т.е. располагается параллельно ей, то
соответствующий индекс принимает значение 0. Так, плоскость F на рис. 4
имеет индексы (1 0 0), а плоскость G – (1 1 0).
Z
(1 0 0)
F
(1 1 0)
G
F
О
10
Y
X
Рис. 4. Примеры атомных плоскостей.
Совокупность физически эквивалентных и не параллельных атомных
плоскостей
называют
семейством
плоскостей.
Индексы
семейства
плоскостей помещают в фигурные скобки. Если взять в качестве примера
кристалл с кубической симметрией, то здесь физически эквивалентными
являются атомные плоскости (1 0 0), (0 1 0) и (0 0 1), которые образуют
семейство с индексами {1 0 0}.
1.6. Поликристаллическое (зернистое) строение материалов.
Кристаллический материал может выглядеть как единый, отдельный
кристалл, т.е. представлять собой монокристалл, а может состоять из
множества
мелких
кристалликов
(зёрен),
образующих
некоторую
целостность. Такое строение материалов называют поликристаллическим.
Подобное поликристаллическое (зернистое) строение наблюдается, в
частности, у металлов и сплавов, затвердевших в обычных условиях. Каждое
отдельное зерно поликристаллического металла или сплава является
микроскопическим кристалликом неправильной формы. Размер зёрен
колеблется в пределах от десятых долей микрона до нескольких
миллиметров. Зёрна отделены друг от друга поверхностью раздела или
границей, представляющей собой переходной слой, толщиной порядка 5-10
межатомных расстояний. На протяжении границы кристаллическая решётка
одного зерна плавно переходит в кристаллическую решётку соседнего зерна.
Порядок расположения атомов на границах зёрен сильно нарушен. Угол
разориентации кристаллических решёток в соседних зёрнах (угол α) является
произвольным (рис 5.).
α
11
α - угол разориентации кристаллических решёток
в соседних зёрнах.
Рис. 5. Ориентация кристаллических решёток в соседних зёрнах.
Сами зерна состоят из фрагментов, которые в свою очередь делятся на
блоки. Угол разориентации кристаллических решёток в соседних фрагментах
не превышает 5º, а для соседних блоков составляет величину от нескольких
минут до нескольких секунд. По этой причине границы блоков и фрагментов
называют малоугловыми границами.
Причиной зернистого строения металлов и сплавов является то, что они
кристаллизуются сразу из нескольких центров. В начальный момент
затвердевания в жидком расплаве появляются зародыши кристаллов, которые
начинают расти. В следующий момент времени появляется очередная порция
зародышей, которые также растут. И так до тех пор, пока весь материал не
закристаллизуется. На заключительном этапе кристаллизации отдельные
кристаллики приходят в соприкосновение, мешают друг другу расти, и
поэтому приобретают неправильную форму – форму зёрен.
Наблюдать зернистую структуру металлических материалов можно
только при большом увеличении на специально подготовленных образцах.
Зернистую структуру материалов, наблюдаемую в микроскоп, называют
микроструктурой. Фрагменты зёрен относят к тонкой структуре, а блоки – к
сверхтонкой структуре материала.
Поскольку металлы и сплавы являются непрозрачными материалами, то
для
изучения
их
микроструктуры
необходим
специальный
металлографический микроскоп, работающий по принципу отражения
световых лучей от доведённой до зеркального блеска, полированной
поверхности образца. Для выявления зёрен полированную поверхность
12
образца подвергают травлению, т.е. обрабатывают различными реактивами, в
частности, кислотами. Кислота в первую очередь разъедает границы зёрен и
на их месте появляются углубления, которые не отражают, а рассеивают
свет, падающий на поверхность образца. В результате границы зёрен
становятся видимыми и обнаруживаются под микроскопом в виде тёмных
полосок.
Образец металлического материала, специально подготовленный для
изучения его микроструктуры, называют микрошлифом.
1.7. Анизотропия кристаллов.
Анизотропия – это неравенство свойств материала в различных
направлениях. Если материал в различных направлениях обнаруживает
одинаковые свойства, то такой материал считают изотропным, в противном
случае – анизотропным.
Анизотропией свойств обладают все кристаллы. В кристаллах, по
причине их особого, упорядоченного внутреннего строения, атомы в
различных направлениях располагаются с различной плотностью, т.е. на
различных расстояниях друг от друга. В результате силы межатомного
взаимодействия, а, следовательно, и свойства кристаллов в различных
направлениях оказываются различными. Например, в кубическом кристалле
в направлении координатных осей [1 0 0], [0 1 0] и [0 0 1] частицы
располагаются на расстоянии друг от друга равном а (рис. 2). В направлении
диагонали [1 1 0], частицы располагаются на расстоянии
направлении пространственной диагонали [1 1 1] –
2 а, а в
3 а. Очевидно, такой
кристалл легче разрывается в направлении [1 1 1], чем в направлении
координатных осей, где он обнаруживает наибольшую прочность.
Анизотропия распространяется практически на все свойства кристаллов.
Так кристалл в одном направлении может лучше, чем в другом проводить
тепло, электрический ток, свет, лучше намагничиваться и т.д. При этом, чем
13
ниже система симметрии кристалла, тем сильнее проявляется анизотропия
его свойств.
В аморфных материалах, из-за хаотического внутреннего строения, атомы
в
различных
направлениях
располагаются
примерно
с
одинаковой
плотностью. В результате аморфные вещества в различных направлениях
обнаруживают
одинаковые
свойства,
т.е.
оказываются
материалами
изотропными.
Металлы и сплавы, полученные в обычных условиях, также очень часто
обнаруживают равенство свойств в различных направлениях, хотя и
являются
материалами
кристаллическими.
Это
объясняется
их
поликристаллическим (зернистым) строением. Отдельные зёрна материала,
будучи кристаллами, в различных направлениях обладают различными
свойствами, однако в целом материал оказывается изотропным, поскольку
зёрна случайным образом ориентированы в пространстве. Такую изотропию
называют ложной изотропией или квазиизотропией. Аналогично, древесина,
имеющая волокнистую структуру, в различных направлениях обнаруживает
различные свойства. В тоже время лист, получений из древесных опилок,
оказывается изотропным.
Если
зёрна
металла
ориентированы
преимущественно
в
одном
направлении, т.е. материал обнаруживает текстуру, его свойства вновь
начинают зависеть от направления, и он оказывается анизотропным.
14