Независимое расследование по теме «Галогены
реклама

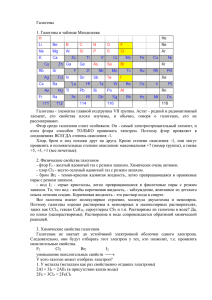
Независимое расследование по теме «Галогены». Цель урока: систематизировать и углубить знания о галогенах на основании их сравнительной характеристики в свете трех форм существования элементов; повторить понятия «химическая связь», «кристаллические решетки», «окисление и восстановление», «скорость химической реакции», «химическое равновесие»; уметь сравнивать свойства простых веществ, работать с учебником, делать выводы; развить познавательный интерес, воспитание культуры умственного труда. Урок в форме ролевой игры. Оборудование: мультимедийный проектор, диск с презентацией урока; инструктивные карточки, фторсодержащие зубные пасты, хлор – и бромсодержащие материалы и лекарства. Ступка с пестиком, пипетка, фарфоровая чашка, пластилин и спички для моделирования кристаллической решетки. Реактивы: натрий, алюминий в порошке, кристаллики йода, вода. Контроль знаний (10 мин): фронтальный опрос - дайте характеристику неметаллов по положению в ПСХЭ; - объясните ОВ свойства неметаллов; - каковы физические свойства неметаллов; - что такое аллотропия? Приведите примеры; - каков химический состав живых организмов? У доски двое решают задачи в конце §15, № 3,4.(параллельно с фронтальным опросом). План урока. Положение галогенов в ПС и строение атомов. Следственный эксперимент физиков. Следственный эксперимент химиков. Следственный эксперимент биологов. Следственный эксперимент историков. Выводы. Закрепление. На дом. Тема урока, план и все этапы проецируется через мультимедийный проектор. Ход урока: Сегодня мы продолжим знакомиться с неметаллами, с элементами 7-ой главной подгруппы - галогенами и их свойствами. Сначала определим их положение в периодической таблице и дадим им характеристику. Строение атомов. F+9)2)7 Cl +17)2)8)7 Br +35)2)8)18)7 I +53)2)8)18)18)7 1s22s22p5 1s22s22p63S23p5 1s22s22p63S23p63d104s2 4p5 1s22s22p63S23p63d104s2 4p6 4d105s25p5 Для завершения слоя недостает 1 электрон. Проявляют окислительные свойства. В соединениях проявляют степень окисления –1(фтор как самый электроотрицательный элемент), а остальные галогены могут иметь и (+) степени окисления: +1,+3,+5,+7. Окислительная способность галогенов падает от фтора к йоду, это связано с увеличением порядкового номера элемента, заряда ядра атома и радиуса атома. А сейчас вы проведете независимое расследование о галогенах. Химия взаимосвязана и с биологией, и с геологией, и с физикой, и с другими науками. Для получения достоверных и разнообразных сведений о галогенах создадим оперативные группы физиков, биологов, химиков, историков. Каждая группа получает инструкцию по проведению расследования. Прочитать инструкцию, параграф учебника и записать данные в тетрадях, подготовиться к выступлению. Работа в группах по инструкции в течение 5 мин. На этапе сбора и обработки материала деятельность учащихся организована как групповая работа и предполагает как коллективный, так и индивидуальный способ получения знаний. Ученики знакомятся с учебной информацией, принимают самостоятельные решения, о ее важности и цели своего исследования, готовятся рассказать о результатах своего расследования. Выступления учащихся: Следственный эксперимент физиков. Галогены – простые вещества, двухатомные молекулы связаны ковалентной неполярной связью, в твердом состоянии имеют молекулярные кристаллические решетки. Вещество Фтор F2 Хлор Cl2 Бром Br2 Йод I2 Агрегатное состояние Г Г Ж Т Физические свойства галогенов. Цвет Запах светложелтый желтозеленый буроватокоричневый чернофиолетовый Резкий, Раздражающий Резкий, удушливый Резкий, зловонный резкий Темп.пл., ºС -220 Темп.кип. ºС -188 -101 -34 -7 +58 +114 +186 С увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия. С увеличением порядкового номера неметаллические свойства ослабевают, а металлические – усиливаются. Следственный эксперимент химиков Химические свойства Выступление учащихся, но опыты взаимодействия йода с натрием, с алюминием демонстрирует учитель. Химическая активность галогенов от фтора к йоду ослабевает. С металлами: (указать условия протекания реакций) F 2+ Zn = ZnF2 2Sb +3 Cl2= 2SbCl3 2 Sb + 5 Cl2 = 2SbCl5 2Fe + 3Cl2 = 2Fe Cl 3 Cu + Br2 = CuBr2 2Al + 3I2 = 2AlI3 H2 + Cl2= 2HCl Фтор реагирует с водородом необратимо, а остальные галогены в зависимости от условий могут давать и обратимую реакцию. Повторить понятие о химическом равновесии и способах его смещения (принцип Ле Шателье) Со сложными веществами: об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к йоду можно судить и по их способности вытеснять друг друга из растворов солей. Сl2 + 2NaBr = 2NaCl + Br2 Br2 +2KI = 2KBr + I2 Для фтора эта реакция не характерна, он взаимодействует с водой. 2F2+2H 2O= 4HF + O2 Следственный эксперимент биологов. Галогены - простые вещества, ядовиты. Элемент фтор входит в состав зубной эмали Участвует в обмене веществ в железах, мышцах, нервных клетках. Ионы хлора важнейшие элементы для живых клеток. Поступает в организм в форме хлорида натрия. Стимулирует обмен веществ. Содержится в плазме крови. В виде соляной кислоты входит в состав желудочного сока. Бром регулирует процессы возбуждения и торможения ЦНС. Используется для изготовления медицинских препаратов. Йод входит в состав гормона тироксина, которую вырабатывает щитовидная железа. Следственный эксперимент историков F получен в 1866г. фр. химиком Анри Муассан. Cl открыт в 1774г. швед. химиком К. Шееле. Br открыт в 1826г. фр. химиком А. Баларом. I открыт в 1811г. фр. Химиком Б. Куртуа. Выводы: Все галогены – неметаллы. В реакциях с металлами или менее электроотрицательными неметаллами галогены являются окислителями. Окислительная способность галогенов падает от фтора к иоду, это связано с увеличением порядкового номера элемента, заряда ядра атома и радиуса атома. Закрепление: Дайте сравнительную характеристику хлора и брома, указав: а) сходство; б) различие. Ответ поясните уравнениями реакции. Напишите уравнения химических реакций: Cl2 + ? = HCl Cl2 + ? = AlCl3 HCl+ ? = AlCl3+ ? Составьте электронные формулы хлороводорода и хлора. Укажите вид химической связи. На дом: §17, упр. 7,8.