В.В. НЕЧАЕВ, А.И. ПЛАТОВ
реклама

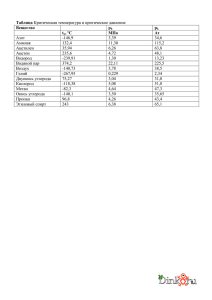
УДК 621.7/.9(06) Физика, химия и компьютерная разработка материалов В.В. НЕЧАЕВ, А.И. ПЛАТОВ1 Московский инженерно-физический институт (государственный университет) 1Всероссийский научно-исследовательский институт технической физики ИССЛЕДОВАНИЕ ПРИЧИН ПОЯВЛЕНИЯ УГЛЕРОДНЫХ ВКЛЮЧЕНИЙ В ТЭБ В ПРОЦЕССЕ ИХ ЭКСПЛУАТАЦИИ Установлены причины и найдены пути устранения выделения ультрадисперсного углерода между пластиной из никеля и слюдяной прокладкой внутри крышки термобатареи при подъеме рабочей температуры холодной части термоэлектрической батареи Термоэлектрические батареи (ТЭБ) показывают хорошие эксплуатационные качества при температуре холодной части 50С. Однако, при повышении температуры до 120С и вынужденной замене Cu на более жаропрочный Ni, на крышке батареи в процессе эксплуатации образуются каверны глубиной 10 мкм, наполненные аморфным углеродом. Что приводит к недопустимому увеличению теплового сопротивления батареи. Для теоретического исследования процесса использовался полный термодинамический анализ [1], количественно основанный на экспериментально определенных количествах реагентов в газовой фазе (см. табл.), полученных имитацией рабочих температурных параметров батареи, и по термохимическим данным [2]. Относительный состав газовой среды в кожухе ТЭБ (эксперимент) Соединение CН4 СО2 СО2 Н2 Относительное количество 95 10 2,5 1,5 На основании компьютерных расчетов предложен следующий механизм формирования состава газовой фазы внутри внешнего кожуха термобатареи. В начальной стадии разогрева системы, при температурах до 150 С, из твердой конструкционной органики выделяются СН4, СО2 и С6Н6. При дальнейшем нагреве (до 250 С) начинаются реакции между диоксидом углерода и углеводородами с образованием СО и Н 2. При еще более высоких температурах (> 300 С) С6Н6 полностью вырабатывается. Поскольку эти выводы подтверждены экспериментом, то можно утверждать, что в данном температурном интервале достаточно быстро устанавливается химическое равновесие в газовой фазе. 96 ISBN 5-7262-0633-9. НАУЧНАЯ СЕССИЯ МИФИ-2006. Том 9 УДК 621.7/.9(06) Физика, химия и компьютерная разработка материалов Однако это допущение не справедливо по отношению к гетерогенной системе, в которой существует конденсированная фаза углерода. Термодинамическую возможность образования конденсированной фазы исследовали, вычисляя химическое сродство А по де Донде [3]. Поскольку, по расчетам A/RT 3 даже при температурах 450-500 С, то процесс выделения свободного углерода в нашей системе существенно неравновесен. Если принять для энергии активации химической реакции без катализатора типичное значение в 100 кДж/моль, то для скорости образования углерода получается очень малое значение 10-10 моль/см2/сек. Этот вывод косвенно подтверждается экспериментально: на внутренней поверхности кожуха даже следов аморфного углерода не обнаружено. Разумно предположить, что появление углерода на поверхности никеля объясняется его каталитической способностью; каталитических свойств меди для образования свободного углерода из углеводородов недостаточно. Сравнением величин парциальных давлений в гомогенной и гетерогенной системах показано, что свободный углерод появляется по двум реакциям: в основном из-за диссоциации метана: СН4 = С(ам) + 2Н2, (1) и, в меньшей степени, восстановлением монооксида: СО + Н2 = С(ам) + Н2О (2) Слоистая структура слюды обеспечивает проникновение газовой среды сначала вдоль ее слоев вглубь устройства, а затем в поперечном направлении к поверхности никеля в глубине конструкции, где углерод выпадает в результате гетерогенных реакций с никелем как катализатором. Реакция (1) идет с двойным увеличением объема газовой фазы и возможным повышением местного давления до + 0,01 ати. Это приводит к возникновению конвективного потока Стефана [4], направленного наружу. В местах неплотного контакта частицы углерода механически вымываются потоком Стефана. В местах плотного прижатия слюды к никелю частицы углерода остаются на месте. Для устранения обсуждаемого вредного эффекта появления углерода свободную никелевую поверхность можно плакировать слоем меди. Список литературы 1. Моисеев Г.К., Вяткин Г.Н. Термодинамическое моделирование в неорганических системах. Челябинск: ЮУрГУ. 1999. 2. Gurvich L.V., Veitz I.V., et al. Thermodynamic Properties of Individual Substances / Fours edition in 5 volumes, Hemisphere pub Co. NY, L. Vol. 1 in 2 parts. 1989. 3. Де Донде Т., Ван Риссельберг. Теория химического сродства. М.: Мир. 1982. ISBN 5-7262-0633-9. НАУЧНАЯ СЕССИЯ МИФИ-2006. Том 9 97 УДК 621.7/.9(06) Физика, химия и компьютерная разработка материалов 4. Франк-Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. М.: Наука. 1987 (изд. IV). 98 ISBN 5-7262-0633-9. НАУЧНАЯ СЕССИЯ МИФИ-2006. Том 9