Государственное бюджетное профессиональное образовательное учреждение Республики Крым «Приморский промышленный техникум»
реклама
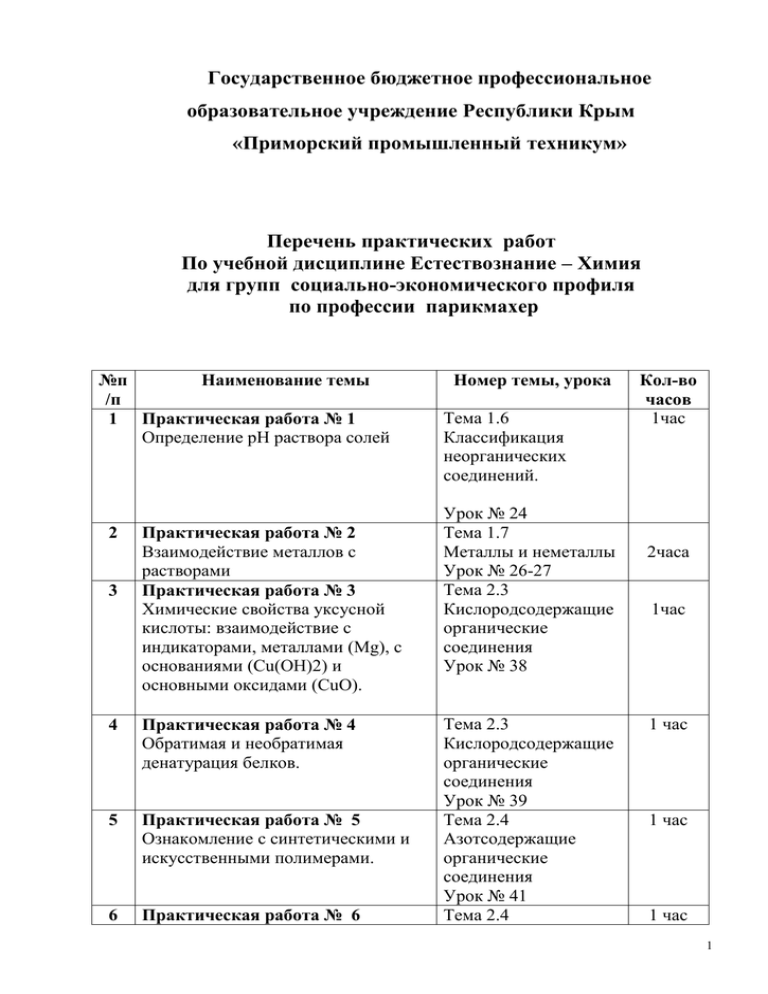
Государственное бюджетное профессиональное образовательное учреждение Республики Крым «Приморский промышленный техникум» Перечень практических работ По учебной дисциплине Естествознание – Химия для групп социально-экономического профиля по профессии парикмахер №п Наименование темы /п 1 Практическая работа № 1 Определение рН раствора солей 2 3 Практическая работа № 2 Взаимодействие металлов с растворами Практическая работа № 3 Химические свойства уксусной кислоты: взаимодействие с индикаторами, металлами (Mg), с основаниями (Cu(OH)2) и основными оксидами (CuO). 4 Практическая работа № 4 Обратимая и необратимая денатурация белков. 5 Практическая работа № 5 Ознакомление с синтетическими и искусственными полимерами. 6 Практическая работа № 6 Номер темы, урока Тема 1.6 Классификация неорганических соединений. Урок № 24 Тема 1.7 Металлы и неметаллы Урок № 26-27 Тема 2.3 Кислородсодержащие органические соединения Урок № 38 Тема 2.3 Кислородсодержащие органические соединения Урок № 39 Тема 2.4 Азотсодержащие органические соединения Урок № 41 Тема 2.4 Кол-во часов 1час 2часа 1час 1 час 1 час 1 час 1 Определение различных видов химических волокон. Азотсодержащие органические соединения Урок № 42 Практическая работа №1 Естествознание - химия Тема: «Гидролиз солей» Цель работы: изучение гидролиза солей разных типов, формироване навыков практической работы с химическими веществами и оборудованием. Задачи работы: 1. Научиться определять реакцию среды растворов солей различных типов. 2. Исследовать растворы различных солей на протекание реакций гидролиза. Отработать навыки составления уравнений реакций гидролиза. 3. Отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии. Краткие теоретические сведения. Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кисло. Классификация электролитов приведена в таблице 1. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами. Таблица 1. Классификация электролитов Степень электролитической Сила электролита Примеры диссоциации 2 кислоты α > 30% 3% < α < 30% сильные основания Меп+(OH)n Р., М. в воде средние соли Р. в воде кислоты HF , H2SO3, Н3PO4 основания Fe(OH)3 кислоты α < 3% H2SO4, HNO3,HCl, HBr, HI слабые основания соли H2S, H2CO3, H2SiO3, СН3СООH Меп+(OH)n Н. в воде и NH4OH М. в воде Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит [H+] = [OH-] - среда нейтральная, [H+] > [OH-] - среда кислая, [OH-] > [H+] - среда щелочная. В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей, которые представлены в таблице 2. Таблица 2. Типы гидролиза солей 1. Соль образована катионом слабого 2. Соль образована катионом основания и анионом сильной сильного основания и анионом слабой кислоты. кислоты. (CuCl2, NH4Cl, Fe2(S04)3 — гидролиз по (К2С03, Na2S — гидролиз по аниону) катиону) К2С03 2К+ + С032- CuCl2 Cu2+ + 2Сl- Н2О Н+ + ОН- Н2О Н+ + ОН- 2К+ + С032-+ Н+ + ОН - НСО3- + 2К+ + ОН- Cu2+ + 2Сl- + Н+ + ОН- CuОН+ + Н++ 2Сl- Выводы: [ Н+] < [ОН-] pH > 7 3 Выводы: [ Н+] > [ОН-] pH < 7 среда раствора щелочная окраска среда раствора кислая окраска индикаторов изменяется индикаторов изменяется 3. Соль образована катионом слабого 4. Соль образована катионом основания и анионом слабой кислоты. сильного основания и анионом ((NH4)2CO3, CH3COONH4, Na2CO3 — сильной кислоты. (гидролизу не гидролиз по катиону и по аниону) подвергаются (NaCl, К2SО4, Ba(N03)2). Fe2 (C03)3 2Fe 3+ + 3C032- NaCl Na+ + Сl- Н2О Н+ + ОН- Н2О Н+ + ОН- 2Fe 3+ + 3C032-+ Н+ + ОН- Fe (ОН)3+ Na+ + Сl- + Н+ + ОН- Na+ + Сl- + Н+ + C02 + Н2О идёт до конца ОН Выводы: Характер среды Выводы: [ Н+] = [ОН-] pH = 7 определяется относительной силой среда раствора нейтральная кислоты и основания. окраска индикаторов не изменяется Приборы и реактивы: - растворы солей: карбонат калия, карбонат натрия, нитрат калия, сульфат алюминия, сульфат железа (III), сульфат меди (II), хлорид железа (III), хлорид натрия, хлорид цинка; - универсальная индикаторная бумажка, штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка. Порядок выполнения работы. Опыт № 1. Испытание растворов солей индикатором. Гидролиз солей. Ход работы: На полоску универсальной индикаторной бумаги нанести пипеткой по одной капли раствора каждой соли (из списка реактивов). Оформление отчета: результаты наблюдений занести в таблицу №3. Таблица 3. Определение среды растворов солей 4 Формула соли 1. К2СО3 2.Na2CO3 3. KNO3 4. Al2(SO4)3 5.Fe2(SO4)3 6.CuSO4 7.FeCl3 8.NaCl 9.ZnCl2 Цвет индикатора Нейтраль Кислая ная Щелочна ясиний Какими основаниями и кислотами kt основания и an кислоты сильными () или слабыми () соль образована: Задание. После заполнения таблицы составьте уравнения реакций гидролиза солей, растворы которых имели, кислую или щелочную среду раствора. С помощью уравнений реакций объясните происходящие реакции. Опыт № 2. Получение соли карбоната алюминия и наблюдение за её гидролизом. Ход работы: К 1 мл раствора соли алюминия прилейте 1 мл раствора карбоната натрия. Оформление отчета: записать наблюдения и уравнение гидролиза в таблицу: Условия проведения. Наблюдения Уравнения гидролиза. Вывод Уравнение гидролиза: Al2 (SO4)3 + 3Na2СО3→ Al2 (CO3)3+3Na2SО4 Al2 (CO3)3 2Al 3+ + 3CO32Н2О ОН- + Н+ 2Al 3+ + 3CO32-+ОН- + Н+ Al(ОН)3+ CO2 + Н2О идёт до конца 5 Опыт № 3. Экспериментальная задача. Ход работы: В трёх, пронумерованных, пробирках находятся растворы солей: K2SO3, Al(NO3)3, NaCl. Определите, в какой пробирке находятся данные соли. Алгоритм проведения опыта по определению веществ: 1. Дотронуться стеклянными палочками из пронумерованных пробирок до индикаторной бумага, записать цвет индикаторной бумага и сделать заключение о реакции среды раствора. 2. Записать уравнение гидролиза предложенных солей и сделать выводы (назовите среду раствора каждой соли). 3. Сопоставить формулы солей и цвет индикаторной бумаги. Оформление отчета: записать наблюдения и уравнение гидролиза в таблицу: Формулы солей 1. K2SO3 2. Al(NO3)3 3. NaCl. Выводы : Цвет индикаторной Уравнение бумаги раствора гидролиза, среда Как реакция среды растворов зависит от типов солей? Практическая работа № 3 Естествознание - химия Тема: Химические свойства уксусной кислоты: взаимодействие с индикаторами, металлами (Mg), с основаниями (Cu(OH)2) и основными оксидами (CuO). Цель: проверить умения обучающихся применять теоретические знания о свойствах уксусной кислоты при проведении практической работы. Формировать навыки практической работы с химическими веществами и оборудованием. 1. Налейте в четыре пробирки по 2 мл раствора уксусной кислоты. Осторожно понюхайте этот раствор. Что ощущаете? Вспомните, где вы применяете уксусную кислоту дома. 2. В одну пробирку с раствором уксусной кислоты добавьте несколько капель раствора лакмуса. Что наблюдаете? Затем нейтрализуйте кислоту избытком щелочи. Что наблюдаете? Запишите уравнение проведенной реакции. 6 3. В две оставшиеся пробирки с раствором уксусной кислоты добавьте: в одну-гранулу цинка, в другую несколько крупинок оксида меди (II) и подогрейте ее. Что наблюдаете? Запишите уравнения проведенных реакций. Ход выполнения лабораторной работы: 1. Раствор имеет характерный резкий запах. Уксусная кислота в быту применяется в кулинарии для гашения соды, в пищевых целях, при мариновании овощей. 2.Сначала раствор окрасился в красный цвет. При добавлении в ту же пробирку избытка щелочи, получаем раствор синего цвета, т.к. реакция среды изменилась на щелочную. CH3COOH + NaOH=CH3COONa + H2O 3. При добавлении цинка выделяются пузырьки водорода: 2CH3COOH + Zn=(CH3COO)2Zn + H2 При добавлении оксида меди он растворяется и образуется ярко-голубой раствор: 2CH3COOH + CuO=(CH3COO)2Cu+ H2O Отчет оформите в виде таблицы: Химические свойства уксусной кислоты: взаимодействие с индикаторами, металлами (Mg), с основаниями (Cu(OH)2) и основными оксидами (CuO). 1-лакмус 3- гранулы цинка 2- NaOH 4- CuO Наблюдения Уравнения реакций (в трех видах) 1 2 3 4 Сделайте вывод в работе. Практическая работа №4. Тема: Обратимая и необратимая денатурация белков. Цель: изучить процесс денатурации белка, его причины. Оборудование и материалы: пробирки, штатив, растворы белка, концентрированной азотной кислоты, ацетон, спиртовка. 7 Денатурация Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.) Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация. Если воздействие сильное (100°), соли тяжелых металлов — свинца или ртути, сильные кислоты, органические растворители, то денатурация необратимая. При этом разрушаются все структуры, кроме первичной. Порядок выполнения работы. 1. Прилить воду к яичному белку. 2. Встряхнуть до образования однородного раствора. 3. Оценить свойства белка (прозрачность, растворимость, агрегатное состояние). 4. Отлить раствор в три пустые пробирки по 1 мл. 5. Зажечь спиртовку и нагреть пробирку № 1 полученный раствор белка. 6.В пробирку № 2 добавить 2 мл концентрированной азотной кислоты и перемешайте 7. В пробирку № 3 добавить 2 мл ацетона и перемешайте. 8. Оценить свойства белка (прозрачность, растворимость, агрегатное состояние). Результат оформите в виде таблицы: Ход работы. Что наблюдал? Пробирка № 1 Пробирка № 2 Пробирка № 3 9. Сделать вывод в тетради: а) Что явилось причиной денатурации? б) Что произошло в результате денатурации? в) Обратима ли данная денатурация? 8 Практическая работа № 5 Естествознание - химия Тема: «Ознакомление с синтетическими и искусственными полимерами». Цель: обобщить знания о высокомолекулярных органических соединениях, исследовать характерные свойства пластмасс, совершенствовать практические умения и навыки в выполнении химического эксперимента. Оборудование: спиртовка, пробирка, образцы изделий на основе полиэтилена и полистирола, раствор KMnO4,ацетон. Задание: двух пронумерованных пакетиках образцы изделий на основе полиэтилена и полистирола. Исследовать их свойства и определить. План : 1.Внешний вид изделия. 2.Отношение к нагреванию: изменение цвета, размягчается, плавится, появляется запах, можно или нет вытянуть в нити; 3. При разложении: Как продукт разложения взаимодействует с раствором KMnO4, Вr2; 4.Действие на растворители: ацетон, бензол, дихлорэтан. Вывод: в пакете № 1 _______________________________ В пакете № 2 ______________________________ 9 Практическая работа № 6 Естествознание -химия Тема: «Определение различных видов химических волокон». Цель: обобщить знания о высокомолекулярных органических соединениях, исследовать характерные свойства волокон, совершенствовать практические умения и навыки в выполнении химического эксперимента. Оборудование: спиртовка, пробирка, образцы изделий на основе хлопка и капрона, HNO3, H2SO4, NaOH , ацетон,таблицы на стр. 214-217 Задание: двух пронумерованных пакетиках образцы изделий на основе хлопка и капрона. Исследовать их свойства и определить каждое о плану. План : 1.Внешний вид изделия. 2.Отношение к нагреванию: изменение цвета, размягчается, плавится, появляется запах, можно или нет вытянуть в нити; 3. При разложении: Как продукт разложения действуют на индикаторы; 4.Действие кислот щелочей: взаимодействие с HNO3, H2SO4, NaOH 5.Действие на растворители: ацетон. Вывод: в пакете № 1 _______________________________ в пакете № 2 ______________________________ 10