Контрольная работа для обучающихся по программе УМК Г.Е Рудзитиса,... в 8 классе. Автор: Веретенникова С.В.
реклама

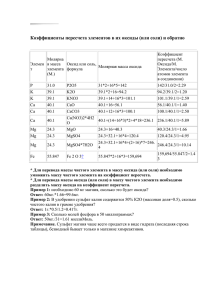
Контрольная работа для обучающихся по программе УМК Г.Е Рудзитиса, Ф.Г Фельдмана в 8 классе. Автор: Веретенникова С.В. Место работы: МБОУ СОШ № 19 г. Нижний Новгород Контрольная работа за I четверть 8 класс. Вариант 1 1. Определите валентность элементов по формуле: HF, NH3, Cl 2O5, FeO. 2. Рассчитайте относительную молекулярную массу: Cl 2O5 3. Напишите формулы соединений с кислородом (оксидов): оксида калия, оксида кремния (IV), оксида водорода, оксида золота (III), оксида серы (VI) 4. Вычислите массу 0,5 моль КCl 5. Вычислите количество вещества водорода, прореагировавшего с кислородом с образованием 18 г воды. Контрольная работа за I четверть 8 класс. Вариант 2 1. Определите валентность элементов по формуле: HСl, PH3, Cl 2O7, Fe 2O3 2. Рассчитайте относительную молекулярную массу: NO2 3. Составьте химические формулы, пользуясь валентностью: IV V II III II S O, N O, Ba O, Al S 4. Вычислите массу 2 моль СаО 5. Вычислите массу кислорода, образовавшегося при разложении 180 г. воды. Контрольная работа за I четверть 8 класс . Вариант 3 1. Определите валентность элементов по формуле: HBr, CH4, N2O5, CuO. 2. Рассчитайте относительную молекулярную массу: Cl 2O7 3. Напишите формулы соединений с кислородом (оксидов): оксида магния, оксида хлора (VII), оксида кремния (IV), оксида золота (III), оксида серы (VI) 4. Вычислите массу 4 моль Мg O 5. Рассчитайте массу оксида углегода (IV), образовавшегося при разложении 10 г. СаСО3 Контрольная работа за I четверть 8 класс. Вариант 4 1. Определите валентность элементов по формуле: HF, PH3, CrO3, Fe 2O3 2. Рассчитайте относительную молекулярную массу: 3. IV CO2 Составьте химические формулы, пользуясь валентностью: IV II III II C O, N O, Ba O, Al S 4. Вычислите массу 0,2 моль ВаО 5. Сколько граммов железа вступило в реакцию, если при взаимодействии его с серой образовалось 132 г. сульфида железа (II)? Контрольная работа за I четверть 8 класс. Вариант 5 1. Определите валентность элементов по формуле: HF, NH3, Cl 2O5, FeO. 2. Рассчитайте относительную молекулярную массу: 3. Cl 2O5 Напишите формулы соединений с кислородом (оксидов): оксида калия, оксида кремния (IV), оксида водорода, оксида золота (III), оксида серы (VI) 4. Вычислите массу 4 моль К2 О 5. . Вычислите массу кислорода, образовавшегося при разложении 90 г. воды. Контрольная работа за I четверть 8 класс. Вариант 6 1. Определите валентность элементов по формуле: HСl, PH3, Cl 2O7, Fe 2O3 2. Рассчитайте относительную молекулярную массу: N 2O5 3. Составьте химические формулы, пользуясь валентностью: IV V II III II S O, N O, Ba O, Al S 4. Вычислите массу 0,5 моль ВаО 5. Рассчитайте массу оксида углерода (IV), образовавшегося при разложении 20 г. СаСО3 Контрольная работа за I четверть 8 класс Вариант 7 1. Определите валентность элементов по формуле: HBr, ,CH4, N2O5, CuО 2. Рассчитайте относительную молекулярную массу: ВаО 3. Напишите формулы соединений с кислородом (оксидов): оксида магния, оксида хлора (VII), оксида кремния (IV), оксида золота (III), оксида серы (VI) 4. Вычислите массу 2 моль К2 О 5. Вычислите количество вещества водорода, прореагировавшего с кислородом с образованием 180 г воды. Контрольная работа за I четверть 8 класс. Вариант 8 1. Определите валентность элементов по формуле: СаО, PH3, Cl 2O7, Fe 2O3 2. Рассчитайте относительную молекулярную массу: NO2 3. Составьте химические формулы, пользуясь валентностью: IV V II III II S O, N O, Ba O, Al S 4. Вычислите массу 2 моль Мg O 5. . Сколько граммов железа вступило в реакцию, если при взаимодействии его с серой образовалось 88 г. сульфида железа (II) ?