Образец решения стартового рейтинга
реклама
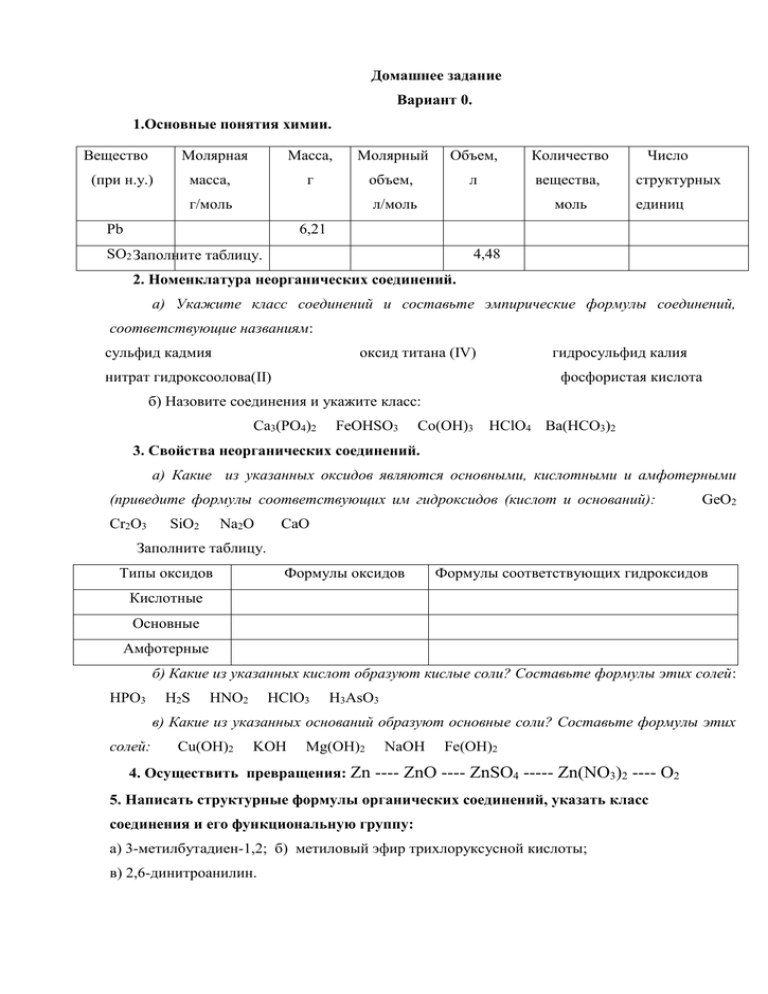
Домашнее задание Вариант 0. 1.Основные понятия химии. Вещество Молярная (при н.у.) масса, Масса, Молярный Объем, Количество г объем, л вещества, г/моль л/моль Pb моль Число структурных единиц 6,21 SO2 Заполните таблицу. 4,48 2. Номенклатура неорганических соединений. а) Укажите класс соединений и составьте эмпирические формулы соединений, соответствующие названиям: сульфид кадмия гидросульфид калия оксид титана (IV) нитрат гидроксоолова(II) фосфористая кислота б) Назовите соединения и укажите класс: Ca3(PO4)2 FeOHSO3 Co(OH)3 HClO4 Ba(HCO3)2 3. Свойства неорганических соединений. а) Какие из указанных оксидов являются основными, кислотными и амфотерными (приведите формулы соответствующих им гидроксидов (кислот и оснований): Cr2O3 SiO2 Na2O GeO2 CaO Заполните таблицу. Типы оксидов Формулы оксидов Формулы соответствующих гидроксидов Кислотные Основные Амфотерные б) Какие из указанных кислот образуют кислые соли? Составьте формулы этих солей: HPO3 H2S HNO2 HClO3 H3AsO3 в) Какие из указанных оснований образуют основные соли? Составьте формулы этих солей: Cu(OH)2 KOH Mg(OH)2 NaOH Fe(OH)2 4. Осуществить превращения: Zn ---- ZnO ---- ZnSO4 ----- Zn(NO3)2 ---- O2 5. Написать структурные формулы органических соединений, указать класс соединения и его функциональную группу: а) 3-метилбутадиен-1,2; б) метиловый эфир трихлоруксусной кислоты; в) 2,6-динитроанилин. Образец решения некоторых заданий 1. Основные понятия. Вещество (агрегат. состояние Молярная масса Масса Молярный Объе Количество Число m, г объем, м V, вещества , структур- л ν или n моль ных единиц при н.у.) N Для расчетов применяются формулы: m(x) M(x) (х) V(x) и только для газов: (х) V M ν или n – количество вещества, измеряется в моль х - вещество m(х) – масса вещества в г (граммах) M (х)– молярная масса вещества или масса 1 моль вещества. Определяется по таблице Менделеева, измеряется в N – число структурных единиц (молекул или атомов) NA – постоянная (или число) Авогадро, показывает, сколько структурных единиц содержится в 1 моль вещества. V(х) – объем газа в л (литрах) VM – молярный объем любого газ, т.е. объем 1 моль газа, измеряется в При н.у. Используя три формулы для расчета ν или n , заполним таблицу. . 1. Al2(SO4)3 дано: N = 12,04· 10 22 молекул решение: Al2(SO4)3 , cоль — сульфат алюминия, твердое вещество при н.у. 1)по таблице Менделеева: М(Al2(SO4)3) = 2·М(Al) + 3·1·М(S) + 3·4·М(O) = 2·27 + 3·32 +12·16 = 342 г/ моль 2) 3) m(Al2(SO4)3) = ν·M = 0,2·342 = 68,4 г 4)VM и V(х) определить невозможно, т.к. при н.у. агрегатное состояние данного вещества твердое. 2. H2S дано: m(H2S) = 7,82 г решение: H2S , сероводород , при н.у. - газ 1) по таблице Менделеева: М(H2S ) = 2·М(H) + М(S ) = 2·1 + 32 = 34 г/ моль 2) 3) VM = 22,4 л/моль 4) V(H2S) = ν·VM = 0,23· 22,4 = 5,152 л 5) N = ν· NA = 0,23· 6,02· 1023 = 1,385· 1023 молекул. 3. Br2 дано: ν(Br2) = 0,115 моль решение: Br2 - бром, при н.у. жидкость 1)по таблице Менделеева: М(Br2 ) = 2·1М(Br) = 2·80 = 160 г/ моль 2) m(Br2 ) = ν·M = 0,115·160 = 18,4 г 3) VM и V(х) определить невозможно, т.к. при н.у. агрегатное состояние данного вещества жидкое 4) N = ν· NA = 0,115· 6,02· 1023 = 0,6923·1023 = 6,923·1022 молекул. 4. ClO2 дано: V(ClO2) = 5,04 л решение: ClO2 - оксид хлора (IV), при н.у. газ желто-бурого цвета 1)по таблице Менделеева: М( ClO2 ) = М(Cl) + 2·М(O) = 35,5 + 2·16 = 67,5 г/ моль 2)VM = 22,4 л/моль 3) 4) m(ClO2 ) = ν·M = 0,225·67,5 = 15,1875 ≈ 15,19 г 5) N = ν· NA = 0,225· 6,02· 1023 = 1,355· 1023 молекул. Вещество Молярная Масса (агрегат. масса m, г состояние при н.у.) Молярный Объе Количество Число объем, м V, л вещества , струкν или n турных моль единиц N _ Соль, 342 68,4 т.к. для твердых 0,2 веществ при данных твердое дано условиях невозможно вещество 12,04· 10 22 определить при н.у. при н.у. для Сероводо- 34 род при 7,82 любого газа дано VM = 22,4 л/моль 5,152 0,23 1,385· 1023 н.у. - газ _ Бром, при 160 18,4 н.у. - т.к. для жидких веществ 0,115 при данных условиях дано 6,923·1022 невозможно определить жидкость при н.у. для любого газа оксид хлора (IV), при н.у. газ желтобурого цвета 67,5 15,19 VM = 22,4 л/моль 5,04 дано 0,225 1,355· 1023 2. Номенклатура неорганических соединений 2а. Составить формулы, указать класс соединений а) сульфат гидроксоникеля (II) или гидроксосульфат никеля (II): (NiOH)2SO4 основная соль (или гидроксосоль) [Ni+2(OH)-1]2+1(SO4)-2 б) гидрокарбонат железа (II): Fe(HCO3)2 , кислая соль (или гидросоль) Fe+2(HCO3)2-1 в) ацетат свинца (более правильно) ацетат свинца (II): Pb(CH3COO)2, средняя (нормальная соль) Pb+2(CH3COO)2-1 г) сернистая кислота:H2SO3 , кислородсодержащая кислота т.к. суффикс «ист», то степень оисления серы = (Nгр.-2) = 6-2 =4, то оксид: S+4O2-2 или SO2 и, следовательно, кислота: SO2 + H2O = H2SO3 д) гидроксид кальция:Ca(OH)2, основание (степень окисления кальция не указывается, т.к. она постоянная, всегда = +2) Ca+2(OH)2-1 е) оксид хрома (VI): CrO3, оксид кислотный Cr+6O3-2 2б. Назвать соединения, указать класс соединений а) Ca(H2PO4)2 кислая соль дигидрофосфат кальция б) H2WO4 - вольфрамовая кислота, кислородсодержащая кислота. H2 +1W+6O4 -2 ,т.к. степень окисления элемента, образующего кислоту = Nгр, то в названии кислоты может быть суффикс -н-, -ов-, -евв) H3AsO3 мышьяковистая кислота (или ортомышьяковистая), кислородсодержащая кислота. H3+1As+3O3 -2 ,т.к. степень окисления элемента, образующего кислоту = (Nгр.-2) = 5-2, то в названии кислоты может быть суффикс –ист-, -нист-, -овистг) FeOH(NO2)2 нитрит гидроксожелеза (III), основная соль [Fe x(OH)-1]+2(NO2)2-1 х-1=2; х=3 д) SO2 оксид серы (IV), кислотный. (S+4O2-2) е) K2Cr2O7 дихромат калия, средняя соль. 3. Свойства неорганических соединений 3а. Определить тип оксида и написать формулу соответствующего гидроксида 1. Если оксид образован металлом, то в зависимости степени окисления тип оксида может быть: основным, амфотерным или кислотным Основные оксиды образуют металлы со степенями окисления +1, +2: кроме BeO, ZnO, SnO, PbO. Таким оксидам соответствуют гидроксиды – основания, в которых число групп OH равно степени окисления металла. Пример. 1) CrO ( Cr+2O-2) – оксид хрома (II), основный гидроксид основание – Cr(OH)2 , гидроксид хрома(II) 2) Na2O (Na2+1O) – оксид натрия, основный гидроксид основание – NaOH, гидроксид натрия Амфотерные оксиды образуют металлы со степенями окисления +3, +4, а также BeO, ZnO, SnO, PbO. Таким оксидам соответствуют амфотерные гидроксиды, т.е. и основания и кислородсодержащие кислоты. Пример. 1) ZnO – оксид цинка, амфотерный гидроксид амфотерный - Zn(OH)2 и основание гидроксид цинка H2ZnO2 кислота цинковая кислота 2) Cr2O3 - оксид хрома (III), амфотерный гидроксид амфотерный – Cr(OH)3 и H3CrO3 основание или HСrO2 кислоты гидроксид ортохромистая метахромистая хрома (III) кислота кислота для амфотерных гидроксидов чаще характерны метакислоты Кислотные оксиды образуют металлы со степенями окисления +5, +6, +7, +8. Таким оксидам соответствуют кислотные гидроксиды, т.е. кислородсодержащие кислоты, формулу которой можно получить, прибавив к оксиду воду. Пример. CrO3 (Cr+6O3-2 ) – оксид хрома (VI), кислотный гидроксид кислота – H2CrO4 (CrO3 + H2O = H2CrO4 ), хромовая кислота 2. Если оксид образован неметаллом, то он может быть или несолеобразующим (это N2O, NO, CO,SO,SiO) или кислотным. Несолеобразующим оксидам не соответствуют ни основания, ни кислоты. Кислотным оксидам – кислоты (кислотные гидроксиды). Пример. 1) Cl2O (Cl2XO-2 , 2x -2=0, x= 1), оксид хлора (I), кислотный гидроксид кислота – HClO, хлорноватистая кислота ( Cl2O + H2O= H2Cl2O2 , все индексы делим на 2 и получаем HСlO). 2) P2O5 (P2XO5-2 , 2x -10 = 0, x = 5), оксид фосфора (V), кислотный гидроксид кислота – H3PO4, фосфорная или ортофосфорная кислота ( P2O5 + H2O = H2P2O6, все индексы делим на 2 и получаем HPO3, метафосфорная кислота, но чаще для некоторых кислотных гидроксидов, в которых степень окисления кислотообразующего элемента +3 или +5, характерны ортокислоты: HPO3 + H2O = H3PO4) Пример задания 3а. Даны оксиды: MnO, Mn2O3, Mn2O7, P2O3, Cl2O5, SiO2, SnO, PbO2. Указать тип оксида и написать формулу соответствующего гидроксида. Решение. а)MnO (MnXO-2, x-2 = 0, x = 2), оксид марганца (II): оксид образован металлом, степень окисления которого +2, оксида в исключениях нет, следовательно, оксид основный, а гидроксид основание: Mn(OH)2 гидроксид марганца (II) б)Mn2O3 (Mn2XO3-2, 2x – 6 = 0, x= 3), оксид марганца (III): оксид образован металлом, степень окисления которого +3, следовательно, оксид амфотерный и гидроксид амфотерный, но с преобладанием основных свойств : Mn(OH)3 , основание — гидроксид марганца(III) и кислоты (практически не встречаются): H3MnO3 или HMnO2 в) Mn2O7 (Mn2XO7-2, 2x – 14 = 0, x= 7), оксид марганца (VII): оксид образован металлом, степень окисления которого +7, следовательно, оксид кислотный, а гидроксид кислота: HMnO4, марганцовая или марганцевая кислота, ( Mn2O7 + H2O = H2Mn2O8, все индексы делим на 2, получаем HMnO4). г) P2O3 (P2XO3-2, 2x – 6 = 0, x = 3), оксид фосфора (III): оксид образован неметаллом, в несолеобразующих нет,следовательно, оксид кислотный, а гидроксид кислота: H3PO3, ортофосфористая или фосфористая кислота, ( P2O3 + H2O = H2P2O4 , все индексы делим на 2 и получаем HPO2, метафосфористая кислота, но может быть и HPO2 + H2O = H3PO3) д) Cl2O5 (Cl2XO5-2, 2x -10 = 0, x = 5), оксид хлора (V), оксид образован неметаллом, в несолеобразующих нет, следовательно, оксид кислотный, а гидроксид кислота:HClO3, хлорноватая кислота, (Cl2O5 + H2O = H2Cl2O6 , все индексы делим на 2 и получаем HСlO3) е) SiO2 (SiXO2-2, x – 4 = 0, x = 4), оксид кремния(IV), оксид образован неметаллом, в несолеобразующих нет, следовательно, оксид кислотный, а гидроксид кислота: H2SiO3, кремниевая кислота (SiO2 + H2O = H2SiO3) ж) SnO (SnXO-2, x -2 = 0, x = 2), оксид олова(II), оксид образован металлом , степень окисления которого +2, есть в исключениях, следовательно, оксид амфотерный и гидроксид амфотерный : основание - Sn(OH)2 , гидроксид олова(II) кислота — H2SnO2, оловянистая кислота з) PbO2 (PXO2-2, x - 4 = 0, x = 4), оксид свинца(IV), оксид образован металлом , степень окисления которого +4, следовательно, оксид амфотерный и гидроксид амфотерный : основание - Pb(OH)4 , гидроксид свинца(IV) кислоты: H4PbO4 , ортосвинцовая , но чаще H2PbO3, метасвинцовая Заполним таблицу. Типы Формулы оксидов оксидов Кислотные Формулы соответствующих гидроксидов Mn2O7, P2O3, Cl2O5, SiO2 HMnO4, HPO 2 или H3PO3, HClO3, H2SiO3 Основные MnO Mn(OH)2 Амфотерные Mn2O3, SnO, PbO2 Mn(OH)3 или H3MnO3 Sn(OH)2 или H2SnO2 Pb(OH)4 или H4PbO4 или H2PbO3 3б. Указать, какие кислоты образуют кислые соли и составить формулы солей. Кислые соли образуют многоосновные кислоты (это те, в состав которых входят 2 или больше атомов Н) при частичном замещении атомов Н в кислоте на катион металла. Пример задания 3б. Даны кислоты: HClO, H2Se, HNO3, H2CO3, H3AsO4 Какие из указанных кислот образуют кислые соли? Составьте формулы этих солей. Решение. а) HClO не может образовать кислую соль б) H2Se частично можем заместить 1 атом H: соли — Al(HSe)3 , Ba(HSe)2 , K(HSe) в) HNO3 не может образовать кислую соль г) H2CO3 частично можем заместить 1 атом H: соли - Al(HCO3)3 , Ca(HCO3)2 , NaHCO3 д) H3AsO4 частично можем заместить 1 атом H:соли -Al(H2AsO4)3 , Ca(H2AsO4)2 , Na(H2AsO4) или частично можем заместить 2 атом H:соли- Al2(HAsO4)3 , Ca(HAsO4), Na2(HAsO4) 3в. Указать основания, образующие основные соли и составить формулы солей. Основные соли образуют многокислотные основания (это те, которые содержат две или больше групп ОН) при частичном замещении групп OH на кислотные остатки. Пример задания 3в. Даны основания:Ni(OH)2, RbOH, AgOH, Ba(OH)2, Cr(OH)3 Какие из указанных оснований образуют основные соли? Составьте формулы этих солей. Решение. а) Ni(OH)2 – частично можем заместить 1 группу OH: соли - [Ni(OH)]Cl, [Ni(OH)] 2SO4, [Ni(OH)] 3PO4 б)RbOH не может образовать основную соль в)AgOH не может образовать основную соль г) Ba(OH)2 – частично можем заместить 1 группу OH:соли - [Ba(OH)]Cl, [Ba(OH)] 2SO4, [Ba(OH)] 3PO4 д) Cr(OH)3 – частично можем заместить 1 группу OH:соли - [Cr(OH)2]Cl, [Cr(OH)2] 2SO4, [Cr(OH)2] 3PO4 частично можем заместить 2 группы OH:соли - [Cr(OH)]Cl2, Cr(OH)]SO4, [Cr (OH)] 3(PO4)2 4.Осуществить превращения: Zn ---- ZnO ---- ZnSO4 ----- Zn(NO3)2 ---- O2 Обменные реакции практически осуществимы, если в результате реакции образуются : а) малорастворимые вещества ( осадок); б) малодиссоциирующие вещества (слабые электролиты); в) газообразные или летучие вещества. Решение. 1) 2Zn + O2 = 2ZnO 2) ZnO + H2SO4 = ZnSO4 + H2O (слабый электролит - H2O) 3) ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4 ↓ (осадок - BaSO4 ) 4) 2Zn(NO3)2 → 2ZnO + 4NO2 ↑ + O2↑ (реакция разложения, протекает при нагревании) 5. Написать структурные формулы органических соединений, указать класс соединения и его функциональную группу: а) 3-метилбутадиен-1,2; б) метиловый эфир трихлоруксусной кислоты; в) 2,6-динитроанилин. Решение. а) 3-метилбутадиен-1,2: алкадиен, отличительный признак — две двойных связи СH2 = C = С – CH3 | CH3 б) метиловый эфир трихлоруксусной кислоты: сложный эфир галогензамещенной кислоты, функциональные группы: сложноэфирная R-COO- R1 и галоген-хлор Cl O Cl––C––C Cl O — CH3 в) 2,6-динитроанилин: нитроароматический амин, функциональные группы: аминогруппа нитрогуппа бензольное кольцо C6H3(NO2)2NH2 (извините, но Вы должны написать структурную формулу)


