Принятая декларантом декларация о соответствии ... органом по сертификации (см. далее перечень органов по сертификации),
реклама
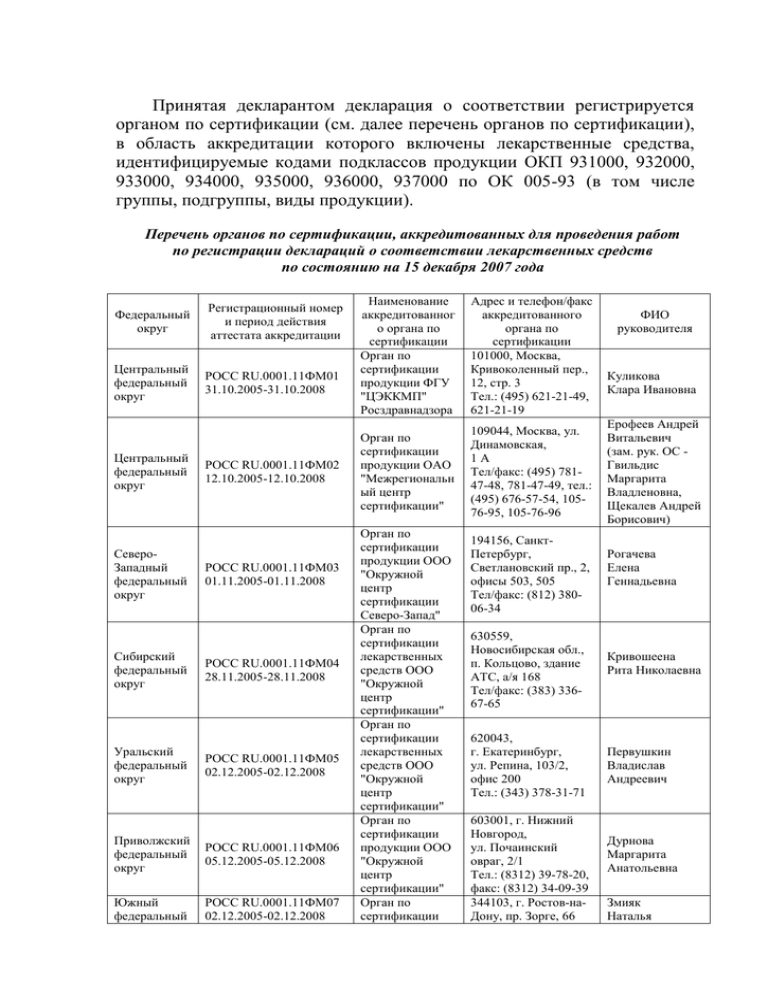
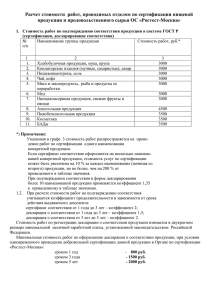
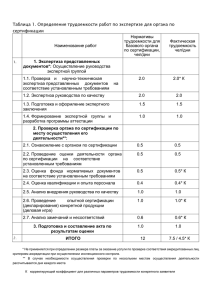
Принятая декларантом декларация о соответствии регистрируется органом по сертификации (см. далее перечень органов по сертификации), в область аккредитации которого включены лекарственные средства, идентифицируемые кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). Перечень органов по сертификации, аккредитованных для проведения работ по регистрации деклараций о соответствии лекарственных средств по состоянию на 15 декабря 2007 года Федеральный округ Регистрационный номер и период действия аттестата аккредитации Центральный федеральный округ РОСС RU.0001.11ФМ01 31.10.2005-31.10.2008 Центральный федеральный округ СевероЗападный федеральный округ Сибирский федеральный округ Уральский федеральный округ РОСС RU.0001.11ФМ02 12.10.2005-12.10.2008 РОСС RU.0001.11ФМ03 01.11.2005-01.11.2008 РОСС RU.0001.11ФМ04 28.11.2005-28.11.2008 РОСС RU.0001.11ФМ05 02.12.2005-02.12.2008 Приволжский федеральный округ РОСС RU.0001.11ФМ06 05.12.2005-05.12.2008 Южный федеральный РОСС RU.0001.11ФМ07 02.12.2005-02.12.2008 Наименование аккредитованног о органа по сертификации Орган по сертификации продукции ФГУ "ЦЭККМП" Росздравнадзора Адрес и телефон/факс аккредитованного органа по сертификации 101000, Москва, Кривоколенный пер., 12, стр. 3 Тел.: (495) 621-21-49, 621-21-19 Орган по сертификации продукции ОАО "Межрегиональн ый центр сертификации" 109044, Москва, ул. Динамовская, 1А Тел/факс: (495) 78147-48, 781-47-49, тел.: (495) 676-57-54, 10576-95, 105-76-96 Орган по сертификации продукции ООО "Окружной центр сертификации Северо-Запад" Орган по сертификации лекарственных средств ООО "Окружной центр сертификации" Орган по сертификации лекарственных средств ООО "Окружной центр сертификации" Орган по сертификации продукции ООО "Окружной центр сертификации" Орган по сертификации 194156, СанктПетербург, Светлановский пр., 2, офисы 503, 505 Тел/факс: (812) 38006-34 630559, Новосибирская обл., п. Кольцово, здание АТС, а/я 168 Тел/факс: (383) 33667-65 620043, г. Екатеринбург, ул. Репина, 103/2, офис 200 Тел.: (343) 378-31-71 603001, г. Нижний Новгород, ул. Почаинский овраг, 2/1 Тел.: (8312) 39-78-20, факс: (8312) 34-09-39 344103, г. Ростов-наДону, пр. Зорге, 66 ФИО руководителя Куликова Клара Ивановна Ерофеев Андрей Витальевич (зам. рук. ОС Гвильдис Маргарита Владленовна, Щекалев Андрей Борисович) Рогачева Елена Геннадьевна Кривошеена Рита Николаевна Первушкин Владислав Андреевич Дурнова Маргарита Анатольевна Змияк Наталья 2 округ Дальневосточ ный федеральный округ РОСС RU.0001.11ФМ08 14.02.2006-14.02.2009 продукции ООО "Окружной центр сертификации" Орган по сертификации лекарственных средств ООО "Окружной центр сертификации" Тел/факс: (863) 27869-21 680033, г. Хабаровск, ул. Тихоокеанская, 204 офис 707 тел.: (4212) 22-53-63 факс: (4212) 76-01-73 Витальевна Лысенко Татьяна Сергеевна Регистрация декларации о соответствии лекарственного средства осуществляется на основании заявления декларанта на проведение регистрации декларации. Форма заявления на регистрацию декларации о соответствии ___________________________ наименование органа по сертификации ___________________________________ адрес ЗАЯВЛЕНИЕ на проведение регистрации декларации о соответствии лекарственного средства _________________________________________________________________ наименование организации-изготовителя, продавца _______________________________________________________________________________________ или индивидуального предпринимателя Юридический адрес_________________________________________ _________________________________________________________________ Банковские реквизиты______________________________________________ _________________________________________________________________ Телефон ____________________Факс _________________ Телекс_________ просит провести регистрацию декларации о соответствии лекарственного средства ________________________________________________________ наименование _______________________________________________________________________________________ серийный (постоянный) выпуск, или партия (серия) определенного объема Оплата работ по регистрации гарантируется. Заявление на регистрацию данной декларации о соответствии в другие органы по сертификации не подавалось. Приложения: 1. Декларация о соответствии. 2. Копии документов, предусмотренных для данной продукции соответствующими федеральными законами, и выданные уполномоченными на то органами и организациями в 1 экз. _______________________________________________________________ наименование документов 3 3. Другие копии документов, подтверждающих соответствие продукции установленным требованиям и (или) правомочность принятия декларации о соответствии _______________________________________________________________ наименование документов Руководитель организации _________________ _______________ подпись инициалы, фамилия _________________ ______________ Главный бухгалтер подпись М.П. _______________________ инициалы, фамилия Дата Для регистрации декларации о соответствии серии (партии) лекарственного средства в орган по сертификации представляются: копия документа, подтверждающего факт внесения сведений о создании или реорганизации юридического лица в Единый государственный реестр юридических лиц или сведений о приобретении физическим лицом статуса индивидуального предпринимателя в Единый государственный реестр индивидуальных предпринимателей; копия документа о государственной регистрации лекарственного средства; копия лицензии на производство (фармацевтическую деятельность) лекарственных средств, заверенная нотариально; копия контракта (договора) на поставку (для продавца); копия документа, выданного компетентным органом в стране происхождения продукции, о соответствии условий производства лекарственных средств, требованиям GMP, заверенная нотариально и имеющая апостилированный перевод (для зарубежных производителей лекарственных средств); документ, подтверждающий право юридического или физического лица, зарегистрированных в соответствии с законодательством Российской Федерации на ее территории, выполнять функции иностранного изготовителя (договор с этим изготовителем в части обеспечения поставляемой продукции установленным требованиям и в части ответственности за несоответствие поставляемой продукции установленным требованиям, либо доверенность, нотариально заверенная изготовителем в стране происхождения продукции и имеющая апостилированный перевод); копия разрешения на ввоз лекарственного средства и копия лицензии на ввоз лекарственного средства (для зарубежного лекарственного средства); 4 копия документа, подтверждающего происхождение лекарственного средства (товарно-транспортной накладной и (или) инвойса, представляемых для таможенного оформления); копия паспорта (протокола анализа) производителя (для отечественных лекарственных средств) или копия сертификата качества (анализа) фирмы (для зарубежных лекарственных средств) с указанием расшифровки подписи уполномоченного лица, его подписавшего; копии протоколов входного контроля (испытаний) и сертификатов на сырье, полупродукты, фармацевтические субстанции и материалы, используемые в производстве лекарственного средства (для отечественных лекарственных средств) и документов, подтверждающих происхождение фармацевтических субстанций используемых в производстве данного лекарственного средства (товарно-транспортных накладных и (или) инвойсов с отметкой таможенного органа); копия протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), заверенная испытательной лабораторией или сертификат соответствия на систему качества Системы сертификации ГОСТ Р, или системы, признанной в установленном порядке в Системе сертификации ГОСТ Р; другие документы прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Копии документов (кроме копии лицензии на право производства лекарственных средств и копии протокола испытаний) заверяются печатью декларанта. Полученные за пределами территории Российской Федерации документы о подтверждении соответствия, знаки соответствия, протоколы исследований (испытаний) должны иметь апостилированный перевод на русском языке или перевод, заверенный юридическим или физическим лицами, исполняющими функции иностранного производителя. При этом в случае, если декларацию о соответствии принимает продавец, к ней должны быть приложены документы на поставку лекарственного средства. При проверке правильности установления срока действия декларации следует проверить его соответствие сроку годности лекарственного средства, сроку действия регистрационного удостоверения и нормативной документации, на основании которой принимается декларация.