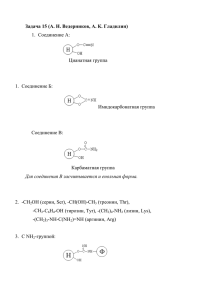
Создание технологии получения лекарственного биопрепарата
реклама

Министерство образования и науки Российской Федерации УДК 615.015.14; 615.015.154; 615.015.3 ГРНТИ 76.31.33 Инв. № 0000008101 УТВЕРЖДЕНО: Исполнитель: Государственное образовательное учреждение высшего профессионального образования "Кабардино-Балкарский государственный университет им. Х.М. Бербекова" От имени Руководителя организации _______________________/Карамурзов Б.С./ М.П. НАУЧНО-ТЕХНИЧЕСКИЙ ОТЧЕТ о выполнении 2 этапа Государственного контракта № П2539 от 20 ноября 2009 г. и Дополнению от 02 апреля 2010 г. № 1/П2539 Исполнитель: Государственное образовательное учреждение высшего профессионального образования "Кабардино-Балкарский государственный университет им. Х.М. Бербекова" Программа (мероприятие): Федеральная целевая программа «Научные и научно-педагогические кадры инновационной России» на 2009-2013 гг., в рамках реализации мероприятия № 1.2.2 Проведение научных исследований научными группами под руководством кандидатов наук. Проект: Создание технологии получения лекарственного биопрепарата с использованием наноматериалов. Руководитель проекта: ______________/Шевченко Анна Александровна (подпись) Нальчик 2010 г. СПИСОК ОСНОВНЫХ ИСПОЛНИТЕЛЕЙ по Государственному контракту П2539 от 20 ноября 2009 с дополнительным соглашением от 02 апреля 2010 г. № 1/П2539 на выполнение поисковых научно-исследовательских работ для государственных нужд Организация-Исполнитель: Государственное образовательное учреждение высшего профессионального образования «Кабардино-Балкарский государственный университет им. Х.М. Бербекова». Руководитель темы: кандидат биологических наук ______________________ 03.09.2010 Шевченко А. А. ______________________ 03.09.2010 Смирнова И.П. Исполнители темы: доктор биологических наук, профессор кандидат химических наук ______________________ 03.09.2010 Шкинев В.М. Аспирант ______________________ 03.09.2010 Анзорова З.З. Аспирант ______________________ 03.09.2010 Сакиева Д.Н. Студент ______________________ 03.09.2010 Борисова А.А. Студент ______________________ 03.09.2010 Андриянова Е.В. ______________________ 03.09.2010 Кольченко Е.А. Нормоконтролер, начальник ОСМО 2 Реферат Отчет 88 с., 1 ч., 34 рис., 7 табл., 68 источн., 0 прил. БИОТЕХНОЛОГИЯ, СИСТЕМАХ НА ЭКСТРАКЦИЯ L-ЛИЗИН--ОКСИДАЗА, ОСНОВЕ ВОДОРАСТВОРИМЫХ В ПОЛИМЕРОВ, ПОЛИЭТИЛЕНГЛИКОЛЬ, МЕМБРАННАЯ ФИЛЬТРАЦИЯ, КАПИЛЛЯРНЫЙ ЭЛЕКТРОФОРЕЗ. В отчете представлены результаты исследований, выполненных по 2 этапу Государственного контракта № П2539 «Создание технологии получения лекарственного биопрепарата с использованием наноматериалов» (шифр «НК428П») от наноматериалы» 20 ноября в 2009 рамках по направлению мероприятия 1.2.2 «Нанотехнологии «Проведение и научных исследований научными группами под руководством кандидатов наук.», мероприятия 1.2 «Проведение научных исследований научными группами под руководством докторов наук и кандидатов наук», направления 1 «Стимулирование закрепления молодежи в сфере науки, образования и высоких технологий» федеральной целевой программы «Научные и научнопедагогические кадры инновационной России» на 2009-2013 годы. Цель работы - Создание противоопухолевого и антивирусного препарата на основе фермента L-лизин-a-оксидазы, разработки вариантов выделения и очистки фермента, позволяющие выбрать соответствующий вариант согласно тем условиям, в котором 3 находится производство. Содержание Введение ....................................................................................................................... 5 Глава 1 Аналитический отчет о проведении теоретических и экспериментальных исследований ............................................................................ 8 Глава 2 Результаты теоретических и экспериментальных исследований........... 20 2.1 Систематизация и предварительная оценка полученных результатов .......... 20 2.2 Оценка полноты решения задач и достижения поставленных целей ............ 31 2.3 Сопоставление и обобщение результатов анализа научно-информационных источников и теоретических (экспериментальных) исследований .................... 36 2.4 Оценка эффективности полученных результатов в сравнении с современным научно-техническим уровнем .......................................................... 45 2.5 Разработка рекомендаций по возможности использования результатов проведенных НИР в реальном секторе экономики ............................................... 66 2.6 Разработка рекомендаций по использованию результатов НИР при создании научно-образовательных курсов.............................................................................. 68 Глава 3 Публикации результатов НИР ................................................................... 70 3.1 Заключение экспертной комиссии по открытому опубликованию ............... 70 3.2 Копии статей, опубликованных в журнале ВАК или зарубежном журнале с обязательной ссылкой на проведение НИР в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы 71 Заключение ................................................................................................................ 79 Список использованных источников ...................................................................... 83 4 Введение Развитие современных методов получения эффективных противоопухолевых препаратов с использованием достижений нанотехнологии одно из важнейших направлений развития биотехнологии. Физико-химические свойства и реакционная способность частиц и наносистем определяются размером и числом атомов в них – это утверждение является выражением одной из фундаментальных проблем современной химии. Важным представляется рассмотрение возможностей использования таких систем в методах разделения и очистки ферментов. При этом весьма важно определиться с размерным понятием наносистемы или нанообъекта. Как показывает анализ литературных данных эти понятия различны для специалистов, работающих в различных областях науки, так в области электроники (при различают нанообъекты размером до 10 нм), для физико-химиков, специалистов по рассмотрении квантовых наноструктур материалам, характерный размер таких структур равен 100 нм, такой же размер является граничным для экологов. Каждый граничный размер нанообъектов, определяется значительным изменением их свойств, и с этим связано внимание специалистов различных областей знаний к данным объектам. В документах США «Национальная нанотехнологическая инициатива» область наноструктур определена в диапазоне 1 – 100 нм. Поиск средств лечения злокачественных новообразований продолжает оставаться актуальной проблемой современной медицины. Поиск лекарственных препаратов осуществляется по двум направлениям: синтез аналогов известных противоопухолевых лекарственных средств и поиск биопрепаратов микробного происхождения. Среди последних особое место занимают лекарственные онкологических заболеваний препараты-ферменты. человека В использование энзимотерапии их принесло определённые успехи, которые побуждают исследователей продолжать поиск ферментов, обладающих антиопухолевой активностью. Преимуществом энзимотерапии является избирательное каталитическое 5 действие ферментов, то есть высокая специфичность их по отношению к индивидуальному субстрату. Среди испытанных препаратов в энзимотерапии активно вмешивающиеся в аминокислотный обмен и вызывающие необратимый распад незаменимых аминокислот занимают ферменты микробного происхождения. Такими ферментами с антиопухолевой активностью являются глутамин (аспарагиназа) (К.Ф. 3.5.1.38) и L-лизин --оксидаза (К.Ф. 1.4.3.14). Глутамин (аспарагиназа) широко используется в клинической онкологии при лечении лейкозов за рубежом [Hollander A., Behnish J. 1998]. Японскими исследователями из водного экстракта гриба Trichoderma viride Pers ex S.F. Gray был выделен новый фермент, который ингибирован рост лейкемических клеток мышей in vivo и in vitro. Фермент был очищен до гомогенного (К.Ф.1.4.3.14). состояния и Фермент идентифицирован катализирует как реакцию L-лизин--оксидаза окислительного дезаминирования L-лизина с образованием -кето--аминокапроновой кислоты. Необратимое ферментативное разрушение глутамина и аспарагина лимитирует не только нормальные, но и в особенности опухолевые клетки амидным азотом, абсолютно необходимым для синтеза ряда биологически активных веществ. L-лизин--оксидаза является также одним из ферментов, разрушающих одну из важных аминокислот-L-лизин, к недостатку которой опухолевые клетки оказываются более чувствительными, чем нормальные клетки [Берёзов Т.Т., 1984г.]. Поиск противоопухолевых ферментов, а также изучение вопроса регуляции биосинтеза и активности оксидаз L-аминокислот в культуре грибов представляет не только практический, но и большой теоретический интерес, поскольку полученные результаты будут способствовать выяснению тонких молекулярных механизмов действия ферментов. Выяснение оптимальных условий биосинтеза и регуляции активности фермента позволило получить активную субстанцию и перейти к разработке усовершенствования метода выделения и очистке её [Смирнова И.П., Алексеев 6 С.Б., Шевченко А.А., 2009 г.]. На этом этапе исследований мы провели поисковую работу по апробации мембран нового поколения, полученных на основе нанотехнологий, для создания новой технологии получения биопрепарата. 7 Глава 1 Аналитический отчет о проведении теоретических и экспериментальных исследований Нанотехнологии в решении проблем онкологии Для неинвазивной диагностической визуализации опухолей качестве наноносителей контрастных агентов наиболее in vivo в перспективны липосомы и мицеллы. В липосомы можно инкорпорировать контрастные агенты как во внутренний водный компартмент, так и в мембрану, и использовать в гамма- и магнитно-резонансной визуализации. Если контрастными агентами служат металлические наночастицы, репортёрный металл можно хелировать в диэтилентриамин пентаацетат и интегрировать в липосомы [Juliano R, Alam R., Dixit V., Kang H. 2008]. Использовались наноносители, нагруженные гадолинием, что позволило выявить опухолевые метастазы в лимфатических узлах. С той же целью применяют покрытые декстраном суперпарамагнитные наночастицы оксида железа у больных раком простаты. Этим методом идентифицированы микрометастазы размером менее 2 мм. С помощью меченных индием-111 длительно циркулирующих липосом диагностируют рак лёгких, рак головы и шеи, ассоциированную со СПИДом саркому Капоши, рак кожи, глиобластомы и метастатические опухоли головного мозга, а также саркому мягких тканей [Stewart S.S., Harrington K.J. 1997]. Молекулы визуализирующих агентов и опухолеспецифические лиганды можно встраивать в одну и ту же наночастицу. Мультивалентные магнитные нанокристаллы, связанные с опухолеспецифическими антителами Негсерtin, успешно используются для диагностики рака с помощью магнитного резонанса. В диагностических системах, предпочтительно использовать квантовые точки. Квантовые точки находят применение и в иммуногистохимическом анализе биопсийного материала [Michalet X., Pinaud F.F., Bentolila L.A. et al. 2005]. Нанокристаллы могут стать основой сверхчувствительных неинвазивных методов визуализации рецепторных 8 молекул и маркёров заболеваний различной этиологии [Kelly K.A., Allport J.R., Tsourkas A. et al 2005]. Молекулярная визуализация in позволяет vivo не только локализировать патологический процесс, но и зарегистрировать уровень экспрессии и активность специфических молекул, а также оценить биологические процессы (апоптоз, ангиогенез и т.д.), которые влияют на развитие патологии, и ответ на терапевтическое воздействие [Choi J.-W., Oh В.-К., Kim Y.-K., Min J. 2005]. Разработан метод с использованием наноштрихкодов [Um S.H., Lee J.В., Kwon S.Y. et al. 2006]. На никелевые наностержни наносят поперечную штриховку из золотых и серебряных полосок и привязывают к ним детекторные молекулы (антитела или олигонуклеотиды). Изменение оптических свойств штрихкода свидетельствует о наличии детектируемой молекулы в исследуемом образце [Brunker S.E., Cederquist K.B., Keating C.D. 2007]. В клинике наноштрихкоды применяются при диагностике рака простаты и болезни Альцгеймера, а также различных инфекций. Кантилеверы, подобные тем, что используются в атомно-силовой микроскопии, помогают анализировать образцы ДНК. Поверхность кантилевера покрывается моноклональными антителами или аптамерами. С помощью кантилеверов выявляют, например, опухолеассоциированные антигены, инфекционные агенты [Azzazy H.M.E., Mansour M.M.H., Kazmierczak S.C. 2006; Brakmann S.2004.; McKendry R. Zhang J., Arntz Y. et al. 2002]. Оценка безопасности нанопрепаратов Весьма важной проблемой, которая может ограничивать широкое применение инновационных нанобиотехнологий, - токсичность наночастиц. Перевод различных материалов в нанометровый диапазон часто сопряжён с радикальными изменениями их свойств [Lewinski N., Colvin V., Drezek R. 2008; Oberdorster G., Oberdorster E., Oberdorster J. 2005]. В связи с этим наночастицы способны оказывать нежелательные воздействия на биологические системы. Кроме того, вследствие генетического 9 полиморфизма, часть популяции может оказаться аномально чувствительной к действию определённых классов или типов наночастиц. Вследствие этого возникает необходимость классической общей разработки токсикологии, новых, методов выходящих за доклинической рамки оценки безопасности нанопрепаратов [Oberdorster G., Oberdorster E., Oberdorster J. 2005; Дурнее А.Д. 2005г.]. Сложность проблемы требует привлечения к её решению токсикологов, физиков, химиков, материаловедов, медиков, молекулярных биологов, специалистов в области биоинформатики. На международной нанотоксикологической конференции «Nanitox 2008» объявлено о создании междисциплинарного сообщества научных экспертов, цель которого состоит в подготовке протоколов для воспроизводимого токсикологического тестирования наноматериалов in vitro и in vivo. Нанотехнологии и мембраны Важнейшим признаком наносистем являются получаемые при их реализации качественные изменения и свойства продуктов, материалов и устройств, которые сегодня невозможно объяснить. Одним из направлений, возможно, это создание системы биосенсоров для внутреннего мониторинга организма, что позволит выявлять заболевания на самых ранних стадиях и создать биокорректоры для его лечения. В создании лекарственных препаратов использование наносистем позволит получать субстанции лекарственных средств более эффективными методами со свойствами, которые приведут к созданию лекарств нового поколения. Использование мембранных технологий, реализуемые в микрореакторах в перспективе могут разделять не только соединения разновалентности, но и, например, ионы натрия и калия, как это делают биологические мембраны в живых организмах. Конечный полезный эффект от использования нанотехнологий сейчас воспринимается как нечто необычное, которое не укладывается в традиционное 10 восприятие окружающих явлений. Наноразмерные мембраны могут быть реализованы в самых приоритетных сферах деятельности человека. Среди наноматериалов пористые мембраны занимают уникальное положение. Это объясняется следующими причинами. Сами мембраны являются типичными наноструктурами, которые представляют сложную систему трёхмерно связанных или отдельных нанопор в полимерном или неорганическом каркасе. Слои мембран, в которых и функционируют нанопоры, могут представлять нанослой толщиной до 100 нм. На основе мембран методами матричного или шаблонного («темплейтного», от анг. Template - шаблон) синтеза могут быть получены так называемые вторичные структуры. Поры мембран, модифицированные так называемыми «умными» (smart) полимерами - основное звено наноустройств сенсорного типа и др. Функциональные свойства мембран характеризуются по размерам (R) задерживаемых частиц. Различают: Обратноосмотические – R < 3 нм, задерживающие гидратированные ионы или растворённые молекулы; наофильтрационные – 3 нм < R < 10 нм; ультафильтрационные – 0,01 мкм < R < 0,1 мкм; микрофильтрационные – 0,1 < R < 1 мкм. Так как структура пор оказывается функционально значимой для процесса разделейвителения, то технологические процессы с использованием таких мембран относят к нанотехнологиям. Поры в трековых мембранах возникают за счёт облучения полимерных плёнок потоком высокоэнергетиченских частиц с последующей физикохимической обработкой (ультра-фиолет, воздействия травителей). Поры калибруются. Разброс их размеров может достигать очень малых 11 величин: ± 2÷5% в нанометровом диапазоне: 10-100 нм. Следует заметить, что зона трека образованная под воздействием травления различных факторов обширна и составляет не менее 50 нм в диаметре. На современном этапе развития мембранной науки исследования учёных сосредоточены на поиске и разработке и создания таких мембранных систем, которые бы обеспечивали эффективность разделения, которая бы стала максимально приближённой к биологическим мембранам. Фактически речь идёт о создании мембран на молекулярном уровне. Такие мембраны должны иметь весьма высокие значения избирательности переноса по целевым компонентам при общем высоком уровне проницаемости. Фундаментальные и поисковые работы в направлении создания мембран нового поколения могут привести к новым принципиальным результатам, к открытию новых мембранных процессов. Практическая реализация мембранных технологий в различных сферах, и в частности, в сфере создания новых технологий выделения и очистки биологически активных соединений, как например, нового перспективного лекарственного биопрепарата, а также использования нанотехнологий в получения новых лекарственных форм приведёт к решению глобальных проблем, стоящих перед человечеством. И, прежде всего, здоровья человека и экологии. На данном этапе проведения исследований по проблеме «Создания технологии получения лекарственного биопрепарата с использованием наноматериалов» необходимо углублённое знание свойств субстанции, которая будет использована в наносистемах в выделении и очистке биопрепарата и в создании лекарственных форм. Современные мембраны, мембранные материалы, мембранные аппараты. Современные мембраны, мембранные материалы В данном разделе разбираются современные мембраны, их тонкая структура. Мембраны подразделяют на пористые и диффузионные [Дытнерский Ю.И. 1986 г.]. Пористые мембраны нашли широкое применение в процессах микро- и ультрафильтрации. Они имеют как анизотропную, так и 12 изотропную структуру. Мембраны с анизотропной структурой имеют поверхностный тонкопористый слой толщиной 0,25-0,5 мкм (называемый активным или селективным), представляющий собой селективный барьер. Компоненты смеси разделяются именно этим слоем, располагаемым со стороны обрабатываемого раствора. Крупнопористый слой толщиной около 100-200 мкм, находящийся под активным слоем, является подложкой, повышающей механическую прочность мембраны. Мембраны с анизотропной структурой характеризуются высокой удельной производительностью, отсутствием закупорки пор в процессе их эксплуатации. Срок службы этих мембран определяется главным образом химической устойчивостью материала мембраны в перерабатываемых средах. Для мембран с изотропной структурой характерно быстрое снижение проницаемости, вследствие закупорки пор коллоидными или взвешенными частицами, часто содержащимися в разделяемых растворах. Диффузионные мембраны обычно применяют для разделения газов и разделения жидких смесей методом испарения через мембрану [Дытнерский Ю.И., 1985. Брык М.Т., Цапюк Е.А.1998 гг.]. Для изготовления мембран применяют различные материалы: полимерные пленки, стекло, металлическую фольгу и др. Факторами, определяющими размер пор и общую пористость мембраны, являются состав раствора для полива, тип растворителя и порообразователя. Чтобы уменьшить диаметр пор в полученной мембране, её обрабатывают водой при температуре, близкой к температуре стеклования данного полимера. При этом происходит некоторая усадка пористой структуры, что часто приводит к повышению селективности мембран. Мембраны с изотропной структурой получают облучением тонких полимерных пленок заряженными частицами или электромагнитным излучением с последующим травлением химическими реагентами, поэтому их называют ядерными или трековыми мембранами. История создания трековых мембран (ТМ) начинается с 1962 г., когда в 13 США был выдан патент на способ изготовления «микросит» с калиброванным размером отверстий [Price P.B., Walker R.M. 1962]. Предложенный способ включал две основные стадии – бомбардировку диэлектрической полимерной пленки высокоэнергетическими тяжелыми заряженными частицами и последующую химическую обработку облученной пленки. Метод был реализован на практике в 70-е годы, когда фирма Nuclepore Co. освоила выпуск трековых мембран из поликарбонатной пленки, радиационная обработка которой проводилась осколками деления ядер урана. Создание технологии трековых мембран в нашей стране связано с именем академика Г.Н. Флерова. По его идее в самом начале 70-х годов прошлого века были синтезированы первые образцы ускорительных трековых мембран. За прошедшее время как в науке о трековых мембранах, так и в технологии их производства произошёл значительный прогресс, на что указывает значительное количество опубликованных материалов исследований и развитие в России пяти центров производства трековых мембран. В настоящее время созданы технологии синтеза, и производятся трековые мембраны в широком диапазоне диаметров пор на основе спектра различных полимеров для процессов нано-, ультра-, микро- и простой фильтрации. В общих чертах процесс формирования трековой мембраны включает в себя следующие основные стадии: 1 – облучение полимерной пленки тяжёлыми ионами или осколками деления; 2 – химическое травление следов (треков) этих частиц в плёнке до образования сквозных пор заданного диаметра; 3 – нейтрализация и отмывка химического травителя; 4 – сушка мембран. Нанофильтрация занимает промежуточное положение между ультрафильтрацией и обратным осмосом, поэтому данный процесс может быть использован для разделения истинных растворов неорганических или органических соединений. Ультрафильтрация, в основном, используется для разделения растворов высокомолекулярных соединений и коллоидных растворов. Подобного рода задачи находят широкое применение в пищевой, 14 фармацевтической и текстильной промышленности, в биотехнологии [Брык М.Т., Кабанов В.Я. 1998 г.]. Основным направлением использования трековых ультрафильтров в биотехнологии являются процессы очистки и разделения биологически активных веществ. В данном разделе систем будет представлен также критический анализ эффективности использования различных методов для модификации их поверхности. Основным требованием, предъявляемым к методам модификации трековых мембран, является возможность обработки всего порового пространства. При этом модификация не должна существенно изменять саму поровую структуру, иначе – это может привести к потере селективных и производительных свойств мембраны. Известные методы модификации полимерных пористых систем могут быть условно разделены на две группы: это методы, заключающиеся в нанесении на поверхность мембраны низко- или высокомолекулярного соединения, формирующего слой с заданными свойствами; принцип действия методов второй группы состоит в изменении физико-химических свойств тонкого приповерхностного слоя полимера мембраны. К первой группе методов относятся плазмо-, радиационнохимическая прививка и полимеризация, модификация путём физической или химической адсорбции или химической прививки различных высокомолекулярных соединений [Кочкодан В.М. 1998, Брык М.Т., Кабанов В.Я. 1998 гг., Mitrofanova N.V., Khohlova T.D., Sergeev A.V., Netchaev A.N., Kirsh Yu.E., Mchedlishvili B.V. 2000]. Наибольшее распространение среди методов данной группы нашли радиационно-химические методы. Которые благодаря своей высокотехнологичности находят широкое применение для получения полимерных материалов, в том числе и пористых, с улучшенной биосовместимостью, с иммобилизованными биологически активными веществами и др. Имеются литературные данные о модификации трековых мембран путём радиационно-прививочной полимеризации мономеров и полимеров различной 15 природы [Lazea A., Kravets L.I., Albu B., Ghica C., Dinescu G. 2005]. Исследования структурных, селективных и производительных свойств мембран, представленные в данных работах, показывают, что модификация сопровождается существенным изменением всех этих свойств. Уже при незначительных степенях прививки любого из полимеров, не превышающих 4%, происходит двукратное уменьшение диаметров пор мембран и, соответственно, снижается их производительность. Прививка полиакриловой кислоты приводит к увеличению задержания мембранами ионогенных красителей вследствие уменьшения эффективного диаметра пор и возрастания роли электрохимических взаимодействий между поверхностью мембраны и компонентами фильтруемой системы. Однако во всех случаях было обнаружено, что прививка осуществляется на внешней стороне мембраны и в меньшей степени в порах. Влияние модификации на изменение степени гидрофильности поверхности трековых мембран ощущается только при значительных степенях прививки (7-10%), при которых происходят значительное уменьшение диаметров пор и снижение производительности (в 100 раз) даже на крупнопористых мембранах с D исх = 0,1 мкм. Это связано с тем, что прививка в данных условиях преимущественно осуществляется вокруг устьев пор вследствие энергетической и химической неоднородности поверхности. Ряд исследований [Сергеев А.В., Митрофанова Н.В., Хохлова Т.Д., Нечаев А.Н., Януль Н.А., Попков Ю.М. 2001 г.] посвящены модификации трековых мембран из ПЭТФ различными водорастворимыми полимерами (поливинлпиролидоном, поливинилкапралактамом, полиэтиленимином и их сополимерами) за счёт химической адсорбции или координационного взаимодействия. Представленные в этих работах данные свидетельствуют о значительном модификации снижении при адсорбционной сохранении их активности производительных мембран свойств. после Однако отсутствие химического взаимодействия между поверхностью мембраны и молекулами модификатора подразумевает возможность его смывания в 16 процессе эксплуатации. Поэтому мембраны, модифицированные данным образом, могут быть использованы в процессах с коротким циклом работы при небольших потоках. Мембранные аппараты Аппараты для мембранных процессов подразделяют на четыре типа, отличающиеся способом укладки мембран: аппараты с плоскими мембранными элементами, аппараты с трубчатыми мембранными элементами, аппараты с мембранными элементами рулонного типа и аппараты с мембранами в виде полых волокон. В настоящем разделе рассматриваются наиболее популярные установки для плоских мембран различной формы. Например, установка для вакуумной фильтрации. Аппарат для вакуумной фильтрации представляет собой простейшее устройство. Оно состоит из трех основных частей: фильтродержателя, воронки и специального зажима. В фильтродержателе имеется плотно посаженный пористый диск (из стекла, тефлона или нержавеющей стали, в зависимости от материала корпуса), проницаемый для жидкости и служащий хорошей подложкой для мембраны. Воронку располагают таким образом, что она оказывается точно напротив мембраны и фильтродержателя. С помощью зажима мембрану закрепляют достаточно плотно, чтобы исключить подтёки жидкости по её периферии. Очень важно, чтобы этих подтёков не было, иначе часть фильтруемой жидкости либо минует мембрану и попадет в фильтрат, либо просачивается снаружи воронки. Более эффективной является фильтрация в режиме тангенциального потока жидкости над мембраной. По этому методу поток жидкости в закрытой системе пропускается под давлением вдоль поверхности мембраны, неотфильтрованный же продукт возвращается в цикл, фильтрат удаляется. Поскольку жидкость проходит касательно к поверхности мембранного фильтра, большинство частиц при этом поддерживается во взвешенном состоянии и рециркуляция возвращает сконцентрированные частицы обратно к подающему 17 резервуару. Концентрирование частиц таким путём происходит намного быстрее, чем при обычной фильтрации в тупиковом режиме. Рисунок 1 - Фотография и схема многоступенчатой фильтрационной ячейки. Способ образования тангенциального потока реализован в многоступенчатой фильтрационной ячейке (рисунок 1). Жидкость, попадая в систему, движется по специальным дренажным каналам (направляющим) над поверхностью мембраны. В процессе фильтрации [Мчедлишвили Б.В., Флеров Г.Н. 1987 г.] происходит отделение частиц и молекул, существенно отличающихся по размерам от молекул растворителя. На каждой ступени разделенные частички смываются общим потоком в специальные камеры, из которых проба извлекается для последующего определения. Данная установка обладает рядом преимуществ [Мчедлишвили Б.В., Флеров Г.Н. 1987], что обусловило их широкое распространение в процессах концентрирования: разделение осуществляется непрерывно, в потоке, с использованием набора мембран с различным диаметром пор; использование препятствует принципа образованию тангенциального намывных 18 мембран и потока раствора концентрационной поляризации; система проста в управлении и контроле над разделением. Используется один шестиканальный перистальтический насос, один кран на входе и выходе; возможна работа с плоскими мембранами; мембраны легко извлекаются из установки; потери определяемых веществ из-за адсорбции на конструкциях ячейки незначительны, что обусловлено компактной конструкцией установки; возможность разделения без изменения вещественного и газового баланса в растворе. Вышеописанная установка была использована нами в выделении очистке фермента L-лизин-а-оксидазы Trichoderma sp. 19 Глава 2 Результаты теоретических и экспериментальных исследований 2.1 Систематизация и предварительная оценка полученных результатов Метод культивирования триходермы. В работе использовали штамм-продуцент L-лизин--оксидазы Trichoderma sp. В качестве посевного материала использовали вегетативный мицелий гриба, выращенный в течение 8-10 суток при температуре 28оС на сусло-агаре. Ферментационная среда включала: пшеничные отруби - 5 г; сульфат аммония - 1,3 г; водопроводную воду - 100 мл; рН среды - 5,8-6,0. Культивирование Trichoderma sp. проводили в колбах (V=250 мл) при t=28oC в течение 5-6 суток на качалке типа 357 (Польша) при амплитуде 120 об/мин. Для поддержания культуры использовали сусло-агаризованную среду. Определение активности L-лизин--оксидазы. Активность оксидазы L-лизина в водном экстракте культур рассчитывали по приросту Н2О2, количество которой определяли спектрофотометрическим микрометодом. Сущность метода заключается во взаимодействии всей образующейся в реакции Н2О2 с ортодианизидингидрохлоридом и измерении интенсивности образовавшегося окрашенного раствора. Инкубационная смесь для определения субстратной специфичности оксидаз L-аминокислот коллекции грибов содержала в конечном объёме (1мл.): 20 мкг пероксидазы; 250 мкг о-дианизидингидрохлорида; 0,1-0,5 мг белка; 20 10 мм L-лизин; 0,7 мл фосфатного буфера, рН 5,8. После 10 мин инкубирования пробы в термостате при 37 оС охлаждали до 4оС и добавляли 1 мл концентрированной HCl, до t=0-4оС. Оптическую плотность окрашенных растворов опытной и контрольной (без субстрата) проб измеряли спектрофотометрически при 540 нм против второй контрольной пробы (без пероксидазы). Для построения свежеприготовленного калибровочной раствора Н2О2 кривой, определяли молярность перманганатометрией (рисунок 1). Субстратами служили L-лизин и DL-лизин (фирма «Reanal», Венгрия); L-фенилаланин (фирма «Servant», Germany); L-метионин (фирма «Servant», Germany); L-лейцин (фирма «Servant», Germany). О-дианизидингидрохлорид получали перекристаллизацией из основания о-дианизидина. Это позволило использовать краситель не в спиртовом, а в водном растворе. В качестве катализатора пероксидазной реакции использовали пероксидазу фирмы «Reanal», Венгрия, а в качестве донора протонов брали ортодианизидингидрохлорид фирмы «Merk», Germany. 250 200 D, нм 150 100 50 0 0 50 100 150 200 Н2O2, нм/мл Рисунок 2 - Калибровочный график для определения Н2О2 ортодианизидингидрохлоридом спектрофотометрическим микрометодом. 21 Активность L-лизин--оксидазы определяют спектрофотометрически по количеству образующейся в процессе ферментивной реакции Н2О2. За единицу активности фермента принимают количество фермента, катализирующего образование 1 мкмоль Н2О2 за минуту при 37оС. Удельную активность фермента выражали числом единиц активности на 1 мг белка или на 1 мл водного экстракта культуры. Определение белка по Лоури Белок определяли по модифицированному методу Лоури (122). В качестве стандарта использовали 0,05% раствор кристаллического бычьего альбумина (фирма «Reanal», Венгрия). Концентрацию белка в пробе определяли колориметрически на ФЭК-56М при светофильтре №8 в кюветах с d=1 см. Для построения калибровочной кривой использовали раствор сывороточного альбумина (5 г. на 25 мл. воды) (рисунок 3). 100 90 80 70 D 60 50 40 30 20 10 0 0 0,05 0,1 0,15 0,2 0,25 0,3 Белок, /мл Рисунок 3 - Калибровочный график для определения белка по Лоури. Ферментация продуцента L-лизин-α-оксидазы Ферментация производилась на оборудовании Опытной технологической установки ИБФМ РАН им. Г.К. Скрябина (г. Пущино). Использовали ферментёр типа БИОР-01 производства ОКБ ТБМ, 22 г. Кириши, объёмом 100 л с коэффициентом заполнения 0,6. Ферментёр оснащён магнитной мешалкой, фильтрами тонкой очистки воздуха, датчиками температуры и рН. Питательную среду готовили непосредственно в аппарате. Для этого в аппарат заливали 60 литров водопроводной воды, вносили 1% пшеничных отрубей, стимулятор-0,1%, 1,3% сульфата аммония, значение рН 5.8-6,0 устанавливали 10%-ным раствором НСl. Пшеничные отруби предварительно замачивали в 10 литрах воды в течение 4 часов, стерилизовали в автоклаве 1 час при 125ºС, затем вносили в ферментёр, где ещё раз стерилизовали вместе с другими компонентами. Подготовленный ферментёр засевали посевным материалом из колб, в которых выращивалась культура продуцента фермента. Посевная доза не менее 5%. Культивирование проводили при температуре 26ºС, расход воздуха на протяжении всей ферментации 30 л в минуту, скорость вращения мешалки 200 оборотов в минуту. Величину рН в процессе роста корректировали до 6,5. Продолжительность выращивания 94-98 часов, конечные значения рН от 5,3 до 7.5. Получение исходного концентрата По окончании ферментации культуральную жидкость направляли на участок предварительной очистки, где мицелий гриба отделяли фильтрованием под вакуумом на нутч-фильтре. Вес полученной биомассы составил 3,5 кг. Полученный нативный раствор подвергали дополнительному сепарированию на сепараторе типа ОСБ при 9000 об/мин. в течение часа при температуре 24ºС. Затем нативный раствор в объёме 55 л, полученный после отделения биомассы, концентрировали до 1,5 л диализом. Используемые полимеры для экстракции фермента Мембраны фирмы Миллипор. Мембраны фирмы Владипор (Владимир, Россия). Трековые фильтры, производство Объединенного Института ядерных реакций, Дубна, Россия. Поли-N-винил-N-метилацетамид (ПВМА) относится к поли-N-виниламидам алифатических карбоновых кислот. Температура кипения мономера 23 ПВМА от 58 до 64ºС в зависимости от плотности (1,4791 и 1,4827 г/см3 соответственно). Поли-N-винил-N-метилацетамид получают при радикальной полимеризации мономера в этиловом спирте и бензоле в присутствии инициатора (60 ºС). Скорость полимеризации в бензоле выше, чем в этиловом спирте. Это объясняется тем, что в апротонном растворителе происходит межмолекулярная агрегация молекул мономера вследствие образования водородных связей, способствующая удлинению цепи. Поли-N-винил-N-метилацетамид хорошо растворим в воде, хлороформе, этиловом спирте, практически нерастворим в ароматических углеводородах и кетонах. Взаимодействует со многими низко- и высокомолекулярными соединениями в водных растворах. Эта способность расширяет области практического применения полимера в различных отраслях. Макромолекулы ПВМА характеризуются высокой комплексообразующей способностью по отношению к аминокислотам. Поли-N-винилпирролидон (ПВП) – аморфный полимер белого цвета, легко растворим в воде и большинстве органических растворителях, нерастворим в алифатических и циклических углеводородах. Несмотря на лактамную структура, ПВП характеризуется высокой химической стабильностью, длительное нагревание его водных и спиртовых растворов при 70 – 100 ºС не приводит к разрушению лактамного цикла. Полиэтиленгликоли (ПЭГ) – водорастворимые термопластичные полимеры с хорошими механическими свойствами. Полиэтиленгликоли (молекулярная масса до 40 тыс.) – жидкие или воскообразные вещества с низкой упругостью пара; вязкость от 4 до 1000 мм 2/сек, плотность 1,12 – 1,20 г/см 3 , удельная теплоемкость 2,05–2,18 кДж/(кг·K) (0,49–0,52 кал/(г·град.С)), поверхностное натяжение 43–45 мн/м (дин/см), теплота плавления 170 кДж/кг (40 кал/г). Кислородсодержащие водорастворимые использованы для экстракции фермента: 24 полимеры, которые были O N CH CH2 H2 C * Молекулярная масса 10000 Поли-N-винилпирролидон n H C * n N H2C O C H2C CH2 H2C C H2 CH2 n Молекулярная масса 20350 Поли-N-винилкапролактам O C H3C N C H CH3 H2 C (-СН2СН2О-)nOH Молекулярная масса 17275 n Поли-N-винилметилацетамид Полиэтиленгликоль Молекулярная масса 5000 Поли-N-винилкапролактам (ПВКЛ) растворяется в толуоле, бензоле, ксилоле, которые для других полимеров этого ряда являются осадителями. Полимер способен растворяться в кетонах и ненасыщенных углеводородах. Синтез ПВКЛ осуществляли радикальной полимеризацией N-винилкапролактама в изопропиловом спирте при 70ºС. Концентрация мономера 1,5 моль/дм3. Полимер после проведения гомополимеризации осаждали гексаном и сушили в вакууме при 55–60 0С, при этом получили ПВКЛ с молекулярной массой 2,3 .104. 25 Мембранный метод выделения и очистки аминооксидазы По окончании ферментации культуральную жидкость направляли на участок предварительной очистки, где мицелий гриба отделяли фильтрованием под вакуумом на нутч-фильтре. Вес полученной биомассы составил 3,5 кг. Полученный нативный раствор подвергали дополнительному сепарированию на сепараторе типа ОСБ при 9000 об/мин. в течение часа при температуре (2-4) ºС. Затем нативный раствор в объёме 55 л, полученный после отделения биомассы, концентрировали до 1,5 л диализом. Для фракционирования компонентов нативного раствора использовали, как стандартные фильтрационные ячейки объёмом 200 и 10 мл производства фирмы Биоспектр (С.-Петербург), так и проточную систему непрерывного мембранного фракционирования с 4 мембранами с последовательно уменьшаемыми размерами пор от 0,2 мкм до 30 kD в мембранах (рисунок 4), разработанную авторами [Shkinev V.M., 2001]. Ранее данная система использовалась для решения задач аналитической химии. [Nifanteva T.I., Shkinev V.M., Spivakov B.Ya., Burba P. 1999, Spivakov B., Shkinev V. 2005, Wennrich R., Mattusch J., Morgenstern P., Stärk H.-J., Spivakov B. Ya., Shkinev V.M. 2005, Шкинев В.М., Джераян Т.Г., Гомолицкий В.Н., Спиваков Б.Я. 1998, Шкинев В.М., Джераян Т.Г., Карандашев В.К., Аракчаа К.Д., Спиваков Б.Я. 2000, Шкинев В.М., Трофимов Д.А., Данилова Т.В., Роговая И.В., Моржухина С.В., Карандашев В.К., Спиваков Б.Я. 2008 гг.] и для проведения биотехнологических процессов не применялась. Система до фракционирования промывалась 0.01 M HCl и затем дистиллированной водой до нейтральной реакции. Оставшаяся вода удалялась из установки с помощью перистальтического насоса. Фракционируемый образец вводился из резервуара на первой фильтрационной ступени (нижняя мембрана, М), где часть раствора движется вдоль поверхности мембраны (тангенциальный поток, R - ретентат) и 26 возвращается в резервуар, а часть проходит через мембрану (фильтрационный поток, F - фильтрат). Рисунок 4 - Общий вид и схема потоков в проточной системе непрерывного мембранного фракционирования с мембранами с последовательно уменьшаемыми размерами пор. Фильтрат проникает в камеру следующего, находящегося выше диска, и также частично возвращается (рециркулируется); процесс повторяется на каждой ступени, снабженной мембранами с меньшими размерами пор. Специальные регулирующие краны используются для управления скоростями потоков, с целью уменьшения образования намывной мембраны на поверхности фильтра и устранения явления концентрационной поляризации. В работе использовались мембраны с размерами пор от 0,2 мкм до 30 килоДальтон, изготовленные фирмами Миллипор, Владипор. Капиллярный электрофорез Метод капиллярного электрофореза (КЭ) основан на разделении компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. Микрообъём анализируемого раствора 27 вводят в капилляр, предварительно заполненный подходящим буфером – электролитом. После подачи к концам капилляра высокого напряжения (до 30 кВ), компоненты смеси начинают двигаться по капилляру с разной скоростью, зависящей в первую очередь от заряда и массы (точнее – величины ионного радиуса) и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой, при этом качественной характеристикой вещества является параметр удерживания (время миграции), а количественной – высота или площадь пика, пропорциональная концентрации вещества. Рисунок 5 - Капиллярный электофорез на установке Капель 104 производство фирмы Люмекс ( С.-Петербург). Известно, что фермент катализирует окислительное дезаминирование лизина с образованием a-кето-έ-аминокапроновой кислоты и перекиси водорода. 1) H2N(CH2)4CNH2COOH + O2 +H2O = H2N(CH2)4COCOOH + NH3 + H2O2. 2) H2N(CH2)4CNH2COOH + O2 +H2O = H2N(CH2)4COCOONH4 + H2O2. Исследование избирательности действия показало, что L-лизин-a-оксидаза действует практически только на L-лизин и лишь в небольшой степени (менее 6% от активности по отношению к L-лизину) на две другие аминокислоты, которые могут рассматриваться как структурные аналоги L-лизина: L-орнитин и L-аргинин [Лукашева Е.В., Березов Т.Т. 1988 г.]. 28 L-лизин-a-оксидаза представляет собой гликопептид с молекулярной массой 120 кДа, состоящий из двух идентичных субъединиц. Впервые изучены электрофореграммы смесей L -лизин-α-оксидазы и L -лизина при рН 7,4 и исследована кинетика ферментативной реакции. Таблица 1 - Зависимость площади пика a-кето-έ-аминокапроновой кислоты от времени реакции. Время реакции (мин) 0 26 54 85 105 146 Площадь пика (S) Номер спектра 0 14,5 30,0 42,5 51 66 1 2 3 4 5 6 Из таблицы 1 и рисунков 6-11 прослеживается кинетика ферментативной реакции. Из приведенных электрофореграмм видно, что пик 6,0 можно отнести к продукту реакции. Таким образом, капиллярный электрофорез может использоваться не только для определения чистоты препарата, но и для определения активности L-лизин-α-оксидазы. 80 70 60 Площадь пика (S) 50 40 30 20 10 0 0 20 40 60 80 100 120 140 160 t мин Рисунок 6 - Зависимость площади пика a-кето-έ-аминокапроновой кислоты от времени реакции окисления L-лизина в присутствии L-лизин-a-оксидазы. 29 14 mAU Capel 1 2 3 4 5 6 7 3 4 5 6 7 8 9 мин Рисунок 7 - (концентрат разбавлен в 2 раза) + лизин 0.002 М – ТС241636 Ввод пробы 30/10 (мБар/сек) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 64 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме –1.8(7.2) 2.52 (98), 4,2(6.4), 5.8(14.3). 14 mAU Capel 1 2 8 9 мин Рисунок 8 - (концентрат разбавлен в 2 раза) + лизин 0.002 М – ТС241706 Ввод пробы 30/10 (мБар/сек) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 64 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме –1.8(4.0) 2.5 (104), 2.8(3,9),4,9(3.9), 5.8(42.5). 14 mAU Capel 1 2 3 4 5 6 7 8 9 мин Рисунок 9 -(концентрат разбавлен в 2 раза) + лизин 0.002 М – ТС241755 Ввод пробы 30/10 (мБар/сек) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 64 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме –1.8(3.67) 2.5 (83.8),4,15(3.5), 6.0(50.82). 30 14 mAU Capel 1 2 3 4 5 6 7 4 5 6 7 8 мин 9 Рисунок 10 - (концентрат разбавлен в 2 раза) + лизин 0.002 М – ТС241836 Ввод пробы 30/10 (мБар/сек) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 64 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме –1.83(3.23) 2.5 (67.8),4,3(5.9), 6.0(61.2). 14 mAU Capel 1 2 3 8 9 мин Рисунок 11 - (концентрат разбавлен в 2 раза) + лизин 0.002 М – ТС241816 Ввод пробы 30/10 (мБар/сек) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 64 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 1.87(5.78) 2.5 (82.7), 4,5(1.8), 6.0(67.8). 2.2 Оценка полноты решения задач и достижения поставленных целей Морфологическая характеристика штамма-продуцента. Способы получения L-лизин-α-оксидазы штаммом – продуцентом Штамм Trichoderma sp. на среде сусло-агаром имеет колонии быстрорастущие, мицелий бесцветный, септированный, распростертый. На 4 - 5 сутки роста появляются дерновинки с конадиеносцами, подушковидные, сначала белые, со временем желто или темно-зеленого цвета. Фиалиды бутыльчатые /9-12μ/, расположены мутовиами по 3 и более. На каждой фиалиде 31 образуются конидии, склеенные в головку. Конидии округлые, гладкие, мелкие /3-5μ/, в проходящем свете бледно-зеленые, а в массе – тёмные. На агаризованной среде Чапека колонии быстрорастущие, но слабо спороносящие. Биохимическая характеристика. Штамм хорошо растёт на среде Чапека. Оптимальные условия роста при рН 4-6, может расти и при рН от 1,5 до 9. Trichoderma sp. в одинаковой степени усваивает как аммонийные, так и азотнокислые соли. Из источников углерода хорошо усваивает глюкозу, мальтозу. Может использовать сложные источники углерода: пшеничные отруби. Последний источник углерода необходим для образования фермента. Агар не разжижает, желатину не разжижает, молоко не пептонизирует, крахмал не разлагает. Аэробный гриб. Температурный оптимум 28-29°С. Trichoderma sp. хорошо растёт на сусло-агаре. На картофельнодексгрозном агаре наблюдается снижение интенсивности роста, образование воздушного мицелия и спороношения. Лучшим источником азота из органических соединений является пептон. Хорошо растёт на средах с аспарагином и с глутаминовой кислотой. Лучшими источниками углерода являются ксилоза, глюкоза, сахароза, лактоза, галактоза, маннит, крахмал. На средах с этими сахарами наблюдается интенсивный рост. Слабо усваиваются спирты метиловый, этиловый, дульцит. Получение фермента поверхностным способом Получение экстракта Trichoderma sp. с L-лизин-α-оксидазной активностью может осуществляться поверхностным способом. Способ А. Штамм Trichoderma sp. выращивали на среде Чапека в течение 7 дней. Полученную культуру петлёй вносили в колбу на 250 мл. со средой следующего состава: 7 мл. 11,4% NaNO3, 10 г. пшеничных отрубей, 10 мл Н2О. Культуру выращивали в течение 14 дней при температуре 28°С. Затем в колбу добавляли 100 мл. Н2О и в течение 2 часов культура встряхивалась. Полученный водный экстракт используют для определения активности L-лизин-α-оксидазы. Определяют активность 32 фермента спектрофото- метрически по количеству образующейся в процессе ферментативной реакции Н2О2. За единицу активности фермента принимали количество фермента, катализирующего образование 1 нмоль Н2О2 за минуту в стандартных условиях, на 1 мл культуральной жидкости. Активность L-лизин-α-оксидазы составляла 2,3 усл. ед. Способ Б. Штамм Trichoderma sp. выращивали на пшеничных отрубях в колбах на 250 мл с добавлением 7 мл. 11,4% NaNO3, 10 г. пшеничных отрубей, 10 мл. Н2О, в течение 7 дней при температуре 28°С. Затем полученную культуру петлёй вносили в среду вышеуказанного состава, выращивали 14 дней и определяли активность L-лизин-α-оксидазы методом, описанным выше. Активность L-лизин-α-оксидазы у штамма на среде с пшеничными отрубями 8,0 условн. ед. Полученный экстракт гриба с L-лизин-α-оксидазной активностью может быть использован для выделения и очистки фермента. Получение фермента глубинным способом выращивания Посевной материал (косяки с культурой) выращивают на среде сусло-агар в течение 14 суток в термостате при 28°С. С целью получения инокулята для глубинного культивирования, используют среду с пшеничными отрубями, имеющую следующий состав: пшеничные отруби – 20, NaNO3 – 11,4%, раствор – 1,4 мл, Н2О – 10 мл. Инокулят выращивают в термостате при 28°С в течение 12-14 суток и используют для посева на ферментационную среду. Ферментацию триходермы проводят в колбах на 250 мл. на термостатированном встряхивателе типа 357 (ПНР) при 28°С в течение 5 суток, амплитуда № 6, 120 оборотов в минуту. Ферментационная среда имеет следующий состав: пшеничные отруби – 5 г., NaNO3 0,9 г; Н2О – до 100 мл, начальный рН среды – 5,5-6,0. Количество 33 инокулята, выросшего на твёрдой среде с пшеничными отрубями составляло 0,5-1 г. от всего количества. Полученную таким образом культуральную жидкость используют для выделения фермента. Активность L-лизин-α-оксидазы определяют спектрофотометрическим способом по количеству образующейся в процессе ферментативной реакции Н2О2. За единицу активности фермента принимают количество фермента, катализирующего образование 1 нмоль Н2О2 за минуту в стандартных условиях на 1 мг белка. Активность фермента составила 0,8 Е/мг белка. Хранение штамма-продуцента и культуральной жидкости Штамм Tr. harzianum хорошо хранится и поддерживается на среде суслоагар. Для этих целей может использоваться и среда Чапека. Однако более длительное хранение штамма целесообразно осуществлять на пшеничных отрубях. Выращивание осуществляется вышеуказанным способом. Культура может хорошо сохраняться и не теряет своей активности до 6-8 месяцев. Культуральная жидкость триходермы хранится в полиэтиленовых флаконах при -4°С в течение 2-3 лет без потери ферментативной активности. Перед использованием культуральной жидкости для выделения и очистки желательно её центрифугировать. Определение активности L-лизин-α-оксидазы Активность L-лизин-α-оксидазы в культуральной жидкости рассчитывали по приросту Н2О2, количество которой спектрофотометрически ортодианизидиновым микрометодом. Сущность метода заключается во взаимодействии образующейся в реакции Н2О2 с о-дианизидингидрохлоридом. Инкубационная смесь содержала 20 мкг пероксидазы, 250 мкг. – дианизидингидрохлорида и 0,1-0,5 мг. белка в 1 мл. конечного объёма. Субстратами служил L-лизин. Применяли 0,05 М фосфатный буфер. В опыте использовали следующие инкубационной смеси: 34 соотношения компонентов Таблица 2 – Компоненты инкубационной смеси. опыт L-лизин пероксидаза о-дианизидингидрохлорид фосфатный буфер культуральная жидкость контроль 0,1 0,05 0,05 0,7 0,1 0,05 0,05 0,7 0,1 бланк 0,1 0,05 0,7 0,1 После 20 мин. инкубирования в термостате при 37°С пробы охлаждали до 4°С и добавляли 1 мл концентрированной HCl, предварительно охлаждённой до 0-4°С. Оптическую плотность окрашенных растворов опытной и контрольной (без субстрата) проб измеряли на спектрофотометре СФ-16 при 540 нм против второй контрольной пробы (без пероксидазы). Для построения калибровочной кривой молярность свежеприго- товленного раствора Н2О2 определяли пермаганатометрией. [Knolthoff A.M., Sandell B.B. – Textbook of Quantative Inorganic Analasis. – New York.] Субстратом служил L-лизин (фирма «Серва», Германия). В качестве катализатора пероксидазной реакции использовали пероксидазу (фирмы «Реанал», Венгрия) в качестве донора протонов о-дианизидингидрохлорид (фирмы «Мерк», Германия). За единицу активности принимали количество фермента, катализирующего образование 1мкмоль Н2О2 за 1 мин. при 37°С. Удельную активность фермента выражали числом единиц активности на 1 мг белка или на 1 мл водного экстракта культуры. Белок определяли по методу Лоури и соавторов [Lowry O.H., Rosebrogh W.Y., Farr A.L., Randell R.I – I. boil. chem. 1951]. В качестве стандарта использовали 0,05% раствор кристаллического бычьего альбумина (фирма «Реанал», Венгрия). Таким образом, поверхностный способ получения L -лизин-α-оксидазы предложенный R. Soda, который заключается в культивировании продуцента в течение 14 дней на среде с пшеничными отрубями имеет основной недостаток – 35 длительность выращивания. Разработка глубинного способа выращивания предполагает сокращение сроков выращивания гриба до 4-5 дней. Однако существует также другой поверхностный способ получения L-лизин-α-оксидазы, предусматривающий культивирование гриба Trichoderma harzianum с многостадийным получением экстракта фермента. Способ заключается в следующем: гриб выращивают в течение 8 дней при 28°С на питательной среде с пшеничными отрубями (10%), сернокислым аммонием (0,6-1,3% масс) и вода – 10 мл. К выросшей таким образом культуре доливают стерильно 100 мл воды, экстрагируют в течение 2 часов и полученный экстракт сливают в колбу. Оставшуюся культуру в течение 3-4 суток доращивают в термостате при 28°С, после чего используют вторичный смыв культуры. Такой способ позволяет максимально использовать исходное сырье для роста культуры, повысить выход целевого продукта. Технология получения продукта для выделения и очистки оксидаз α-аминокислот с помощью глубинного культивирования имеет ещё одно преимущество: гриб имеет ограниченное распространение (колба, ферментер). При поверхностном выращивании грибом поражается не только оборудование, люди, но и также окружающая среда. Разработка способов культивирования продуцента позволило осуществить наработку исходной субстанции в промышленных условиях для выделения и очистки биопрепарата. 2.3 Сопоставление и обобщение результатов анализа научноинформационных источников и теоретических (экспериментальных) исследований Нанотехнологии в создании лекарственных препаратов Нанотехнологии активно проникают во все сферы человеческой деятельности, в том числе и в медицину и, в частности, в фармакологию, в методы выделения и очистку биологически активных соединений, в создание эффективных лекарственных форм. 36 На современном этапе развития появляются всё новые возможности для активного вмешательства в эти процессы. И это очень важно, так как новые технологии более экономичны и перспективны в создании лекарственных средств. Создание лекарственных препаратов нового поколения, а также конструирование высокоэффективных биосенсорных систем – это проблемы стоящих перед современной медициной и которые вполне решаемы с использованием нанотехнологии. Нанотехнологии – это набор технологий и методик атомного, молекулярного или макромолекулярного масштаба, которые позволяют осуществлять конструирование и использование структур, устройств или систем в манометровом диапазоне [Salata O.V. 2004]. Сущность нанотехнологии в создании лекарственных препаратов состоит в использовании достижений нанотехнологии применительно к лечению, конструирование лекарственных и диагностических препаратов, собственно контролю над функционированием биологических систем [Morrow К J., Bawa H, WtiC. et al 2007]. Развивать нанотехнологии стремятся все страны. Самые масштабные государственные научно-исследовательские программы в области нанотехнологии реализуются в США и Японии. С 1997 г. объём инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил около 15 млрд. долл. О значении наномедицины свидетельствует рост публикаций на эту тему в международных научных журналах. За последние 10 лет количество научных публикаций по наномедицине в мире увеличилось в 4 раза. Растёт число заявок на изобретения, что указывает на расширяющуюся коммерциализацию данной сферы. Бесспорный лидер по числу и научных публикаций, и патентных заявок - США, публикаций и 53% заявок; следом идут Германия – 8% публикаций и 10% заявок и Япония – 9 и 6% соответственно (VDI Technologiezentrum 2006). Использование тех или иных наночастиц в биомедицинских целях определяется разнообразными параметрическими характеристиками, такими 37 как природа (органические и неорганические вещества), особенности структурной организации (размер, форма), физические и физико-химические свойства (магнитные, электрические, оптические, механические) [McNeil S.E.2005]. Спектр наночастиц, как уже нашедших практическое применение в клинике, так и потенциально перспективных в медицинских целях, довольно широк. Из-за исключительного разнообразия наноматериалов классификация их достаточно произвольна. Среди них представлены: металлические наночастицы – суперпарамагнитные кристаллы железа, наночастицы благородных металлов (золота и серебра), полупроводниковые наночастицы (квантовые точки) и др.; органические наноматериалы – нанолипосомы, нанокомпозиты из природных материалов, рекомбинантные «неприродные» химерные белки и пептиды и др.; углеродные наночастицы – фуллерены, одно- и многослойные нанотрубки; синтетические нанополимеры – дендримеры и другие синтетические полимеры [Salata O.V. 2004; Morrow К.J., Bawa H, WtiC. et al 2007; McNeil S.E. 2005]. Чтобы выбрать оптимальные условия для действия наноматериалов необходимо знать их свойства и проанализировать возможности их использования. Строение наноматериалов и область их использования В настоящее время практическую значимость в области создания лекарственных препаратов нашли самые разнообразные наноматериалы. Некоторые из них мы рассмотрим ниже. Суперпарамагнитные кристаллы оксида железа (размер 4-5 нм). Это гексагональные кристаллы, окружённые молекулами декстрана или полиэтиленгликоля. Используются для адресной доставки лекарственных препаратов. К 38 поверхности кристаллов оксида железа могут быть привязаны функциональные группы - антитела, белки, олигонуклеотиды [Neumaier C.T., Baio C., Ferrini S., 2008]. Квантовые точки - полупроводниковые флуоресцентные металлические нанокристаллы (размер 5-10 нм). Образованы из селенида кадмия, покрыты оболочкой из сульфида цинка, обладают уникальными оптическими и электронными свойствами, имеют высокие квантовый выход и коэффициент экстинкции. Квантовые точки отличает уникальная фотостабильность [Олейников B.A., Суханова Л.В., Набиев И.P., 2008 г.]. Углеродные наночастицы (фуллерены) (размер 1-10 нм). Третья аллотропная форма элементарного углерода (после графита и алмаза), представленная фуллеренами и нанотрубками. Эти наночастицы в основном используют при конструировании наноустройств. При соответствующей модификации возможно применение их в качестве депо для лекарственных препаратов [Bakry R., Valiant М., Najam-ul-Hag M. et al 2007]. Неорганические наночастицы, как правило, формируют ядро, которое покрывают защитным слоем инертного материала. Функционализация – это модификация поверхности наночастиц для придания им заданных свойств. Они могут быть образованы ковалентным присоединением структурных элементов, осуществляющих распознавание молекулярных мишеней in vivo или in vitro – антител, антигенов, олигонуклеотидов и т.д. [Kraij M., Pavelic K. 2003]. Дендримеры (размер < 50 нм). Полимерные сильно ветвящиеся макромолекулы с близкой к монодисперсной трёхмерной структурой. Они имеют губчатую структуру, что позволяет использовать их в качестве матрицы. Путём химической модификации к поверхностным группам дендримеров могут быть привязаны терапевтические и диагностические агенты [Singh I., Rehni A.K., Karla R. 2008; Saltan D., Nasongkla N., Blanco E., Gao J. 2007]. 39 Нанолипосомы (размер < 100 нм). Замкнутые однослойные липидные везикулы. Заключённые в липосомы лекарственные препараты могут быть доставлены в органы-мишени при модификации поверхности везикул соответствующими лигандами [Immordino M.L., Dosio F., Cartel L. 2006]. Аквасомы (размер 60 - 300 нм). Сферические частицы. Используются для доставки и освобождения лекарств и антигенов. Ядро частиц представлено нанокристаллическим фосфатом кальция или керамическим углеродом и покрыто олигомерной пленкой из полигидроксила. Лекарства и антигены адсорбируют на поверхности этих частиц [Goya I A.K., Khatri K., Mishra N. et al. 2008]. Полиплексы/липоплексы (размер 100 – 200 нм). Наноструктуры, которые формируются спонтанно между нуклеиновыми кислотами и поликатионами, либо катионными липосомами, и используются для трансфекции генов [Kabanov A. V. 2006]. Свойства наночастиц и возможность применения их в доставке лекарственных препаратов Наночастицы обладают мощным потенциалом в качестве эффективной системы доставки лекарственных препаратов. С этой целью используются наночастицы биодеградируемых материалов (природные или синтетические полимеры, липиды), а также металлов. Основные требования, предъявляемые к наноносителям, – отсутствие токсичности, иммуногенности, способность к переносу достаточного количества лекарственного препарата и освобождение его в оптимальной дозе [Liu W. 2006]. Наночастицы захватываются клетками более эффективно, чем структуры большего размера, и, следовательно, могут использоваться для транспорта и освобождения лекарств. Лекарственные препараты могут быть интегрированы в матрикс частиц или привязаны к их поверхности. Рациональное развитие наносистем основано на знании характера их 40 взаимодействия с биологическим окружением, популяцией клеток-мишеней, поверхностными рецепторами этих клеток (с учётом изменения их экспрессии в ходе заболевания). Конструированию таких наносистем должно предшествовать тщательное изучение фармакокинетики, биораспределения и эффективности накопления нанокомпозитов в органе-мишени. Стабильность, вне- и внутриклеточное распределение наночастиц в биологическом микроокружении зависят от их химической природы, пространственной организации и размера [Alexis F., Pridgen E., Molmr L.K., Farokhzad O.C. 2008; Peer D., Karp J.M., Hong S. et al 2007]. При внутривенном введении наночастицы быстро выводятся из крови, аккумулируясь преимущественно в купферовских клетках печени и макрофагах краевой зоны красной пульпы селезёнки. Наночастицы применимы для адресной доставки лекарств. Терапевтические и диагностические агенты могут быть инкапсулированы, ковалентно привязаны к наноносителям или адсорбированы на них. Корпускулярные наноносители нацелены на определённый тип клеток и поступают в заданный компартмент организма после системного введения. Функционализация поверхности частиц позволяет повысить время их циркуляции в сосудистом русле и избежать неспецифического распределения. Для покрытия наночастиц особенно часто используется полизтиленгликоль (ПЭГ), который создаёт эффект «стерической стабилизации». Его молекулы формируют защитный гидрофобный слой на поверхности наночастицы, препятствующий опсонизации частиц белками плазмы и их захвату клетками системы мононуклеарных фагоцитов. В качестве стерических стабилизаторов, наряду с ПЭГ, применяются и альтернативные полимеры, в частности на основе полиоксазолина, поливинилэтанола и полиглицерола [Cuenca A.G., Jiang H., Hochward S.N. et at. 2006]. После достижения заданного компартмента стабилизирующее покрытие наночастиц в большинстве случаев начинает играть отрицательную роль, препятствуя эффективному освобождению 41 лекарственных препаратов. Молекулы стабилизаторов привязывают к поверхности наночастиц с помощью линкерных структур. Линкеры подбирают таким образом, чтобы при попадании в заданное микроокружение нарушалась связь между стабилизирующим покрытием и наночастицей. Слущивание (шеддинг) покрытия может быть индуцировано в зависимости от природы линкера низкими значениями рН, реакцией восстановления, протеолизом и др. [Romberg В., Hennink W.E., Storm G. 2007]. Адресная доставка наночастиц осуществляется двумя способами – пассивным и управляемым транспортом [Sinha R., Kim G.J., Nie S., Shin D.M. 2006]. Первый способствует спонтанному накоплению длительно циркулирующих наночастиц в очагах воспаления и ткани солидных опухолей благодаря проявлению феномена «повышенной проницаемости и задержки». Эпителиальная выстилка патологически нарушенного капиллярного русла структурно изменена и между эндотелиоцитами возникают фенестры, через которые свободно проникают наночастицы. Отсутствие (в случае солидных опухолей) или недостаточность лимфатической системы, ответственной за дренаж макромолекул из здоровых тканей, приводят к накоплению наночастиц в патологически изменённой ткани [Maeda H., Wu J., Sawa T. et al. 2000]. Прицельная доставка наночастиц осуществляется путём конъюгации соответствующего лиганда с их поверхностью. Такими лигандами могут быть моноклональные антитела или их фрагменты, другие белки, пептиды, малые молекулы и аптамеры. Низкая аффинность лиганда компенсируется усилением его авидности за счёт повышения плотности посадки на носитель. В качестве целевых лигандов широко используются малые синтетические пептиды, которые более стабильны, чем молекулы антител, и, скорее всего, неиммуногенны. Лигандами могут служить также углеводы – лактоза, галактоза и манноза. Их целесообразно применять для маркировки опухолевых клеток, на поверхности которых избыточно экспрессированы лектины. В последнее время всё более широкое применение получают аптамеры. 42 Эти целевые продукты селекции олигонуклеотидной природы обладают высоким сродством и специфичностью к заданной мишени. Их можно рассматривать как искусственные аналоги антител, отличающиеся от последних существенно меньшим размером [Jayasena S.D. 1999]. Конструкция некоторых носителей такова, что они способны активироваться в условиях меняющегося рН окружающей среды, а также под воздействием химических стимулов, быстро изменяющегося магнитного поля или внешнего источника тепловой энергии [Torchilin V.P 2007]. За счёт модификации носителей возможен контроль целостности частиц, скорости освобождения и локального выхода лекарств на органном, клеточном и субклеточном уровнях. При адресной доставке лекарственного препарата в цитоплазму наночастицам приходится преодолевать эндолизосомальный компартмент. Для этого используются наночастицы из поли- (DL-лактид-ко-гликолида) или наночастицы с привязанными к ним короткими пептидами, такие как домены трансдукции белка. Захват частиц осуществляется по рецептор-независимому механизму макропиноцитоза через липидные рафты. Средством их доставки в цитоплазму служит шаперонин GгоЕL Е. соli – белок теплового шока с заключёнными в него наночастицами (квантовые точки). Он проникает в цитоплазму, минуя эндолизосомальный компартмент, и освобождает наночастицу при связывании АТФ в присутствии ионов магния и калия [MUD., Kinbara K., Ishida Y. et al. 2003]. Нанотехнологии открывают возможности для решения вопроса о доставке лекарственных препаратов к опухолям головного мозга. Наночастицы, конъюгированные с лектином Ulex europeus, эффективно преодолевают гематоэнцефалический барьер [Gao X., Chen J., Tao W. et al. 2007]. Созданы также мультифункциональные наноносители, которые несут одновременно лекарственный препарат, лиганд, обеспечивающий адресную доставку (например, антитела или аптамеры), и контрастирующий агент. Такие наночастицы могут использоваться для специфического освобождения противоопухолевых препаратов, выявления циркулирующих опухолевых 43 клеток и мониторинга эффективности лечения в реальном времени. Поведение наночастиц в биологическом микроокружении, стабильность, вне- и внутриклеточное распределение варьируют в зависимости от их химической природы, пространственной структуры и размера. Для доставки лекарственных препаратов в опухоль перспективны липосомы и мицеллы, поскольку применение таких наноносителей снижает токсичность лекарств, позволяет задавать временные параметры их освобождения, а также модифицировать фармакокинетику и биораспределение препаратов [Moghimi S.M., Hunter A.C., Murray J.C 2005; Medina C, SantosMartinez M.J., Radomski A. et al. 2007]. Наночастицы помогают преодолеть эффект множественной лекарственной резистентности путём доставки цитостатиков в опухолевые клетки без запуска р-гликопротеиновой помпы. Нагруженные доксирубицином частицы из поли (алкилцианоакрилата) способны проникать в клетки, не будучи распознаны р-гликопротеином. В условиях клиники преодолена лекарственная резистентность при СПИД-ассоциированной саркоме Калоши благодаря использованию доксорубицина, заключённого в липосомы [Northfelt D.W., Dezube B.J., Thommes J.A. et al. 2007]. Сконструированы нанокомпозиты, позволяющие одновременно решать задачи целевой доставки препарата, визуализации мишени и её деструкции. Наноконтейнерами для доставки лекарств всё чаще служат биодеградируемые природные (альбумин, хитозан, гепарин) и синтетические (поли-L-лактид, поли-(L-глутамат), полиэтиленгликоль) полимеры, которые разрабатываются для различных типов лекарственных средств - противоопухолевых, антибиотиков, белковых препаратов, включая вакцины, генно-инженерные лекарственные и иммуномодулирующие препараты [Wang X., Yang L., Chen Z, Shin D.M. 2008]. Доказана возможность включения тех или иных веществ в различные классы наночастиц (таблица 3). 44 Таблица 3 - Области применения различных видов наносистем. Наносистемы Липосомы Полимеры Дендримеры Фуллерены Квантовые точки Противоопу холевые лекарственные средства + + + + + Антибиотики Пептид ы + + + Генно-инженерные препараты Иммуномодуляторы + + + + Вакцины + + + + + + + Стратегия преодоления лекарственной резистентности основывается на использовании новых систем освобождения лекарств, обеспечивающих их избирательное накопление в опухолевой ткани, собственно в опухолевых клетках или даже в их цитоплазматических компартментах. 2.4 Оценка эффективности полученных результатов в сравнении с современным научно-техническим уровнем Использование биопрепарата. различными наноматериалов Изучение осадителями. в выделении возможности Выбор и агрегирования экстракционных очистке фермента систем для последующей доочистки полученного продукта Целью настоящего этапа исследований является создание новых вариантов метода выделения и очистки L-лизин-α-оксидазы, проведения сравнительного исследования их, которое позволит расширить возможности получения исходной субстанции противоопухолевого фермента в промышленных масштабах. Проблема получения относительно больших количества препарата требовала постоянного усовершенствования методик его получения и очистки. Основное направления развития эти работ заключалось в сокращении стадий процесса и использованию новых более эффективных сорбентов. Однако предлагаемые методики требовали много ручного труда и их трудно автоматизировать. Среди наиболее часто используемых биотехнологических процессов следует выделить жидкостную 45 экстракцию и мембранную фильтрацию. Эти процессы легко автоматизируются, есть соответствующее оборудование. Поэтому основное внимание в работе обращается на развитие и использование их для получения, очистки растворов L-лизин-a-оксидазы. Жидкостная экстракция органических соединений широко используется в медицинской, фармацевтической и пищевой промышленности. Однако органические растворители пожароопасные, токсичны и приводят часто к падению биологической активности препаратов. Более перспективным является применение жидкостных экстракционных систем на основе водорастворимых полимеров. Данные процессы хорошо сочетаются с процессами высаливания балластных белков, которые, как правило, выполняются на первой стадии получения препарата. Метод нашёл применение для различных биотехнологических процессов, которые описаны в работе [Янкевич Н.Б., Лаугалене Н.Ф., Веса В.С., Хадуев С.Х., Смирнова И.П., Берёзов Т.Т. 1989., Nifant'eva T.I., Shkinev V.M., Spivakov B.Ya. 1994, Нифантьева Т.И., Матоушова В., Адамцова З., Шкинев В.М. 1989, Шляхина Ю.В., Мокшина Н.Я., Хохлов В.Ю., Медведева Н.Н., Селеменев В.Ф., Шаталов Г.В. 2005 гг.]. Также они используются для выделения водорастворимых органических соединений, таких как природные гуминовые вещества, фенолы, разнообразные красители [Терещенко Г.Ф., Путилов А.В. доклад]. Данные процессы хорошо сочетаются с процессами высаливания балластных белков, которые, как правило, выполняются на первой стадии получения препарата. В начале работы были опробованы все стадии предварительной подготовки нативных растворов на примере схемы получения фермента с использованием новых сорбентов. Представлены варианты выделения и очистки противоопухолевого фермента L- лизин-α-оксидаза из гриба триходермы. Для ферментации гриба использовали ферментёр типа БИОР-01, объёмом 100 л с коэффициентом заполнения 0,6. Нативный раствор обрабатывали на нуч-фильтре, затем на сепараторе типа ОСБ при 9000 об/мин в течение часа при температуре (2-4)ºС, 46 отделяли белки 15-ным%раствором сульфата аммония, выделяли фермент 70% раствором сульфата аммония, концентрировали фермент из 55 л до 1,5 л диализом. Затем проводили очистку с использованием сорбентов DEAEсефацела, сефадекс G-100 и G-200. Удельная активность фермента L-лизин-αоксидазы повысилась от 4 до 200 ед /мг. Выделение и очистку по второму варианту осуществляли методом последовательной 4 ступенчатой мембранной фильтрации с мембранами с размером пор от 0,2 мкм до 30 kDа. Чистоту препарата проверяли методом капиллярного электрофореза. На первых этапах исследования проводилось высаливание белковой составляющей (концентрата) насыщением исходного сырья увеличивающимися концентрациями сульфата аммония. Результаты представлены в таблице 4. Из таблицы 4 видно, что высаливание примесных белков без осаждения фермента возможно при концентрации сульфата аммония ниже 15%. Таблица 4 - Выделение L-лизин-α-оксидазы при высаливании сульфатом аммония (Объём фракции, 7 мл). Концентрация сульфата аммония (%) Активность L-лизин-α-оксидазы Ед/мл Ед/мг Сумма (мг) 5,40 3,80 38 5,3 4,8 37 4.2 4,4 30 3.5 7,0 24 8,0 8,0 24 0 10% 20% 30% 70% При содержании сульфата аммония 70% происходит полное высаливание белков, которые затем растворяют в минимальном объёме фосфатного буфера. Раствор фермента диализировали дважды против 20 мМ NaCl фосфатного буфера рН 7,4. Полученный диализат разделили на две части. Затем большую часть наносили на колонку с ионообменной смолой DEAE-сефацелом, уравновешенную тем же фосфатным буфером. Размер колонки 1,5 на 20 см. 47 Фермент элюировали при градиенте концентрации NaCl от 0 до 0,6 М. В полученных фракциях определяли активность фермента. Оказалось, что конечной концентрации NaCl-0,6 М недостаточно для десорбции фермента. Поэтому оставшуюся часть раствора белка после диализа наносили на ионообменную смолу и фермент элюировали при градиенте концентраций NaCl – от 0 до 0,8 М. Десорбция фермента начиналась с 0,3 М. Фракции, содержащие фермент, после 1 и 2 колонок объединяли, белок осаждали 70% раствором сульфата аммония и после центрифугирования осадки растворяли в фосфатном буфере. Полученный раствор, содержащий фермент, разделяли на две порции. Первую порцию наносили на колонку с сефадексом G 100 c учётом того, что молекулярная масса фермента около 140 кДа. Размер колонки 0,9 на 90 см. Смола уравновешена 20 мМ фосфатным буфером рН 7,4. В полученных фракциях определяли активность L-лизин-αоксидазы и фракции объединяли. Вторую порцию наносили на колонку с сефадексом G200. Результаты выделения и очистки фермента представлены в таблице 5. Таблица 5 - Выделение и очистка L-лизин-α-оксидазы. Стадии выделения фермента 0 15% 70% Объём фракции (мл) Содержание белка мг/мл Активность L -лизин-αоксидазы Ед/мл Ед/мг Сумма (Ед) Сумма (мг) Осаждение сульфатом аммония 55 1,40 77 50 1,10 55 45 0,80 36 Очистка на колонке DEAE-сeфацел 30 0,80 25 33 0,12 4,00 5,70 6,30 5,80 Хроматографирование 5,80 Элюирование 0,6 М 4,00 раствором NaCl Повторная очистка на колонке DEAE-сeфацел Хроматографирование 15 0.80 12,00 5.8 Элюирование 0,8 М 20 0,07 1,4 4,3 раствором NaCl Осаждение очищенного фермента сульфатом аммония 70% раствор 2 2,5 5,0 90 Очистка фермента на колонках Сефадекс Сефадекс G200 15 0,03 0,45 5,6 Сефадекс G100 13 0,03 0,40 6,0 48 4.00 5,70 7,25 313 313 261 7,25 33,00 174 132 7,25 61 90 86 36 180 187 200 85 80 Как видно из представленных результатов, удельная активность фермента L-лизин-α-оксидазы повысилась от 4 до 200 ед /мг. Результаты исследования показали возможность использования для очистки фермента сефадекс G100. Содержание L-лизин-α-оксидазы на каждой стадии очистки контролировали с помощью электрофореза в ПААГ (10%). Далее был поставлен опыт по выделению и очистке L-лизин-α-оксидазы из 300 мл концентрата. Полученные результаты представлены в таблице № 4. Результатом проведённых стадий очистки был получен фермент с удельной активностью 292 ед/мг белка. Электрофорез в 10% ПААГ в присутствии додецилсульфата натрия показал, что очищенный фермент обнаруживается в виде преимущественно одной полосы в области 60 кДа. После конечной стадии очистки L-лизин-α-оксидазы была проведена лиофилизация фермента из 11 мл раствора, содержащего 1,4 мг белка с активностью 410 Ед. Таблица 6 - Новая технология выделения и очистки фермента L-лизин-αоксидазы. Стадии выделения фермента Объём фракции, мл 0 15% 70% 300 290 30 DEAEсeфацел Сефадекс G100 140 80 Содержание белка Активность L-лизин-α-оксидазы мг/мл Сумма Ед/мл Ед/мг Сумма (мг) (Ед) Осаждение сульфатом аммония 1,40 420 14 10 4200 1,20 348 14 11 4060 6,50 195 133 20,5 4000 Хроматографирование на смолах 0,20 28 27 135 3800 0,14 11,2 41 292 3300 Леофильно высушенный препарат (45 мг) содержит то же количество фермента (1,4 мг), которое было взято до лиофилизации, и представляет собой порошок белого цвета с активностью 340 Ед. 49 Предложенная технология существенно сокращает стадии выделения и очистки противоопухолевого фермента по сравнению с технологией, используемой ранее (2,3) и может использоваться для получения фермента. Однако следует заметить, что при относительно высоких концентрациях сульфата аммония активность препарата уменьшается, а водорастворимые полимеры предохраняют, в частности ферменты, от инактивации поэтому были изучены условия получения гетерогенных систем с сульфатом аммония и различными водорастворимыми полимерами. Поэтому следующим экстракционных систем этапом на исследований основе был водорастворимых сделан выбор полимеров для последующей доочистке L-лизин-α-оксидазы данным методом из растворов сульфата аммония. В качестве экстрагентов нами применены кислородсодержащие водорастворимые полимеры виниламидного ряда (полиN-винилпирролидон (ПВП), поли-N-винилметил-ацетамид (ПВМА)) и полиэтиленгликоль (ПЭГ) (таблица 7). Выбор полимеров обусловлен их высокой комплексообразующей способностью по отношению к биологически активным веществам. Нами была предложена использование двухфазовой системы. Нами исследовались условия получения гетерогенных с сульфатом аммония и различными водорастворимыми полимерами. Проведено исследование фазовых равновесий в системах водорастворимый полимер-сульфат аммония. Вязкость растворов полимеров и скорость их расслаивания с растворами солей зависят от молекулярной массы полимера и его концентрации в системе. При концентрации ПВМА 12 мас. % в насыщенном растворе соли разделение фаз происходит в течение 3 мин. При выполнении эксперимента нами применены растворы ПЭГ-5000 с концентрацией полимера менее 30 мас. %. Использование таких растворов ПЭГ и раствора сульфата аммония с концентрацией 20 мас. % позволяет разделять фазы менее чем за 3 мин, причём с уменьшением концентрации полимера и с повышением содержания соли в растворе скорость расслаивания 50 системы возрастает. Полнота выделения полимера в отдельную фазу зависит от растворимости высаливателя и полимера в воде, а также от растворимости электролита в полимере [Бардин В.В., Ягупольский Ю.Л. 1987., Альбертсон П.О. 1974., Сергиевский В.В., Джакупова Ж.Е., Шкинев В.М., Спиваков Б.Я. 1994 гг.]. Таблица 7 - Структура кислородсодержащих водорастворимых полимеров. Полимер Поли-Nвинилпирролидон Формула O N CH Поли-Nвинилкапролактам H2 C * Молекулярная масса 10000 CH2 H C n 20350 * n N H2C O C H2C CH2 H2C C H2 Поли-Nвинилметилацетамид CH2 n C H3C N C H Полиэтиленгликоль 17275 O CH3 H2 C n (-СН2СН2О-)nOH 51 5000 Стабильность гетерогенной системы в широком диапазоне концентраций полимера ПГ и рН достигается в присутствии (NH4)2SO4 и Na2SO3. с полимера, мас % 30 25 2 1 20 15 10 1 5 0 0 5 10 15 20 25 30 с соли, мас% Рисунок 12 - Фазовые диаграммы систем ПВМА – (NH4)2SO4 (1) и ПВМА – Na2SO3 (2). с полимера, масс % 30 25 20 15 10 2 5 1 0 0 5 10 15 20 25 30 с соли, масс% Рисунок 13 - Фазовые диаграммы систем ПВП – (NH4)2SO4 (1) и ПВП – Na2SO3 (2). Поэтому легко растворимые сульфит и сульфат натрия, хлориды натрия и калия, сульфат аммония обеспечивают наиболее полное выделение полимера в отдельную фазу. Были изучены фазовые равновесия в водно-солевых растворах 52 ПЭГ с целью выбора условий получения гетерогенных систем для широкого круга органических веществ. На рисунке 14 приведены фазовые диаграммы систем ПЭГ − соли неорганических кислот − Н2О. Видно, что область II равновесия двух жидких фаз, которая и используется в качестве экстракционной системы, занимает значительную часть треугольника Гиббса – Розебома и с увеличением молекулярной массы (ММ) полимера она расширяется, т.е. чем выше степень полимеризации ПЭГ, тем ниже его концентрация, требуемая для получения гетерогенной системы. Рисунок 14 - Фазовые диаграммы систем ПЭГ−(NH4)2SО4−Н2О для различных ММ полимера: 1−6000, 2−3000, 3−2000, 4−1500, 5−600. I − область одной жидкой фазы, II − область равновесия двух жидких фаз, III − область равновесия твердой и жидкой фаз. При этом наиболее существенные изменения в фазовых диаграммах наблюдаются в интервале ММ от 600 до 2000 Да. В то же время вязкость растворов полимера резко возрастает с увеличением его ММ. Например, вязкость 40%-ного раствора ПЭГ-600 лишь в 2,3 раза меньше, чем 40% раствора ПЭГ-2000, а в интервале ММ от 2000 до 6000 вязкость 40% растворов возрастает более чем в 7 раз. Оптимальная область гетерогенности и вязкости растворов получено для ПЭГ с ММ от 1500 до 2000, которые и использовали в дальнейшем для изучения. 53 Изучение экстракции L-лизин-α-оксидазы и некоторых аминокислот Выбор проведения данного исследования обусловлен тем, что аминокислоты, возможно будут также извлекаться с ферментом. Изучена экстракция L-лизин-α-оксидазы и некоторых аминокислот из растворов сульфата аммония. Обычно аминокислоты экстрагируются слабо из водных сред. Изучена экстракция фенилаланина, тирозина и триптофана в системах аминокислота – (NH4)2SO4 – ПВМА и аминокислота – Na2SO3 – ПВМА в широком интервале рН водно-солевых растворов. Для экстракционных систем Phe – (NH4)2SO4 – ПВМА, Trp – (NH4)2SO4 – ПВМА, Tyr – (NH4)2SO4 – ПВМА и Phe – Na2SO3 – ПВМА, Trp –Na2SO3 – ПВМА, Tyr – Na2SO3 – ПВМА рассчитаны коэффициенты распределения и степень извлечения аминокислот. В системах с поли-N-винил-N-метилацетамидом проявляется наибольшее сродство полимера к триптофану. Максимальная степень извлечения триптофана при однократной экстракции в присутствии сульфата аммония – 73,4%, тирозина – 69%, фенилаланина – 25%. Экстракция полиэтиленгликолем из водно-солевого раствора более эффективна, чем экстракция поли-N-винил-N-метилацетамидом. Применение сульфата аммония повышает степень извлечения тирозина (степень извлечения 45,2%), триптофана (60,6%) и фенилаланин (13,5%). Установленные закономерности экстракции аминокислот поли-N-винил-N-метилацетамидом относятся и к экстракции полиэтиленгликолем: так, минимальная степень извлечения характерна для фенилаланина. Показано, что экстракция L-лизин-α-оксидазы в системе ПЭГ-сульфат аммония, намного более эффективна по сравнению с аминокислотами. Степень извлечения до 90%, что позволяет заключить, что экстракция дополнительно очищает фермент от аминокислот. Однако данная стадия очистки требует дополнительного изучения. Для изучения экстракции предварительно были получены спектры растворов полимеров как с аминокислотами, так и без них. 54 Для изучения механизма распределения аминокислот в фазу поли-N-винилпирролидона сняты ИК-спектры полимера и экстракта после экстракции (рисунки 9 и 10). В фазе экстрагента повышается содержание воды, о чём свидетельствуют уширения полос поглощения при 3400–3050 см-1, характерных для воды, и изменение интенсивности пиков при 1640 и 1480 – 950 см-1. Увеличение содержания воды в экстрагенте способствует образованию более прочных комплексов полимера с аминокислотой за счёт водородной связи между их функциональными группами. T, % 500 1000 1500 2000 2500 3000 3500 4000 , см-1 Рисунок 15 - ИК-спектр поли-N-винилпирролидона. Исследования аминокислотами определения комплексов практически аминокислот в не водорастворимых проводились. водных растворах полимеров Для и с количественного органической фазе предварительно построены спектральные характеристики полимеров (рисунки 17, 18, 19). Изучено комплексообразование водорастворимых полимеров с ароматическими аминокислотами при компонентов. 55 разных молярных соотношениях T, % 500 3500 1000 1500 2000 2500 , см-1 3000 Рисунок 16 - ИК-спектр экстракта поли-N-винилпирролидоном. Установлена зависимость максимума светопоглощения смеси от концентрации аминокислот в растворе и температуры. Наиболее прочный комплекс в системе поли-N-винилпирролидон – фенилаланин образуется при концентрации аминокислоты 2∙10 -3 моль/дм3 в условиях наибольшего сдвига максимума светопоглощения. При повышении температуры максимум смещается в длинноволновую область, что связано с разрывом связей в ассоциате вода – амидная группировка полимера и объясняется повышением прочности ассоциатов полимера с аминокислотой при увеличении температуры. Образование комплексов в системах фенилаланин – поли-N-винилпирролидон, фенилаланин – поли-N-винилкапролактам, триптофан – поли-Nвинилкапролактам, триптофан – поли-N-винилпирролидон и триптофан – полиN-винил-N-метилацетамид подтверждается соответствующими УФ-спектрами светопоглощения полимеров и аминокислот при совместном присутствии. На спектрах проявляются максимумы светопоглощения индивидуальных компонентов, а также новые максимумы, свидетельствующие об образовании комплексных соединений в растворе. 56 A 0,7 0,6 0,5 0,4 0,3 0,2 0,1 190 195 200 205 210 l, нм Рисунок 17 - УФ-спектр светопоглощения поли-N-винилпирролидона; lмах = 194 нм. . A 0,8 0,6 0,4 0,2 0 19 0 20 0 21 0 22 l, 0н м 23 0 24 0 Рисунок 18 - УФ-спектр светопоглощения поли-N-винилкапролактама; lмах = 202 нм Слабо выраженный максимум при 202 нм на спектре светопоглощения смеси поли-N-винилпирролидон – фенилаланин подтверждает наличие батохромного сдвига, т.е. образование комплекса (ассоциата) полимера с аминокислотой. На УФ-спектрах светопоглощения систем поли-N-винилпирролидон – триптофан, поли-N-винил-N-метилацетамид – триптофан, поли-N-винилкапролактам – триптофан и поли-N-винилкапролактам – фенилаланин также обнаружены новые, не характерные для индивидуальных компонентов 57 максимумы светопоглощения при 218, 228, 222 и 230 нм соответственно. А 0,5 0,4 0,3 0,2 0,1 0 190 200 210 220 230 l, нм Рисунок 19 - УФ-спектр светопоглощения поли-N-винил-N-метилацетамида; А 21 0 20 5 20 0 19 5 19 0 0 0,5 1,0 1,5 2,0 2,5 3,0 lмах= 193 нм.с . 10-3, моль/дм3 Рисунок 20 - Зависимость максимума светопоглощения от концентрации аминокислоты в смеси поли-N- винилпирролидон – фенилаланин. Для подтверждения комплексообразования сняты ИК-спектры смесей аминокислот с полимерами. Методом ИК-спектроскопии получена важная информация о строении молекулярных комплексов. Например, смещение максимума при 2100 см-1 на 250 см-1 в ИК-спектре смеси поли-N- винилпирролидон – фенилаланин (появление максимума при 2350 см-1) свидетельствует об образовании водородных связей между атомами азота полимера и водорода фенилаланина. На основании максимумов светопоглощения можно заключить, что при взаимодействии полимеров с аминокислотами 58 образуются комплексы, оптические свойства которых отличаются от свойств исходных компонентов. Разработка мембранных методов для разделения белковых компонентов. Апробация мембран нового поколения, полученных на основе нанотехнологий Мембранные методы широко используются в биотехнологии для выделения и концентрирования, полимерных водорастворимых соединений. Наиболее часто используются малопроизводительны, неорганических как солей процессы правило, при диализа, используются концентрировании однако для они удаления низкомолекулярных органических соединений. В данной работе для доочистки и концентрирования фермента L-лизин-αоксидазы была применена последовательная непрерывная или каскадная ультрафильтрация. Выбор размеров пор в мембранах определялся известными из литературы размерами молекул фермента. На первом этапе с использованием мембраны с размерами пор 0,22 мкм проводилась условная стерилизация раствора и удаление механических примесей. Затем удаляли примеси белком с размером молекул более 500 kDa, после этого проводили более тонкую очистку раствора с мембранами 300 kDa и на последней стадии концентрировали фермент и промывали его фосфатным буферным раствором с использованием мембран с порами менее 50 kDa . Данный процесс осуществлялся как в каскадном варианте, так и режиме непрерывной проточной фильтрации. Получены сходные результаты. Во фракциях определяли содержание белка и активность фермента. За чистотой продукта наблюдали методом капиллярного электрофореза. На рисунке 21 представлены спектры исходного раствора до мембранной очистки. Исходный раствор имеет темно-коричневый цвет с возможным присутствием взвеси, которую предварительно отфильтровывали на бумажном фильтре. Из рисунка 21 видно, что раствор характеризуется большим числом полос не известной идентификации 59 и данный спектр указывает на загрязненность препарата различными органическими соединениями. 5.33 mAU 1 2 Capel 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 мин Рисунок 21 - Спектр исходного раствора до очистки. Условия анализа: буфер рН=7.4 (фосфатный), 20 мМ, длина волны 220 нм, напряжение 15 кВ, ток 64 мкА. Ввод пробы 40\10 (мБар\сек). На оси абсцисс – время в минутах На оси ординат – интенсивность сигнала в миллиамперах на вольт (mАU). Показательными являются также спектры промывных растворов капилляра, полученные после вымывания загрязнителей из капилляра после электрофореза исходного раствора. На рисунках 22-24 показано, что вымывной раствор содержит большое число примесей при использовании различных растворов для промывки капилляра после анализа исходного раствора. 1 - промывка капилляра дистиллированной водой в два этапа 2 мин и 8 мин.; Видно, что даже длительная промывка капилляра водой не приводит к значительному изменению сигнала. Поэтому дальнейшая промывка проводилась 0.01 М раствором HCI. 2 - промывка капилляра 0.01 М раствором HCI в течение 3,5 мин. При использовании данного раствора удается снизить содержание примесей находящихся в капилляре. дополнительно промывали водой. 60 Для подготовки капилляра его Для характеристики чистоты препарата после мембранной очистки был получен спектр фермента, представленный на рисунке 22 в двух различных масштабах (до 2,59 и до 21,3 . mAU). Видно, что спектр очищенного фермента представлен широкой полосой от 3 до 12 минут, что является характерным для оксидаз и пероксидаз различного строения. При уменьшении концентрации фермента до 0,05 мг/мл наблюдается уменьшение максимума при 6-8 мин, при этом полоса при 4 мин сохраняется. Это дает возможность предположить, что максимум полосы L-лизин-αоксидазы находится в данном диапазоне. 35.2 mAU Capel 1 2 3 4 5 6 7 8 9 Рисунок 22 - Спектры промывных растворов. мин 3.45 mAU Capel 1 мин 2 Рисунок 23 -Спектры промывных растворов. 1 - промывка капилляра дистиллированной водой в два этапа 2 мин и 8 мин.; 2 - 0.01 М соляная кислота время промывки 3,5 мин. Выход фермента при последовательной мембранной фильтрации составил до 85%, при этом содержание белка наблюдалось, как и при хроматографическом выделении на уровне 0,2 мг/мл, а удельная активностью 61 равна 50 ед/мг белка. Таким образом, нами показана, что возможность получение противоопухолевого фермента L-лизин-α-оксидазы при использовании двух предложенных вариантах процесса. Получены электрофореграммы растворов на каждой стадии мембранной очистки, что позволило оптимизировать условия проведения очистки. Получены спектры очищенного препарата при рН 5 и 8. 1. 2.59 mAU 2 2. 4 6 8 10 12 14 16 18 20 22 24 26 мин Capel 21.3 mAU Capel 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 мин Рисунок 24 - Спектры растворов после мембранной очистки в двух различных масштабах (1-до 2,59 и 2-до 21,3 mAU). Условия анализа: буфер рН=7.4 (фосфатный), 20 мМ, длина волны 220 нм, напряжение 15 кВ, ток 64 мкА. Ввод пробы 40\10 (мБар\сек). Оптимизация режимов выделения и разделения компонентов белковой смеси для очистки биопрепарата Для получения доказательств чистоты биопрепарата нами были проведены дополнительные исследования активности оксидазы методом капиллярного электрофореза. Для расшифровки полученных спектров были изучены спектры ряда 62 аминокислот и их смесей методом капиллярного электрофореза. 20 mAU Capel 1 2 3 4 5 6 7 8 9 мин Рисунок 25 - Ввод пробы валина 20/10 (мБар/сек), треонина 20/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 65 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.483 (36.62), 2.606 (40.26). Был проведён анализ полученных спектров. Аминокислоты: по 0,01М, Валин (1), треонин (2), аланин (3), тирозин (4) Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 65 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.525 (84.9), 2.593 (34.3) 10 mAU Capel 1 2 3 4 5 6 7 8 9 мин Рисунок 26 - Пробы валина 10/10 (мБар/сек), аланина 20/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 65 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.415 (17.59), 2.458(24.59). 10 mAU Capel 1 2 3 4 5 6 7 8 9 мин Рисунок 27 - Пробы аланин 20/10 (мБар/сек), тирозин 20/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 65 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.539 (921). 63 131 mAU Capel 1 2 3 4 5 6 7 8 9 мин Рисунок 28 - Пробы аланин 20/10 (мБар/сек), Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.476 (26.52). 10 mAU Capel 1 2 3 4 мин Рисунок 29 - Ввод пробы тирозин 5/5 (мБар/сек), ДМСО 5/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.39 (77.49), 2.468 (118.64). 100 mAU Capel 1 2 3 4 мин Рисунок 30 -Ввод пробы валин 20/10 (мБар/сек), ДМСО 5/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.318 (77.39), 2.374 (37.00). 64 30 mAU Capel 1 2 3 4 мин Рисунок 31 - Ввод пробы треонин 20/10 (мБар/сек), ДМСО 5/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пик на фореграмме – 2.39 (118.22). 30 mAU Capel 1 2 3 4 мин Рисунок 32 - Пробы аланин 20/10 (мБар/сек), ДМСО 5/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 2.289 (83.46), 2.35 (27.92). 30 mAU Capel 1 2 3 4 мин Рисунок 33 - Ввод пробы лизин 20/10 (мБар/сек), ДМСО 5/10 Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 1.693 (27.92), 2.415 (242.67) 65 60 mAU Capel 1 2 3 4 мин Рисунок 34 - Ввод пробы смеси лизина, аланина, треонина, валин по 20/10 (мБар/сек), тирозин 5/5. Длина волны 220 нм, температура 25 С, напряжение 15 кВ, ток 67 мкА. Буфер фосфатный рН 7,4 – 20 мМ. Пики на фореграмме – 1.7(14.89), 2,156(38,43), 2.4(215), 2,497(152,63). Из полученных данных можно сделать вывод, что аминокислоты характеризуются пиками на электрофореграмме в диапазоне 3 минут. 2.5 Разработка рекомендаций по возможности использования результатов проведенных НИР в реальном секторе экономики Создание технологий получения лекарственных препаратов нового поколения, а также конструирование высокоэффективных наноструктурированных систем – это проблемы стоящих перед современной медициной и которые вполне решаемы с использованием нанотехнологии. На основе полученных результатов проведённых научных исследований по проблеме «Создание технологии получения лекарственного биопрепарата с использованием наноматериалов» нами проведена поисковая работа по отработке условий выделения и очистки фермента с использованием наноматериалов на опытном образце в авторском исполнении [Shkinev V.M. On-line, multi-stage membrane systems for separating natural - water componens and suspended solid materials.//An International Newsletter Membrane Technology.2001.-June.- N134.- P.8-10.]. Ранее данная система была использована для очистки воды и в биотехнологическом процессе используется впервые. 66 Препарат на основе фермента оксидазы L-лизина является полифункциональным и может быть применён для создания лекарственных форм разного назначения в фармацевтической промышленности. Такая перспектива обоснована на научных исследованиях, которые доказали возможность использования этого фермента: как противоопухолевой субстанции, которая гриба триходерма обладает выраженным тормозящим влиянием на синтез ДНК, РНК и белка в культивируемых клетках карциномы яичника человека (CaOv) и лимфомы Беркитта (P3Hrj) в опытах in vitro. Противоопухолевый эффект фермента выражался в значительном торможении роста аденокарциномы молочной железы Са-755 и опухоли Льюис (3LL), в увеличении продолжении жизни мышей с перевиваемыми лейкозами и излечении мышей с асцитной гепатомой; фермент обладает антиметастатическим действием. Введение препарата в концентрации 50 МЕ/кг. Количество метастазов в лёгких уменьшается в 3,5 раза, а их объём в 10 раз по сравнению с этими показателями у животных, не получивших препарат. Показано in vivo, что оксидаза L-лизина обладает более широким спектром противоопухолевого действия по сравнению с известным противоопухолевым препаратом L-аспарагиназой, что делает препарат также перспективным в химиотерапии опухолей; в качестве аналога антивирусного средства может быть ацикловир. Используемая концентрация оксидазы оказалась в 100 раз ниже по сравнению с известным противогерпетическим препаратом ацикловиром. Она активно подавляет развитие генитальной герпетической инфекции в эксперименте на морских свинках, при этом комбинированное лечение оказалось наиболее эффективны; нами исследовалась возможность фермента ингибировать репродукцию вируса иммунодефицита человека, и сравнить с используемым в качестве ингибитора ВИЧ азидотимидином. Азидотимидин подавление репродукции вируса в дозе 1,2 мкг/мл, а оксидаза 67 вызывает L-лизина в концентрации от 7,0 до 70 нг/мл полностью блокирует ВИЧ, не оказывая токсического воздействия на клетки МТ-4. Создание препарата нового поколения на основе использования метаболита триходермы может найти применение в качестве лекарственного средства в фармацевтической промышленности. Рекомендации сфер использования субстанции триходермы в фармацевтической промышленности, в качестве лекарственного препарата в онкологии; при химиотерапии вирусных заболеваний; при химиотерапии вирусных заболеваний; как ранозаживающее средство; как иммуномодулятора; в комбинации с другими лекарственными средствами. Нативный фермент может быть использован в биосенсорных системах для определения концентрации L-лизина. Как показали наши предварительные исследования, может быть рекомендована к использованию также нативная форма оксидазы L-лизина для создания лекарственного средства в ветеринарии. Нами предполагается проведения экспериментов по созданию такой наноструктурированой лекарственной формы. 2.6 Разработка рекомендаций по использованию результатов НИР при создании научно-образовательных курсов Оксидаза аминокислоты L-лизина – новый препарат микробного происхождения, обладающий противоопухолевой и антивирусной активностями. Разработка удобных и эффективных методов выделения и очистки белков и ферментов, особенно имеющих применение в промышленности и медицине, является актуальной задачей. С этой точки зрения исследования, выполненные 68 по проблеме «Создание технологии получения лекарственного биопрепарата с использованием наноматериалов» безусловно, представляют интерес, так как является новыми и более эффективными. Наноразмерные мембраны могут быть рекомендованы в самые приоритетные сферы деятельности человека. Среди наноматериалов пористые мембраны занимают уникальное положение. Это объясняется следующими причинами. Сами мембраны являются типичными наноструктурами, которые представляют сложную систему отдельных нанопор в полимерном каркасе. Нами впервые был использован для выделения и очистки фермента мембранный метод, основанный на использовании наноструктурированной системы. Метод основан на последовательной 4 ступенчатой мембранной фильтрации с использованием мембран с размером пор от 0,2 мкм до 30 kDа. Чистоту препарата проверяли методом капиллярного электрофореза. Разработанный мембранный метод выделения и очистки перспективного фермента может быть рекомендован при создании научнообразовательных курсов по специальностям биохимия и биотехнология. 69 Глава 3 Публикации результатов НИР 3.1 Заключение экспертной комиссии по открытому опубликованию 70 3.2 Копии статей, опубликованных в журнале ВАК или зарубежном журнале с обязательной ссылкой на проведение НИР в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 годы 71 72 73 74 75 76 77 78 Заключение Развитие современных методов получения эффективных противоопухолевых препаратов с использованием достижений нанотехнологии одно из важнейших направлений развития биотехнологии. Однако, следует обратить внимание на то, что и в нанотехнологии нет четких подходов к выбору систем для применения в методах разделения сложных природных объектов. Можно разделить наносистемы и нанообъекты на так называемые мягкие (soft matter) и жесткие. Мягкие системы характерны для коллоидных, полимерных, биологических объектов и подчас уже изучались в рамках коллоидной химии, биотехнологии. В этих областях знаний накоплен значительный экспериментальный и теоретический материал, который при рассмотрении с позиций нанохимии дает возможность понять наблюдаемые явления. Такие системы очень часто наблюдаются в экстракционных методах разделения. В экстракционный системах можно выделить следующие основные типы нанообъектов: - ассоциаты молекул, обладающих поверхностно-активными свойствами; - адсорбционные слои, мицеллы, мицелярные гели, везикулы, жидкие кристаллы; - клубки полимеров, полимерные гели (студни); дисперсные твердые фазы; - золи, кристаллические гели, кристаллические осадки; - дисперсные жидкие фазы: мицеллы и солюбилизированные мицеллы, микроэмульсии, нанодисперсия, эмульсии. Наноструктуры в экстракционных системах могут оказывать влияние на равновесие и кинетику экстракции. Влияние на экстракционные равновесия может заключаться в изменении констант распределения и разделения, в изменении числа фаз экстракционных систем. Влияние на кинетику экстракции определяется повышением вязкости фаз, уменьшением коэффициентов диффузии, возникновением структурно- механических барьеров, что ухудшает разделение фаз. С другой стороны, мицеллярный транспорт и транспорт веществ нанодисперсией может приводить 79 к большим значениям эффективных коэффициентов диффузии. Наноструктуры в процессах разделения могут быть использованы либо для создания соответствующих сред, либо в качестве экстрагентов, катализаторов и прочие вариантах процессов. Например в процессах экстракции из жидких фаз (мициллярная экстракция, мембранная экстракция с нанодисперсией, микроэмульсия) – наноструктуры используются для экстракции веществ. Экстракция в точке помутнения и при коацервации (используется образование дисперсной фазы, в том числе наночастиц). Селективный транспорт веществ в везикулах и липосомах (наноструктуры в качестве селективных носителей). Высокоселективные процессы с использованием супрамолекулярных структур (наноструктуры могут быть супрамолекулами, ансамблями и устройствами). Катализ (мицеллярный каиализ, катализ в микроэмульсиях). Мицеллы и наночастицы в различных вариантах хроматографии и электрофореза (мицеллярная ВЭЖХ и прочие). Мембранные методы с наноструктурами (нано и ультрафильтрация, жидкие мембраны и прочие). Большинство рассмотренных систем были использованы в данном этапе проекта. Фермент L-лизин--оксидаза (КФ 1.4.3.14), противоопухолевая активность которого была показана японскими исследователями Kusakaba H. и Soda К., синтезируется грибами рода Trichoderma. С целью создания отечественного биопрепарата на основе L-лизин-оксидазы были проведены исследованя фазовых равновесий в системах водорастворимый полимер-сульфат аммония и экстракции различных аминоислот; экстракция L-лизин--оксидазы в системе полиэтиленгликольсульфат аммония. Нами осуществлен выбор типа мембран, размер пор и оборудования. Осуществлён поиск и разработка мембран прецизионной пористости с улучшенными эксплуатационными и адсорбционными параметрами для очистки растворов оксидазы L-лизина, оценка их основных физико-химических 80 и эксплуатационных свойств. На основе содержащего использования фермент мембранной фильтрации с L-лизин--оксидазу, концентрата, использованием мембран различной природы, включая трековые и с использованием мембран с различными размерами пор, осуществлено создание новых биотехно- логических процессов концентрирования, выделения и очистки L-лизин-оксидазы, получения чистых растворов Доказана L-лизин--оксидазы. возможность многоступенчатой последовательной очистки растворов L- лизинα-оксидазы с целью автоматизации процессов очистки биопрепарата и произведён поиск наноматериала для изготовления носителя протвоопухолевого фермента. Разработан новый подход к определению активности фермента с использованием капиллярного электрофореза. Впервые получены электрофореграммы кинетики ферментативной реакции. В ходе работ были сделаны выводы: 1) проведены исследования фазовых равновесий и экстракции различных аминокислот в системах водорастворимый полимер-сульфат аммония; 2) показана возможность экстракция l-лизин-a-оксидазы в системе полиэтиленгликоль-сульфат аммония и последующей реэкстракции в растворы, содержащие хлорид натрия; 3) изучена мембранная фильтрация фермента с использованием мембран, как различной природы, включая трековые, так и с различными размерами пор; 4) предложено использовать для определения чистоты биопрепарата метод капиллярного электрофореза; 5) доказана возможность определения активности биопрепарата по каталитической реакции l-лизин-a-оксидазы с l-лизином методом капиллярного электрофореза; 6) разработано и предложено несколько схем выделения и очистки lлизин-a-оксидазы с использованием мембран, наноматериалов для масштабирования процесса. 81 изготовленных из На основании полученных результатов предложено несколько схем выделения и очистки фермента и создание условий масштабирования процесса с целью наработки исходной субстанции. Предполагается провести анализ, выбор и создание потенциальных лекарственных форм биопрепарата, провести тестирование их. 82 Список использованных источников 1 Hollander A., Behnish J. // Surf. Coat. Technol. 1998. V.98. №1-3. P. 855 2 Берёзов Т.Т.,Смирнова И.П., Сяткин С.П., Спектрофотометрический микрометод определения L-лизин--оксидазы // Вопр. мед. химии.-1984 г.-№ 1., С.133-136 3 Смирнова И.П., Алексеев С.Б. Биосинтез противоопухолевого фермента L-лизин--оксидазы Trichoderma sp.// Антибиотики и химиотерапия.2009 г.-Т.54.-В. 5-6.-С.8-11 4 Juliano R., Alam R., Dixit V., Kang H. Mechanisms and strategies for effective delivery of antisense and siRNA oligonucleotides // Nucleic Acids Research. 2008. V. 36. P. 4158-4171 5 Stewart S.S., Harrington K.J. The biodistribution and pharmacokinetics of stealth liposomes in patients with solid tumors // Oncologe. 1997. V. 11. P. 33-37. 6 Michalet X., Pinaud F.F., Bentolila L.A. et al. Quantum dots for live cells, in vivo imaging and diagnostics // Science. 2005. V. 307. P. 538-544 7 Kelly K.A., Allport J.R., Tsourkas A. et al. Detection of vascular adhesion V. 96. P. 327-336 8 Choi J.-W., Oh В.-К., Kim Y.-K., Min J. Nanotechnology inbiodevices//Journ. Microbiol. Biotechnology. 2007. V. 17. P. 5-14 9 Um S.H., Lee J.В., Kwon S.Y. et al. Dendrimer-like DNA-based fluorescence nanobarcodes // Nat. Pro-toc. 2006. V. 1. P. 995-1000 10 Brunker S.E., Cederquist K.B., Keating C.D. Metallic barcodes for multiplexed bioassays // Nanomedicine. 2007. V. 2. P. 695-710 11 Azzazy H.M.E., Mansour M.M.H., Kazmierczak S.C. Nanodiagnostics: A new frontier for clinical laboratory medicine//Clinical Chemistry. 2006. V. 52. P. 1238-1246 12 Brakmann S. DNA-based barcodes, nanoparticles and structures for the ultrasensitive detection and quantification of proteins//Angew. Chem. Int. Ed. 2004. V. 43. P. 5730-5734 83 13 McKendry R., Zhang J., Arntz Y. el al. Multiple label-free biodetection and quantitative DNA-binding assays on a nanomechanical cantilever array // Proc. Nat. Acad. Sci. USA. 2002. V. 99. P. 9783-9788 14 Lewinski N., Colvin V., Drezek R. Cytotoxicity of nanoparticles// Small. 2008. V. 4. P. 26-49 15 Oberdorster G., Oberdorster E., Oberdorster J. Nano-toxicology: An emerging discipline evolving from studies of ultrafine partickles// Environment. Health Perspectives. 2005. V. 113. P. 823-839 16 Дурнее А.Д. Токсикология наночастиц // БЭБиМ. 2008 г. Т. 145. С. 78-80 17 Дытнерский Ю.И. Баромембранные процессы. М.: Химия, 1986 г. С. 272 18 Дытнерский Ю.И., Дмитриев А.А., Мчедлишвили Б.В., Потокин И.И. // Коллоида. журн. 1985 г. №6. С. 1166 19 Брык М.Т., Цапюк Е.А. Ультрафильтрация. Киев.: Наукова думка, 1989 г. С. 306 20 Price P.B., Walker R.M. // Pat. USA № 3303085. 1962 21 Брык М.Т., Кабанов В.Я. // Успехи химии 1998 г. Т.9. №67. С. 861-895 22 Кочкодан В.М., Брык М.Т., Мчедлишвили Б.В., Житарюк Н.И. // Укр. хим. журн. 1987 г. Т.53. №1. С.29-31 23 Mitrofanova N., Sergeev A., Khohlova T., Khataibe E., Vasil'ev A. // Proceedings of Engineering with membranes. V.1. p. 450 24 Lazea A., Kravets L.I., Albu B., Ghica C., Dinescu G. // Surface & Coatings Technology. 2005 V 200.. P. 529– 533 25 Сергеев А.В., Митрофанова Н.В., Хохлова Т.Д., Нечаев А.Н., Януль Н.А., Попков Ю.М. // Тез. докл. Всерос. научной конференции Мембраны2001. Москва. 2001 г. С. 70 26 Мчедлишвили Б.В., Флеров Г.Н. // Жур. ВХО им. Д.И. Менделеева. т. 32. №6. 1987 г. С. 641 84 27 Shkinev V.M. On-line, multi-stage membrane systems for separating natural - water componens and suspended solid materials.//An International Newsletter Membrane Technology.- 2001.-June.- N134.- P.8-10 28 Nifanteva T.I., Shkinev V.M., Spivakov B.Ya., Burba P. Membrane filtration studies of aquatic humic substances and their metal species.//Talanta.-1999.Vol.48.-P. 257-267 29 Spivakov B., Shkinev V. Membrane Techniques. Ultrafiltration.// In book: Encyclopedia of Analytical Science. Elsevier, London.- 2005.- P. 524 30 Wennrich R., Mattusch J., Morgenstern P., Stärk H.-J., Spivakov B.Ya., Shkinev V. M. Multi-elemental analysis in size fractions of fine -grained solid residue of ore grinding Intern. //J. Environm. Anal. Chem. -2000.-Vol.77.-N1.-P. 6374 31 Шкинев В.М., Джераян Т.Г., Гомолицкий В.Н., Спиваков Б.Я. Аналитическое мембранное оборудования для непрерывного фракционирования частиц и макромолекул. // Наука производству.-1998 г.№2.- С.43 – 46 32 Шкинев В.М., Джераян Т.Г., Карандашев В.К., Аракчаа К.Д., Спиваков Б.Я. // Журн. аналит. хим. 2000 г. Т. 55. №2. С. 153 33 Шкинев В.М., Трофимов Д.А., Данилова Т.В., Роговая И.В., Моржухина С.В., Карандашев В.К., Спиваков Б.Я. Армированные трековые мембраны в методах оценки качества природной и питьевой воды. //Журнал аналит. химии.- 2008 г.- Т.63.- №4.- С.363-370 34 Knolthoff A.M., Sandell B.B. – Textbook of Quantative Inorganic Analasis. – New York 35 Lowry O.H., Rosebrogh W.Y., Farr A.L., Randell R.I – I. boil. chem. – 1951 – vol. 193 – Р. 265-275 36 Salata O.V. Applications of nanoparticles in biology and medicine // Joum. Nanobiotechnology. 2004. V. 2. P. 3-8 37 Morrow К.J., Bawa H., Wti C. etal. Recent advance in basic and clinical runocnedicine // Med. Clin. N. Am. 2007. V. 9. P. 805-843 85 38 McNeil S.E. Nanotcchnotogy for the biologist // Journ. Leucocyte Biol. 2005. V. 78. P. 535-594 39 Neumaier C.T., Baio C., Ferrini S. MR and iron magnetic nanoparticles. Imaging opportunities in preclinical and translatiooal research // Tumori. 2008. V. 94. P. 226-233 40 Олейников B.A., Суханова Л.В., Набиев И.P. Флуоресцентные полупроводниковые нанокристаллы в биологии и медицине // Российские нанотехнологии. 2007 г. Т. 2. С. 162-173 41 Bakry R., Valiant ЯМ., Najam-ul-HagM. etal. Medicinal application of fullerens // Int. Journ. Nanomedi-cine. 2007. V. 2. P. 639-649 42 Kraij M., Pavelic K. Medicine on a small scale // EMBO Rep. 2003. V. 4. P. 1008-1012 43 Singh I., Rehni A.K., Karla R. Dendrimers and their pharmaceutical applications // Pharmazie. 2008. V. 63. P. 491-496 44 Saltan D., Nasongkla N., Blanco E., Gao J. Functional-ized mice liar systems for cancer targeted drug delivery // Pharmaceutical Res. 2007. V. 24. P. 1029-1046 45 Immordino M.L., Dosio F., Cartel L. Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential // Int. Journ. Nano-medicine. 2006. V 1. P. 297-315 46 Goya I.A.K., Khatri K., Mishra N. et al. Aquasomes-A nanoparticulate approach for the delivery of antigen // Drug Dev. Ind. Pharm. 2008. V. 10. P. 1-9 47 Kabanov A.V. Polymer genomics: An insight into pharmacology and toxicology of nanomedicines // Adv. Drug Deliv. Rev. 2006. V. 58. P. 1597-1621 48 Liu W. - T. Nanoparticles and their biological and environmental applications // Journ. Biosci. Bioengineer-ing. 2006. V. 102. P. 1-7 49 Alexis F., Pridgen E., MolmrL.K., Farokhzad O.C. Factors affecting the clearance and biodistribut ion of polymeric nanoparticles // Molec. Pharmaceutics. 2008. V. 5. P. 505-515 50 Peer D., Karp J.M., Hong S. et al. Nanocarriers as an emerging platform 86 for cancer therapy // Nat. Nano-technology. 2007. V. 2. P. 751-760 51 Cuenca A.G., Jiang H., Hochward S.N. et at. Emerging implications of nanotechnology on cancer diagnostics and therapeutics // Cancer. 2006. V. 107. P. 459-466 52 Romberg В., Hennink W.E., Storm G. Sheddable coatings for long- circulating nanoparticles// Pharmaceutical Res. 2008. V. 25. P. 55-71 53 Sinha R., Kim G.J., Nie S., Shin D.M. Nanotechnotogy in cancer therapeutics: bioconjugated nanoparticles tor drug delivery // Mol. Cancer Then 2006. V. 5. P. 1909-1917 54 Maeda H., Wu J., Sawa T. etal. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review//Joum. Control Release. 2000. V. 65. P. 271-284 55 Jayasena S.D. Aptamers: An emerging class of molecules that rival antibodies in diagnostics // Clin. Chem. 1999. V. 45. P. 1628-1650. 56 Torchilin V.P. Targeted Pharmaceutical nanocarriers for cancer therapy and imaging // AAPS Journ. 2007. V. 9. P. 128-147 57 MUD., Kinbara K., Ishida Y. etal. Chaperonin-medi-ated stabilization and ATP-triggered release of semiconductor nanoparticles // Nature. 2003. V. 423. P. 628-632 58 Gao X., Chen J., Tao W. et al. UEA I-bearing nanoparticles for brain delivery following intranasal administration // Int. Journ. Pharm. 2007. V. 340. P. 207-215 59 Northfelt D.W., Dezube B.J., Thommes J.A. et al. Efficacy of pegylated- liposomal doxorubicin in the treatment of AIDS-related Kaposi's sarcoma after failure of standard chemotherapy // Journ. Clin. Oncol. 1997. V. 15. P. 653-659. 60 Wang X., Yang L., Chen Z., Shin D.M. Application of nanotechnology in cancer therapy and imaging // CA Cancer Journ. Clin. 2008. V. 58. P. 97-110 61 Янкевич Н.Б., Лаугалене Н.Ф., Веса В.С., Хадуев С.Х., Смирнова И.П., Берёзов Т.Т. Усовершенствованная схема очистки L-лизин--оксидазы Trichoderma sp.// Вопр.мед.химии.-1989 г.-№ 2.-С.84-86 87 62 Nifanteva T.I., Shkinev V.M., Spivakov B.Ya., Burba P. Membrane filtration studies of aquatic humic substances and their metal species.//Talanta.-1999.Vol.48.-P. 257-267 63 Шкинев В.М., Трофимов Д.А., Данилова Т.В., Роговая И.В., Моржухина С.В., Карандашев В.К., Спиваков Б.Я. Армированные трековые мембраны в методах оценки качества природной и питьевой воды. //Журнал аналит. химии.- 2008 г.- Т.63.- №4.- С.363-370 64 Лаугалене Н.Ф., Веса В.С., Янкявичене Р.Н., Пуоджюте С.П., Суджювене О.Ф., Песлякас И.И., Хадуев С.Х., Берёзов Т.Т. Новый метод очистки L-лизин--оксидазы гриба Trichoderma. // Вопр. мед. химии.-1990 г.-№ 4.-С.88-90 65 Терещенко Г.Ф., Путилов А.В. Перспективы создания и внедрения новых технологий для производства химической продукции в России. Доклад на Российском конгрессе «Химическая промышленность на рубеже веков: итоги и перспективы». Крит, технол. Мембраны, 1999 г., №3, С.31-44. Рус 66 Бардин В.В., Ягупольский Ю.Л. (Под ред. Л.С. Германа, С.М. Земскова). // Наука, Новосибирск, 1987 г. С. 63 67 Альбертсон П. О. Разделение клеточных частиц и макромолекул. … - М.: Мир, 1974 г. С. 9 68 Сергиевский В.В., Джакупова Ж.Е., Шкинев В.М., Спиваков Б.Я.// Ж. общ. хим. –1994 г. –Т. 64. –Вып. 1. – С. 23-25 88