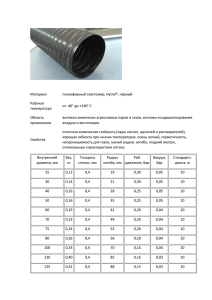
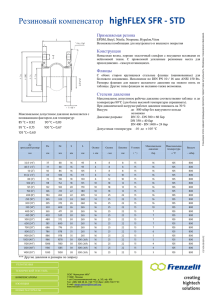
ГАЗОВЫЕ ЗАКОНЫ В стальном баллоне ёмкостью 12 л
реклама

ГАЗОВЫЕ ЗАКОНЫ 1. В стальном баллоне ёмкостью 12 л находится кислород под давлением 141,5 бар при 0оС. Какой объём (м3) займет тот же газ при нормальных условиях? 2. 56 г азота под давлением 4,052 бар занимают объём 10 л. Какое нужно применить давление, чтобы концентрация азота стала 0,3 моль/л при условии, что температура осталась неизменной? 3. При 18оС давление в баллоне с азотом 16,21 бар. При какой температуре давление возрастёт в два раза? 4. Привести объём газа к нормальным условиям, если известно, что при 22оС и давлении 95940 Н/м2 объём его равен 20 л. 5. Определить давление (бар), под которым будут находиться 13,5 г монооксида углерода в сосуде ёмкостью 8 л при 150оС. 6. Сколько м3 СО2 при 22оС и давлении 99280 Н/м2 можно получить при обжиге 1000 кг известняка с содержанием 90% СаСО3? 7. Найти общее давление газов в сосуде ёмкостью 200 л, если в нём при 135 оС содержится смесь 82,1 г бензола и 23,6 г толуола. 8. Сухой воздух имеет следующий объёмный состав: азот – 78,09%, кислород – 20,95%, аргон – 0,93%, диоксид углерода – 0,03%. Определить массу 40 м3 сухого воздуха при 22оС и нормальном давлении. 9. Сухой воздух имеет следующий объёмный состав: азот – 78,084%, кислород – 20,946%, аргон – 0,932%, диоксид углерода – 0,038%. Рассчитать парциальные давления этих газов, если атмосферное давление равно 740 мм рт. ст. 10. Вычислить среднюю квадратичную скорость движения молекул кислорода при 0оС. 11. Определить, при какой температуре (оС) средняя квадратичная скорость движения молекул азота будет равна 1000 м/с. 12. Рассчитайте давление, под которым находятся 32 г кислорода в объеме 0,6 л при температуре 20˚С, считая: а) газ идеальным; б) считая газ реальным (постоянные уравнения Ван-дер-Ваальса а=1,36 л2·атм·моль-2; в=0,03183 л·моль-1). Поясните различие между двумя результатами.