Э4-51 - МГТУ им. Н. Э. Баумана
реклама
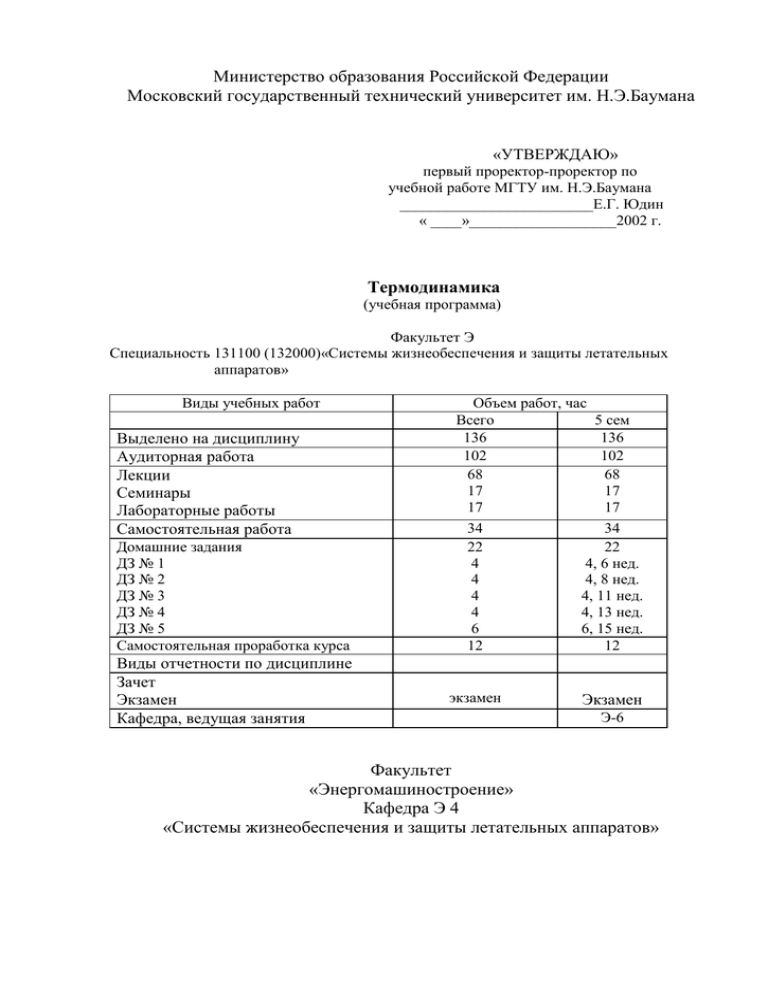
Министерство образования Российской Федерации Московский государственный технический университет им. Н.Э.Баумана «УТВЕРЖДАЮ» первый проректор-проректор по учебной работе МГТУ им. Н.Э.Баумана _________________________Е.Г. Юдин « ____»___________________2002 г. Термодинамика (учебная программа) Факультет Э Специальность 131100 (132000)«Системы жизнеобеспечения и защиты летательных аппаратов» Виды учебных работ Выделено на дисциплину Аудиторная работа Лекции Семинары Лабораторные работы Самостоятельная работа Домашние задания ДЗ № 1 ДЗ № 2 ДЗ № 3 ДЗ № 4 ДЗ № 5 Самостоятельная проработка курса Виды отчетности по дисциплине Зачет Экзамен Кафедра, ведущая занятия Объем работ, час Всего 5 сем 136 136 102 102 68 68 17 17 17 17 34 22 4 4 4 4 6 12 34 22 4, 6 нед. 4, 8 нед. 4, 11 нед. 4, 13 нед. 6, 15 нед. 12 экзамен Экзамен Э-6 Факультет «Энергомашиностроение» Кафедра Э 4 «Системы жизнеобеспечения и защиты летательных аппаратов» Раздел 1. Цели и задачи дисциплины Основные цели дисциплины: подготовка специалистов к научноисследовательской работе и конструированию энергетического и тепломассообменного оборудования различного назначения. Задачи дисциплины – приобретение знаний, умений и навыков, необходимых при выполнении термодинамических и тепломассообменных расчетов, научно-исследовательских и проектно-конструкторских задач, связанных с расчетом и проектированием теплоэнергетических машин и тепломассообменного оборудования систем кондиционирования. Профессиональные навыки, умения и знания, приобретаемые в результате изучения дисциплины. 1. 2. 3. 4. 5. Навыки и умения. Студент должен уметь: Сформулировать цель рассматриваемой проблемы, связанной с расчетом и проектированием энергетических установок различного назначения. Разработать физическую модель процесса. Выполнять расчеты состава газовых смесей, термодинамических процессов, газовых и паровых циклов, фазового равновесия многокомпонентной реальной смеси, а также термодинамический расчет сопел. Согласовать параметры тепломассообменных процессов с общими конструктивными решениями систем кондиционирования. Оценить эффективность работы различных энергетических установок и аппаратов. Знания. Студент должен знать: 1. Законы: 1. Фундаментальные законы о превращениях энергии в различных термодинамических процессах, первое и второе начала термодинамики, законы истечения, парообразования и дросселирования. 2. Законы фазовых преобразований в многокомпонентных системах. 3. Характеристики: а) теплофизические характеристики сред; б) характеристики, параметры и функции состояния; в) характеристические функции и дифференциальные уравнения; г) характеристики газовых смесей, их состав; д) характеристики термодинамических процессов, циклов и их эффективности; е) характеристики реальных рабочих веществ; ж) характеристики тепловых и холодильных машин; з) характеристики сложных термодинамических систем с фазовыми превращениями. 4. Понятия: Термодинамическая система: простая, сложная, закрытая, открытая, изолированная, гомогенная и гетерогенная. Энергия, работа, теплота, энтальпия, внутренняя энергия, энергия Гельмгольца и Гиббса, энтропия, теплоемкость, процесс, цикл, КПД, фазовое равновесие, дросселирование, агрегатное состояние. 5. Методики: а) расчета газовых смесей, теплоемкостей, термодинамических процессов, параметров и функций состояния; б) расчета газовых и паровых циклов; в) расчета равновесного состава химически реагирующих смесей; г) расчета газодинамических и геометрических параметров в процессах истечения и дросселирования. д) расчета эффективности энергетических машин и установок. 6. Приборы и оборудование: а) приборы для измерения теплофизических характеристик твердых и подвижных сред, газового анализа смеси газов; б) приборы для измерения температур, давлений, скоростей, расходов жидкостей и плотностей тепловых потоков. Основные исходные, профессиональные и интеллектуальные навыки, умения, знания, необходимые для изучения дисциплины. Изучению данной дисциплины предшествует подготовка студентов по высшей математике, информатике, физике, химии. При изучении указанных дисциплин студенты получают фундаментальную подготовку, основные исходные профессиональные и интеллектуальные навыки, умения и знания, необходимые для успешного усвоения данной дисциплины. В процессе изучения дисциплины используются технические средства обучения, персональные ЭВМ, комплекс учебно-лабораторных установок, обеспечивающих экспериментальное подтверждение изучаемых законов и процессов. Применяются активные формы обучения, включающие семинарские и лабораторные занятия, выполнение расчетных домашних заданий, самостоятельную работу студентов под контролем преподавателя. Текущий контроль качества усвоения материала осуществляется путем индивидуального собеседования преподавателя со студентами по результатам лабораторных работ, при приеме домашних заданий, при выполнении самостоятельной работы студентов под контролем преподавателя. Раздел 2 Содержание дисциплины – 68 часов 1. Введение – I час. Краткие исторические сведения о развитии термодинамики. Первое и второе начала термодинамики. Термодинамика – наука об энергетических преобразованиях. Роль российских и иностранных ученных в развитии термодинамики. Место термодинамики в ряду естественных научных дисциплин. 2. Основные понятия и определения термодинамики – 4 час. Термодинамическая система – определение. Работа и теплота – формы энергетического взаимодействия. Гомогенная, гетерогенная, простая, сложная, адиабатная, закрытая, изолированная термодинамическая системы. Простая система – предмет изучения технической термодинамики. Объем, удельный объем и плотность вещества. Механическое равновесие, абсолютное и избыточное давления. Единицы измерения давления. Тепловое равновесие. Нулевой закон термодинамики. Температура – общее свойство тел, находящихся в тепловом равновесии. Шкалы температуры: Цельсия, Кельвина, Фаренгейта и Рэнкина. Взаимозависимость объема, давления с температурой. Физическая и техническая атмосферы. Нормальные физические и технические условия. Объем, давление и температура – параметры, характеризующие состояние простой гомогенной термодинамической системы. Равновесный и неравновесный процессы. Термодинамический процесс. Прямой и обратный циклы. Алгебраическое выражение для количественной оценки передачи энергии в форме механической работы (работы деформации объема). Иллюстрация работы в системе координат объем – давление (в диаграмме состояния). Работа процесса и располагаемая работа – функции процесса. Работа цикла. Алгебраическое выражение для количественной оценки теплоты как одной из форм энергетического взаимодействия в термодинамической системе. Единицы измерения теплоты: калория, джоуль, британская термическая единица (ВТИ). Теплоемкость. Опыт Джоуля. Эквивалентность теплоты и работы. Теплота – функция процесса. Физическая сущность теплоемкости. Массовая, объемная и мольная теплоемкости. Зависимость теплоемкости от характеристики процесса. Теплоемкости в термодинамических процессах при постоянных давлении или объеме. Абсолютные (истинные и средние теплоемкости от нуля градусов Цельсия до некоторой текущей температуры и в произвольном диапазоне температур. Некоторые экспериментальные методы определения теплоемкостей. Таблицы теплоемкостей. 3. Первое начало термодинамики – 6 час. Внутренняя энергия – введение в термодинамику и физическая сущность. Единицы измерения внутренней энергии. Внутренняя энергия – функция и параметр состояния термодинамической системы. Закон сохранения и превращения энергии и его математическая формулировка для изолированной системы. Формы энергетического взаимодействия в закрытой изолированной системе. Алгебраическое выражение первого начала термодинамики для закрытой изолированной системы. Эквивалентность закона сохранения и превращения энергии и первого начала термодинамики. Некоторые другие формулировки первого начала термодинамики. Формула для определения изменения внутренней энергии в термодинамических процессах. Опыт Джоуля – экспериментальное доказательство закона сохранения и превращения энергии. Вечный двигатель первого рода. Энтальпия – введение в термодинамику и физическая сущность. Энтальпия – функция и параметр состояния. Формула первого начала термодинамики через энтальпию и располагаемую работу. Связь энтальпии с внутренней энергией. Формула для расчета изменения энтальпии в термодинамических процессах. Открытая термодинамическая система – схема и характеристика происходящих в ней процессов энергетического взаимодействия. Работа проталкивания вещества – эквивалент располагаемой работы. Аналитическое выражение первого начала термодинамики для открытой изолированной системы. 4. Идеальный газ – рабочее вещество термодинамической системы – 6 час. Характеристики идеального газа. Обоснование использования понятий “идеальный газ” в термической термодинамике. Экспериментальные законы Бойля-Мариотта, Гей-Люссака и Шарля (Джоуля). Уравнение состояния (или характеристическое уравнение, или уравнение Клаперона). Уравнение Клапейрона для m кг удельного газа. Закон Авогадро. Объем моля: его значения для нормального физического и технического условий. Уравнение Клапейрона-Менделеева. Универсальная газовая постоянная. Опыт Гей-Люссака. Внутренняя энергия и энтальпия идеального газа – функция одной только температуры. Элементы молекулярно-кинетической теории. Совершенный газ. Уравнение Роберта Майера. Объем, температура и давление смеси идеальных газов. i–ый компонент смеси: его массовая и объемная доли, парциальное давление. Закон Дальтона. Две формы уравнения состояния для i-го компонента. Газовая постоянная смеси. Характеристическое уравнение для смеси. Число термодинамических параметров (независимых переменных), характеризующих состояние смеси. Определение объема, температуры и давления смеси через исходные данные газов, участвующих в процессе смешения. Внутренняя энергия и энтальпия смеси. Массовая, объемная и мольная теплоемкости смеси. Закон Роберта Майера для смеси идеальных газов. Таблица наиболее характерных соотношений смеси. Методика их вывода и примеры использования в инженерной практике. Выбор характеристики процесса энергетического взаимодействия между рабочим веществом и окружающей средой термической системы. Её анализ и иллюстрация в диаграмме состояния. Показатель адиабаты. Связи теплоты и работы с изменением функции состояния (внутренней энергии и энтальпии) в термодинамических процессах идеального газа. Характеристика политропного процесса и ее представление в диаграмме объем–давление. Уравнение политропы в независимых переменных объем–давление, температура–давление и объем–температура. Изохорный, изобарный, изотермический и адиабатный процессы – частные случаи политропного процесса. Теплоемкость вещества в политропном процессе. Техническая политропа. Иллюстрация и анализ термодинамических процессов в диаграмме состояния. Возможность идеализации произвольного процесса с помощью политроп – метод, широко используемый в инженерной практике. 5. Второе начало термодинамики – 4 час. Иллюстрация и исследование прямого цикла Карно в диаграмме состояния. Верхний и нижний источники теплоты. Температуры верхнего и нижнего тепловых источников. Термический коэффициент полезного действия (КПД) цикла Карно. Независимость КПД цикла Карно от природы рабочего вещества. Анализ теоремы Карно. Сравнение эффективности цикла Карно с произвольным циклом, осуществляемыми в одном и том же диапазоне изменения температур верхнего и нижнего источников. Невозможность преобразования теплоты в работу в цикле с одним источником теплоты (вечный двигатель второго рода) – один из постулатов второго начала термодинамики. Неадекватность процессов преобразования теплоты в работу и работы в теплоту. Представление в диаграмме состояния прямого произвольного цикла множеством элементарных циклов Карно. Интегрирующий множитель. Введение энтропии по Клаузиусу. Энтропия – функция состояния. Выражение энтропии идеального газа в зависимости от объема и давления, объема и температуры, и от температуры и давления. Тепловая диаграмма (энтропия – абсолютная температура) идеального газа. Построение произвольного, термодинамического процесса в тепловой диаграмме. Условная точка отсчета энтропии. Использование формулы для площади трапеции при определении теплоты процесса по диаграмме. Анализ погрешности. Знак теплоты. Обоснование целесообразности использования тепловой диаграммы идеального газа в теплотехнических расчетах. Построение изохорного, изобарного, изотермического, адиабатного и политропного процессов в тепловой диаграмме. Идеальный адиабатный процесс – изоэнтропный процесс. Графическое определение изменения внутренней энергии и энтальпии произвольного термодинамического процесса. Использование формулы для площади трапеции при вычислений абсолютных значений i и I. Правило знаков при графическом определении изменения внутренней энергии и энтальпии. Определение показателя политропы по тепловой диаграмме. Формулировки второго начала динамики по Клаузиусу и Томсону. Доказательство их аналогичности. Возрастание энтропии при протекании адиабатных процессов в изолированной термодинамической системе. Энтропия необратимых процессов. Трактовка второго начала термодинамики по Больцману. Энтропия и термодинамическая вероятность. Философские аспекты сущности энтропии. 6. Свободная энергия (функция Гельмгольца) и термодинамический потенциал (функция Гиббса) – 2 часа Введение функций Гельмгольца и Гиббса в термодинамику по результатам опыта Джоуля о эквивалентности теплоты и работы. Свободная энергия и термодинамический потенциал – функции состояния. Связь функции Гельмгольца с внутренней энергией. Аналитическое выражение первого начала термодинамики через свободную энергию и работы процесса. Термодинамический потенциал и энтальпия. Аналитическое выражение первого начала термодинамики через функцию Гиббса и располагаемую работу. 7. Характеристические функции – 2 часа Определение характеристических функций и их роль в построении математического аппарата термодинамики. Внутренняя энергия – функция четырех переменных: объем, давление. Энтропия и температура. Внутренняя энергия – характеристическая функция двух независимых переменных: объем и энтропия. Выражение давления и температуры через частные производственные внутренней энергии по обьему и энтропии. Функции состояния – энтальпия, энтальпия, свободная энергия, термодинамический потенциал, температура, давление и объем – характеристические функции. Методика определения независимых переменных, обращающих функции состояния в характеристические функции. Соотношения Максвелла. 8. Дифференциальные уравнения термодинамики – 4 часа Значение дифференциальных соотношений в математиком исследовании характеристик энергетического взаимодействия реальных рабочих веществ с окружающей средой термодинамической системы. Полные дифференциалы функций состояния в зависимости от произвольной пары независимых переменных; объем – давление, температура – объем и объем – температура. Термические коэффициенты упругости, расширяемости и сжимаемости. Уравнение Роберта Майера для реального рабочего вещества. Таблица Бриджмена. 9. Реальные газы – рабочее тело энергетических машин – 10 часов Основные характеристики реальных газов: возможность фазовых переходов, сжимаемость. Уравнение Ван дер Ваальса и методика его получения. Уравнения состояния Бертло, Дитеричи, Клаузиуса и др. Построение и анализ семейства изотерм Ван дер Ваальса в диаграмме состояния. Критическая точка. Безразмерная форма уравнения Ван дер Ваальса. Параболы Бойля, инверсии и идеальная парабола. Коэффициент сжимаемости. Понятие о вириальных уравнениях состояние реальных газов. Фазовая диаграмма (на примере воды в трех её фазовых состояниях) твердого, жидкого, газообразного и сверхкритического состояний вещества. Тройная и критическая точки в фазовой диаграмме. Взаимозависимость термодинамических параметров по линиям насыщения (конденсации), плавления (затвердевания) и сублимации (десублимации). Перспективы исследований поведения реальных веществ при экстремальных значениях температуры и давления. Сухость. Пограничные кривые. Область насыщенного пара в диаграмме состояния. Метастабильные и неустойчивые состояния. Закон аддитивности. Построение линий постоянной сухости. Методика расчета термодинамических параметров и процессов реального вещества в области насыщения. Таблицы насыщенного пара. Таблицы перегретого пара. Элементы теории критического и сверхкритического состояний реальных веществ. Схема построения семейства изобар реального газа в тепловой диаграмме. Необходимые данные по теплоемкости. Выбор пути интегрирования энтропии по давлению и температуре для получения формул S = f (Т,Р). Точка отчета энтропии. Условное равенство нулю внутренней энергии и энтропии при параметрах тройной точки жидкой фазы исследуемого вещества в состоянии насыщения. Пограничные кривые и линии постоянной сухости в тепловой диаграмме. Скрытая теплота парообразования; её анализ и физическая сущность. Формы и содержание тепловых диаграмм для некоторых реальных веществ, используемых в энергетике. Диаграмма Молье (энтальпия – энтропия диаграммы). Обоснование её использования при теплотехнических расчетах. Методика построения линий постоянного давления, объема, температуры и сухости в диаграмме Молье. 10.Истечение и дросселирование – 4 часа Общее описание процесса истечения из сосуда «неограниченной» емкости. Уравнение неразрывности для сплошного потока вещества. Определение скорости истечения и расхода идеального рабочего вещества. Критическое отношение давлений. Критические скорость и расход. Местная скорость звука. Число Маха. Течение газа по насадку переменной геометрии. Сопло Лаваля. Идеализация процесса истечения адиабатным процессом. Анализ погрешности. Определение скорости истечения и расхода реальных газов. Дросселирование: общая характеристика процесса. Температура торможения. Дифференциальный дроссель-эффект. Коэффициент свободного расширения. Идеальный газ – вещество с нулевым дроссель - эффектом и коэффициентом свободного расширения. Использование диаграммы Молье для расчета процессов истечения и дросселирования. Элементы теории истечения из сосуда ограниченной емкости. 11.Компрессор и тепловые машины – 6 часов Механизм сжатия газов и конструкция поршневого и турбо – компрессов. Индикаторная диаграмма. Цикл идеального компрессора. Работа, затрачиваемая на привод компрессора. Цикл компрессора с «вредным» пространством. Объемный коэффициент полезного действия. Многоступенчатое сжатие. Определение оптимальных промежуточных давлений по ступеням сжатия. Поршневые четырехкратные двигатели внутреннего сгорания (ДВС), конструкция и принцип преобразования теплоты сгорания топлива в работу. Индикаторная диаграмма ДВС. Цикл ДВС с подводом теплоты при постоянном объеме (цикл Отто), с подводом теплоты при постоянном давлении (цикл Дизеля) и со смешанным подводом теплоты. Их термические коэффициенты полезного действия. Сравнение эффективности карбюраторного ДВС с двигателем Дизеля. Газотурбинная установка (ГТУ) – схема и механизм преобразования теплоты в работу. Преимущества ГТУ по сравнению с ДВС. Цикл ГТУ с подводом теплоты при постоянном давлении и объеме. Термический коэффициент полезного давления. Жидкостной и твердотельный реактивные двигатели. Устройство, идеальный цикл, КПД. Паровой двигатель и паротурбинная установка: схема и механизм работы. Возможность осуществления в паровых машинах преобразования теплоты в работу по циклу Карно. Цикл Рэнкина и его термический КПД. Анализ некоторых методов повышения эффективности тепловых двигателей. СПЕЦИАЛЬНЫЕ ГЛАВЫ ТЕРМОДИНАМИКИ 12.Холодные установки и термотрансформаторы – 4 часа Обратный цикл Карно. Хладоагент. Холодопроизводительность. Холодильный коэффициент обратного цикла Карно и его сравнение с коэффициентом полезного действия прямого цикла Карно. Воздушная холодильная установка. Схема, принцип работы и ее идеализированный цикл. Холодильный коэффициент. Сравнение эффективности воздушной холодильной установки с эффективностью эквивалентного обратного цикла Карно. Регенерация теплоты – один из методов повышения эффективности воздушной холодильной установки. Парокомпрессионная холодильная установка. Схема и принцип работы. Используемые хладоагенты и их краткая тепловая характеристика. Возможность упрощения конструкции и металлоемкости по сравнению с воздушной холодильной машиной. Идеализированный цикл и холодильный коэффициент парокомпрессионной холодильной машины. Некоторые методы повышения эффективности парокомпрессионной установки. Пароэжекторная холодильная установка. Схема и принцип работы. Характеристика хладоагента. «Условный цикл». Коэффициент теплоиспользования. Абсорбционная холодильная установка. Хладоагенты. Схема и принцип работы. Коэффициент теплоиспользования. Эффекты Зеебека и Пельтье. Термоэлектрическая холодильная установка. Схема и принцип работы. Холодильный коэффициент. Каскадная холодильная установка. Схема и принцип работы. Тепловые характеристики и свойства используемых хладоагентов. Идеализированный цикл каскадной установки и ее общий холодильный коэффициент. Тепловой насос. Отопительный коэффициент. Понижающий и повышающий термотрансформаторы. Схема и принцип работы. Коэффициент трансформации теплоты. Возможности и перспективы использования термотрансформаторов в инженерной практике. 13.Влажный воздух – 6 часов Основные понятия и определения. Влажный воздух – смесь воздуха с водой в различных ее фазовых состояниях. Ненасыщенный влажный воздух – смесь идеальных газов. Влагосодержание, молярное влагосодержание. Связь влагосодержания с парциальным давлением водяного пара. Влагосодержание и мольное влагосодержание в состоянии насыщения. Абсолютная и относительная влажность. Степень насыщения. Связь относительной влажности со степенью насыщения. Использование паровых таблиц для расчетов параметров влажного воздуха. Смешение влажного воздуха с водой. Температура адиабатного насыщения. Психрометр. Температура "сухого" и "мокрого" термометров. Влагосодержание – энтальпия диаграмма. Построение линий относительной влажности. Области ненасыщенного влажного воздуха, тумана, влажного и ледяного туманов, в диаграмме влагосодержание – энтальпия. Линии "сухого" и "мокрого" термометров в d-i - диаграмме. Кривая парциального давления. Диаграмма влажного воздуха для различных барометрических давлений. Процесс нагрева (охлаждение) влажного воздуха. Аналитическое и графическое исследования процессов смешения потоков влажного воздуха. Графическое интерпретация добавки воды или водяного пара к влажному воздуху. Процесс сушки и некоторые методы его интенсификации. Элементы теории кондиционирования воздуха. 14.Фазовое равновесие – 4 часа Многокомпонентная термодинамическая система с фазовыми неоднородностями. Две фундаментальные теоремы. Химический потенциал. Условия равновесия по Гиббсу. Условный экстремум. Функция Лагранжа. Правило фаз Гиббса. Теорема Эйлера для гомогенных функций. Уравнения Гиббса-Дюгема. Уравнение Клапейрона-Клаузиуса и его физическая интерпретация. Фазовые переходы 1-го и 2-го родов. Уравнения Эренфеста. Химический потенциал идеального газа и i-го компонента смеси идеальных газов. Фугитивность и активность. Коэффициент активности и его связь с фугитивностью. Некоторые методы определения фугитивности чистого вещества. Правило Льюиса. 15.Элементы теории растворов диэлектриков – 5 часов. Термодинамическое классификация растворов. Химический потенциал i-го компонента раствора. Законы Генри и Рауля. Термодинамические функции смешения. Температура кипения (замерзания) раствора. Эбуллиоскопическая постоянная. Фазовые диаграммы концентрация – температура и концентрация – давление бинарных растворов. Основные процессы в растворах. 2.1 Семинары (17 час.). № упражнения 1 2 3 4 5 6 7 8 9 Тема практического занятия Параметры состояния Газовые смеси и теплоемкости Первый закон термодинамики, аналитический и графический расчет газовых процессов Расчет газовых циклов Расчет процессов истечения и дросселирования Расчет паровых циклов: аналитический, графический по P--V, T--S и H--S -диаграммам и с использованием таблиц Расчет холодильных установок Процессы во влажном воздухе и растворы диэлектриков 2.2. Лабораторные работы (17 часов) № Наименование лабораторной работы Исследование индикаторной диаграммы компрессора Определение изобарной теплоемкости воздуха Адиабатное истечение воздуха через сужающееся сопло Исследование термодинамических процессов во влажном воздухе Определение К.П.Д. тепловой машины 1 2 3 4 5 2.3 Самостоятельная работа (34 час.) а) Домашние задания (22 час.) № 1 2 3 4 5 Наименование домашних заданий Расчет параметров газовой смеси (4 час.) Расчет газового цикла (4 час.) Термодинамический расчет сопла (4 час.) Расчет парового цикла (4 час.) Расчет цикла холодильных машин (6 час.) б) Самостоятельная проработка курса (12 час.) 3.УЧЕБНО-МЕТОДИЧЕСКАЯ ЛИТЕРАТУРА ПО ДИСЦИПЛИНЕ 3.1. Основная литература 1. Техническая термодинамика. Учебник для вузов (под ред. В.И.Крутова) 3ое изд. М.: Высшая школа, 1991. 2. Теория тепломассообмена. Учебник для вузов (под ред.А.И.Леонтьева) 2-е изд. М.: МГТУ им. Н.Э. Баумана, 1997. 3. Задачник по технической термодинамике и теории тепломассообмена. Учебное пособие для машиностроительных вузов (под ред.В.И.Крутова и Г.Б.Петражицкого) М.: Высшая школа, 1986. 4. Лабораторный практикум по термодинамике и теории тепломассообмена. Учебное пособие для вузов (под ред.В.И.Крутова и Е.В.Шишова) М.:Высшая школа, 1988. 5. Исаев С.И. Термодинамика. 3-е изд. М.: МГТУ им. Н.Э. Баумана, 2000. 3.2. Дополнительная литература 1. Базаров И.П. Термодинамика. Учебник для вузов. М.: Высшая школа, 1983. 2. Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. Учебник для вузов 4-ое изд. М.: Энергоатомиздат, 1983. 3. 3. Теплотехника. Учебник для ВУЗов (под ред. В.И. Крутова). М.: Машиностроение. 1986. 3.3. Перечень пособий. 1. Для демонстрации на лекциях используются наглядные пособия: комплекты плакатов. 2. Для демонстрации на лабораторных работах используется: комплекты плакатов. 3.4. Использование ЭВМ. Для выполнения домашних заданий – 10 часов на ПЭВМ (на каждого студента). Для проведения и обработки результатов лабораторных работ необходимо выделение следующего количества часов на ПЭВМ — 8 часов (на каждого студента). Программа составлена на основании Государственного образовательного стандарта высшего профессионального образования по специальности 131100 (132000) "Системы жизнеобеспечения и защиты летательных аппаратов" Программу составил Доцент, к.т.н. каф. Э-6 Зав.кафедрой Э-6 д.т.н., проф. каф. Э-6 Самойлов М.С. «______»__________г. Хвесюк В.И. «______»__________г. Программа обсуждена и одобрена на заседании кафедры «Системы жизнеобеспечения и защиты летательных аппаратов» Э4 Зав. кафедрой Э4 д.т.н., проф. Архаров А.М. «______»__________г. Программа рассмотрена и одобрена методической комиссией ф-та «Э» Председатель методической комиссии д.т.н., проф. Руководитель НУК «Э» (декан) к.т.н., доцент Начальник методического отдела МГТУ к.т.н., доцент Пластинин П.И. «______»__________г. Суровцев И.Г. «______»__________г. Васильев Н.В. «______»__________г.





