Вопросы к коллоквиуму по теме "Фазовые равновесия"
реклама

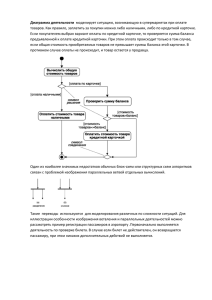
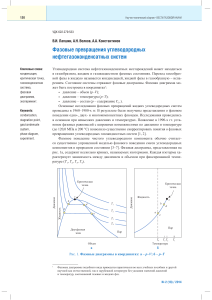
Вопросы к коллоквиуму по теме «Фазовые равновесия» 1. Фазовые равновесия. Фаза. Составляющее вещество системы. Компонент. Термодинамическая степень свободы. Условие термодинамического равновесия в гетерогенной системе. Правило фаз Гиббса и его вывод. 2. Уравнение Клапейрона-Клаузиуса и его применение к различным фазовым переходам первого рода. Фазовые переходы второго рода. 3. Диаграммы состояния однокомпонентных систем. Диаграмма состояния воды при низких и высоких давлениях. 4. Моно- и энантиотропные фазовые переходы. Диаграмма состояния серы: энантиотропный фазовый переход. 5. Моно- и энантиотропные фазовые переходы. Диаграмма состояния фосфора: монотропные фазовые переходы. 6. Диаграммы плавкости двухкомпонентных систем: диаграмма с эвтектикой, диаграммы с конгруэнтно и инконгруэнтно плавящимся химическим соединением. Правило рычага. 7. Диаграммы плавкости двухкомпонентных систем: диаграммы с неограниченной и ограниченной растворимостью компонентов в твердом состоянии. 8. Диаграммы состояния систем из двух ограниченно растворимых жидкостей. 9. Общая характеристика диаграмм состояния трехкомпонентных систем. Графическое изображение состава тройных систем: треугольник Гиббса, треугольник Розебома. 10.Диаграмма растворимости в воде двух солей с одноименным ионом, не образующих кристаллогидратов и двойных солей. 11.Диаграмма плавкости с тройной эвтектикой. 12.Равновесия жидкость - жидкость в трехкомпонентных системах. 13.Распределение растворенного вещества между двумя несмешивающимися растворителями. 14.Экстракция. Степень извлечения. Зависимость степени извлечения от различных факторов. 15.Общая характеристика растворов. Способы выражения концентрации растворов. 16.Парциальные молярные величины. Уравнения Гиббса-Дюгема. 17.Основные методы определения парциальных молярных величин. 18.Термодинамическая классификация растворов. Идеальные и реальные растворы. Три определения идеального раствора. 19.Давление насыщенного пара жидких растворов. Давление насыщенного пара компонента над раствором. Закон Рауля и его термодинамический вывод. Зависимость состава пара от состава раствора. 20.Реальные растворы. Положительные и отрицательные отклонения от закона Рауля, их причины. 21.Активность. Коэффициент активности. Стандарт - состояния при определении химических потенциалов компонентов. Симметричная и несимметричная система стандартных состояний. 22.Понижение температуры замерзания и повышение температуры кипения идеальных и предельно разбавленных растворов. 23.Осмотическое давление идеальных и предельно разбавленных растворов. 24.Методы определения активности и коэффициентов активности компонентов раствора. 25.Диаграммы состояния идеальных летучих смесей и реальных летучих смесей с незначительными отклонениями от закона Рауля. 26.Диаграммы состояния реальных летучих смесей со значительными положительными и отрицательными отклонениями от закона Рауля. 27.Первый и второй законы Гиббса-Коновалова. 28.Перегонка жидких летучих смесей: перегонка в равновесии, фракционная перегонка. Ректификация. 29.Диаграммы состояния ограниченно растворимых летучих смесей (без гетероазеотропа и с гетеоазеотропом). 30.Диаграммы состояния практических нерастворимых летучих смесей. Перегонка с водяным паром.