Общая характеристика IVA группы Периодической системы
реклама

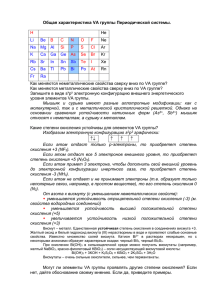
Общая характеристика IVA группы Периодической системы. В IVA группе находятся самые важные элементы, без которых не было бы ни нас, ни Земли, на которой мы живем. Это углерод – основа всей органической жизни, и кремний – «монарх» царства минералов. H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Ga Ge As Se Br Kr Rb Sr In Sn Sb Te I Xe Cs Ba Tl Pb Bi Po At Rn Fr Ra Как меняются неметаллические свойства сверху вниз по IVA группе? Как меняются металлические свойства сверху вниз по IVA группе? Запишите в виде sxpy электронную конфигурацию внешнего уровня элементов IVA группы Если углерод и кремний – типичные неметаллы, а олово и свинец – металлы, то германий занимает промежуточное положение. Одни учебники относят его к неметаллам, а другие – к металлам. Он серебристо-белого цвета и внешне похож на металл, но имеет алмазоподобную кристаллическую решетку и является полупроводником, как и кремний. Хорошо известны две аллотропные модификации олова: Серое олово (-форма) существует при температуре ниже 13,2С, имеет алмазоподобную структуру, проявляет полупроводниковые свойства. Это очень хрупкое вещество с плотностью 5,846 г/см3. Белое олово (-форма) устойчиво выше 13,2оС. Типичный металл серебристо-белого цвета, хорошо проводит тепло и электрический ток, пластично, плотность 7,295 г/см3. При переходе -формы в -форму значительно (на 25%) увеличивается удельный объем металла, который при этом рассыпается в порошок. Тпл, оС C Si Ge Sn 4100 1420 945 232 Почему температуры простых веществ элементов IVA группы понижаются от углерода к олову? Изобразим электронную конфигурацию s2p2 графически: Если атом отдаст только р-электроны, то приобретет степень окисления +2. Если атом отдаст все 4 электрона внешнего уровня, то приобретет степень окисления +4. Если атом примет 4 электрона, чтобы дополнить свой внешний уровень до электронной конфигурации инертного газа, то приобретет степень окисления -4. Если атом не отдает и не принимает электроны (т.е. образует только неполярные связи, например, в простом веществе), то его степень окисления 0. От углерода к свинцу (с уменьшением неметаллических свойств): уменьшается устойчивость отрицательной степени окисления (-4) уменьшается устойчивость высшей положительной степени окисления (+4) увеличивается устойчивость низкой положительной степени окисления (+2) Олово реагирует с кислородом, галогенами, серой, образуя соединения Sn(IV). Находясь левее водорода в электрохимическом ряду напряжений металлов, растворяется в разбавленных кислотах (правда, медленно), давая соли Sn(II). При нагревании взаимодействует с растворами щелочей: Sn + 2NaOH + 2H2O = Na2[Sn(OH)4] + H2 (также образуется Na4[Sn(OH)6]) Свинец - темно-серый металл, более активный, чем олово. При взаимодействии с кислородом, галогенами, серой образует соединения Pb(II). Хорошо растворяется в кислотах, с которыми образует растворимые соли, а при нагревании – в растворах щелочей (аналогично олову). Образование окрашенных осадков солей свинца (желтый PbI2, черный PbS, желтый PbCrO4) используется в химическом анализе. Могут ли элементы IVA группы проявлять другие степени окисления? Если нет, дайте обоснование своему мнению. Если да, приведите примеры. Свойства оксидов и гидроксидов элементов IVА группы кислотно-основные свойства оксидов и гидроксидов кислотамфотер- основный несолеобраный ный зующий растворимость оксидов и гидроксидов в воде раствомалорастнерастрим ворим ворим кислотно-основные свойства оксидов и гидроксидов кислотамфотер- основный несолеобраный ный зующий растворимость оксидов и гидроксидов в воде раствомалорастнерастрим ворим ворим С(IV) Si(IV) Ge(IV) Sn(IV) Pb(IV) С(II) Si(II) Ge(II) Sn(II) Pb(II) Ярко окрашенные соединения свинца находят применение в качестве основы красок: PbO – желтый («глет») или красный, в зависимости от кристаллической модификации. Pb3O4 – ярко-красный («сурик»). PbCrO4 (хромат свинца) – желтый (краска «хромовая желтая») Pb(OH)22PbCO3 или (PbOH)2CO3 (основной карбонат свинца) – белый («свинцовые белила») Свойства водородных соединений элементов IVA группы элемент C Si Ge Sn Pb водородные СnHm SinH2n+2 GenH2n+2 SnH4, Sn2H6 PbH4 соединения (до Ge9H20) названия водородных соединений силаны ? германы станнаны плюмбан Падает устойчивость* Уменьшается многообразие** *Подобно водородным соединениям мышьяка, герман легко разлагается при пропускании через нагретую стеклянную трубку, образуя на стенках «зеркало» металла. Устойчивость станнана и плюмбана еще ниже. **«Заполните» в приведенной выше таблице графу, в которой стоит знак вопроса. Перечислите названия всех классов водородных соединений углерода, которые Вам известны, и приведите их общие формулы. Т.к. элементы IVA группы имеют небольшие значения электроотрицательности, они неспособны образовывать в соединениях водородную связь. -40 SnH4 -60 GeH4 -80 SiH4 Т кип. -100 -120 -140 CH4 -160 -180 0 10 20 30 40 порядковый номер элемента 50