«Оксиды»
реклама
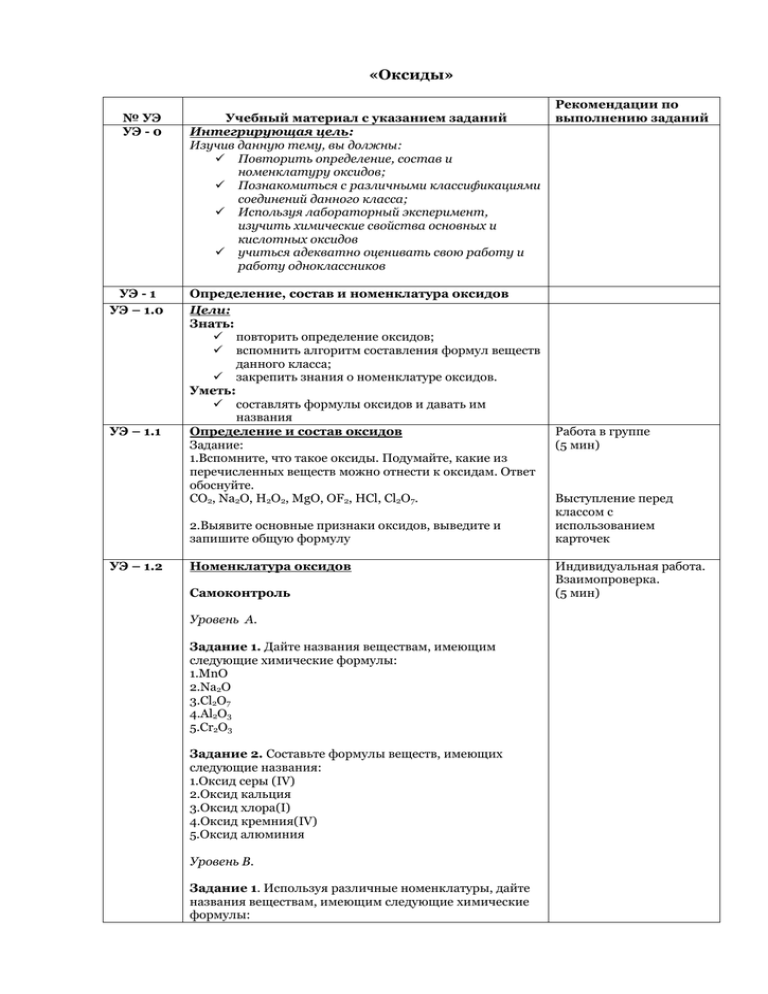
«Оксиды» № УЭ УЭ - 0 Учебный материал с указанием заданий Интегрирующая цель: Изучив данную тему, вы должны: Повторить определение, состав и номенклатуру оксидов; Познакомиться с различными классификациями соединений данного класса; Используя лабораторный эксперимент, изучить химические свойства основных и кислотных оксидов учиться адекватно оценивать свою работу и работу одноклассников УЭ - 1 УЭ – 1.0 Определение, состав и номенклатура оксидов Цели: Знать: повторить определение оксидов; вспомнить алгоритм составления формул веществ данного класса; закрепить знания о номенклатуре оксидов. Уметь: составлять формулы оксидов и давать им названия Определение и состав оксидов Задание: 1.Вспомните, что такое оксиды. Подумайте, какие из перечисленных веществ можно отнести к оксидам. Ответ обоснуйте. CO2, Na2O, H2O2, MgO, OF2, HCl, Cl2O7. УЭ – 1.1 2.Выявите основные признаки оксидов, выведите и запишите общую формулу УЭ – 1.2 Номенклатура оксидов Самоконтроль Уровень А. Задание 1. Дайте названия веществам, имеющим следующие химические формулы: 1.MnO 2.Na2O 3.Cl2O7 4.Al2O3 5.Cr2O3 Задание 2. Составьте формулы веществ, имеющих следующие названия: 1.Оксид серы (IV) 2.Оксид кальция 3.Оксид хлора(I) 4.Оксид кремния(IV) 5.Оксид алюминия Уровень В. Задание 1. Используя различные номенклатуры, дайте названия веществам, имеющим следующие химические формулы: Рекомендации по выполнению заданий Работа в группе (5 мин) Выступление перед классом с использованием карточек Индивидуальная работа. Взаимопроверка. (5 мин) 1.CaO 2.CrO 3.CO 4.NiO 5.PbO2 Задание 2. Составьте формулы веществ, имеющих следующие названия: 1.Оксид бария 2.Оксид хрома(VI) 3.Монооксид азота 4.Диоксид марганца 5.Оксид калия Оцените свою работу по УЭ – 1 по 5-балльной системе УЭ – 1.3 УЭ - 2 УЭ – 2.0 УЭ – 2.1 Работа в группе (5 мин) Классификация оксидов Цели: Знать: классификацию оксидов по составу, физическим и химическим свойствам Уметь: приводить примеры оксидов………. давать характеристику оксидов, используя различные признаки классификации Классификация оксидов Прочтите учебный текст и выполните задания Классификация оксидов по составу При взаимодействии металлов и неметаллов с кислородом образуются оксиды металлов и неметаллов Запишите схему в тетрадь. ОКСИДЫ (по составу) Приведите примеры Если в основу классификации взять агрегатное состояние веществ, то оксиды можно разделить на газообразные, жидкие и твёрдые. Запишите схему в тетрадь ОКСИДЫ (по физическим свойствам) Газообразные Приведите примеры Твердые Жидкие Работа в группе(10 мин). Если возникли трудности, обратитесь к учителю. Если в основу классификации положить другой признак – химические свойства оксидов, то можно выделить основные, амфотерные и кислотные оксиды. Результат проверьте по ключу Запишите схему в тетрадь ОКСИДЫ (по химическим свойствам) Приведите примеры Самоконтроль Задание 1.: проверьте, как вы усвоили материал, выполнив задание «Закончите предложение» 1.Солеобразующие оксиды делятся на …, … и … 2.Все основные оксиды по агрегатному состоянию … 3.Большинство кислотных оксидов по агрегатному состоянию … и … вещества. 4.Оксиды, которым соответствуют основания, называются … 5.Оксиды, которым соответствуют кислоты, называются … 2. Дайте характеристику оксида углерода (IV), используя различные признаки классификации Оцените свою работу по 5-балльной системе УЭ - 3 Химические свойства оксидов УЭ – 3.0 Цели: изучить химические свойства основных и кислотных оксидов Взаимодействие основных оксидов с водой Некоторые основные оксиды взаимодействуют с водой и образуют растворимые основания – щёлочи УЭ – 3.1 K2O + H2O = 2KOH BaO + H2O = Ba(OH)2 Задание: проведите лабораторный эксперимент, используя инструктивную карточку №1(приложение 1) Дополнительный материал «Химическая грелка» Известно несколько видов «обыкновенных химических грелок». Устройство их очень простое: обычно это два пакета (маленький и большой) из водонепроницаемого и химически стойкого материала (пленки, ткани). Внутри маленького пакета — вещество или смесь веществ. Чтобы грелка начала работать, сюда надо добавить немного воды и перемешать содержимое пакета. Потом пакет закрывают, вставляют в большой и еще раз тщательно закупоривают; теперь грелкой можно пользоваться. Одна из самых простых химических грелок содержит оксид кальция СаО Проверьте решение задачи по ключу. (негашеную известь), который взаимодействует с водой с образованием гидроксида кальция: СаО + Н2O= Са(ОН)2 Взаимодействие основных оксидов с кислотами Все основные оксиды реагируют с растворами кислот с образованием соли и воды. MgO + H2SO4 = MgSO4 + Н2O Задание: проведите лабораторный эксперимент, используя инструктивную карточку №2(приложение 1) Взаимодействие кислотных оксидов с водой Кислотные оксиды взаимодействуют с водой, образуя кислоты. SO3 + Н2O= H2SO4 Задание: проведите лабораторный эксперимент, используя инструктивную карточку №3(приложение 2) Взаимодействие кислотных оксидов со щелочами Все кислотные оксиды взаимодействуют со щелочами с образованием соли и воды Ba(OH)2 + CO2 = BaCO3 + Н2O Задание: проведите лабораторный эксперимент, используя инструктивную карточку №4(приложение 2) Взаимодействие основных и кислотных оксидов друг с другом Основные и кислотные оксиды взаимодействуют между собой с образованием соли. MgO + SiO2 = MgSiO3 Задание: напишите уравнение реакции между оксидом кальция и оксидом серы (IV), используя алгоритм (приложение 4) Оцените свою работу по 5-балльной системе УЭ - 4 Резюме 1.Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2. 2.Окксиды можно классифицировать по различным признакам ОКСИДЫ (по составу) Металлов Неметаллов ОКСИДЫ (по физическим свойствам) Газообразные Твердые Жидкие ОКСИДЫ (по химическим свойствам) Основные Амфотерные Кислотные 3.Химические свойства оксидов Основный оксид + вода = щелочь Основный оксид + кислота = соль + вода Основный оксид + кислотный оксид = соль Кислотный оксид + вода = кислота Кислотный оксид + щелочь = соль + вода УЭ - 5 Подведение итогов урока 1.Прочитайте еще раз цели урока и ответьте на вопросы: смогли ли вы достичь поставленных целей? в какой степени? что мешало достижению целей? какую оценку поставили себе за урок? 2. Домашнее задание: Подсчитайте общую сумму баллов за урок: если набрано 27 – 30 баллов, Вы отлично освоили тему и готовы к контрольной работе; если набрано 23– 26 баллов, Вам необходимо проработать отдельные темы; если набрано 18 – 22 балла, Вам необходимо тщательно повторить тему Сдайте тетради на проверку. Спасибо за урок!